速递丨靶向YAP介导的T细胞抑制或将改善BRAF突变型黑素瘤患者预后
导读
Hippo-YAP信号通路是肿瘤抑制的一个重要信号通路。新证据表明,YAP活化是黑素瘤BRAF抑制剂(BRAFi)的重要耐药机制,YAP参与抑制抗肿瘤免疫应答。然而,YAP活性对CTL免疫应答的潜在直接影响仍是一个未知领域。
近年来,通过单抗阻断免疫检查点受体PD-1的治疗方式使晚期黑色素瘤患者表现出了显著的临床反应。癌细胞表面PD-L1异常表达是许多肿瘤逃避抗肿瘤免疫应答的重要机制,PD-L1表达是免疫检查点抑制剂有效反应的预测性生物标志物。新研究表明,BRAFi耐药性黑素瘤细胞以PD-L1依赖方式,通过激活YAP,逃避CD8+T细胞免疫应答。
研究方法
首先,获取亲本和BRAFi耐药性SKMEL28和WM3248细胞。获取A375SM细胞并在补充10% FBS的DMEM中培养。获取MCF7,MDA-MB231和A172细胞并在补充10% FBS的DMEM中培养。获取HT29,KM12和A549细胞,并在补充10% FBS的RPMI1640中培养。获取前,通过Sanger测序证实黑色素瘤细胞系BRAFV600E突变。连续处理2μMPLX4032两个月,产生BRAFi耐药性A375SM细胞。在含有2μMPLX4032的培养基中培养BRAFi耐药性细胞系。Sanger测序证实耐药细胞系具有BRAFV600E突变。常规检测细胞系支原体感染。所有细胞系都储存在液氮中,使用前培养不超过6个月。
应用逆转录病毒载体产生稳定表达YAP及其突变体的黑素瘤细胞和HEK293T细胞。制备克隆到pMSCV-puro载体中的FLAG-YAP野生型,FLAG-YAP-5SA和FLAG-YAP-5SA-S94A cDNA,进行逆转录病毒颗粒装配,转染和嘌呤霉素选择。根据制造商说明,应用Lipofectamine RNAiMAX(Invitrogen)获得的siRNA转染细胞。
主要结果
YAP激活可诱导BRAFi耐药性黑素瘤细胞上PD-L1表达
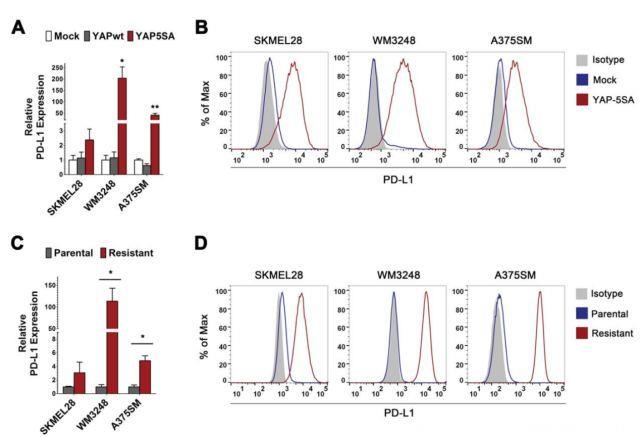
为研究YAP激活对免疫检查点通路的影响,研究人员首先检查了表达组成型活性YAP的黑色素瘤细胞的T细胞共抑制/共刺激配体(PD-L2,B7-1,B7-2,半乳糖凝集素9和CD155)。研究人员建立了具有FLAG标记的YAP-5SA载体的BRAFV600E突变型黑素瘤细胞系(SKMEL28, WM3248和A375SM)。既往研究表明,通过Hippo通路激酶LATS1和LATS2阻止YAP抑制性磷酸化,5SA突变会引起YAP组成型核定位和转录激活。注意,相较于亲代细胞,表达YAP-5SA的黑色素瘤细胞系表现出更广泛的PD-L1和PD-L2表面表达。另外,YAP-5SA(而非野生型YAP)过表达增加了三种黑色素瘤细胞系中PD-L1 mRNA表达以及其表面蛋白质表达。这些结果表明,YAP激活诱导了黑素瘤细胞中的PD-L1表达。研究人员还观察到乳腺癌(MCF7,MDA-MB231),NSCLC(A549),结肠癌(HT29)和成胶质细胞瘤(A172)细胞中YAP-5SA诱导的PD-L1上调。然而,YAP-5SA表达并未显着增加KM12结肠癌细胞中的PD-L1水平,这表明YAP介导的PD-L1诱导依赖于细胞背景。
研究人员还检测了BRAFi(威罗菲尼)耐药性黑色素瘤细胞中的PD-L1 mRNA和蛋白质表达。相较于亲本细胞,BRAFi耐药性SKMEL28, WM3248和A375SM细胞更多地表达PD-L1 mRNA和细胞表面蛋白。RNAi介导的YAP及其旁系同源TAZ敲低抑制了BRAFi耐药性细胞中的PD-L1转录和细胞表面表达,这表明YAP/TAZ活性增强与PD-L1表达增加相关。微阵列数据(GSE68599)比较了亲本和BRAFi耐药性黑素瘤细胞以及YAP/TAZ耗竭的耐药细胞,结果证实免疫检查点配体中耐药细胞PD-L1上调以及YAP/TAZ敲低后PD-L1表达减少。总之,这些结果表明YAP活化上调了黑素瘤细胞上的PD-L1表达。
YAP上调PD-L1,但独立于EGFR, AKT, MAPK和IFNγ通路
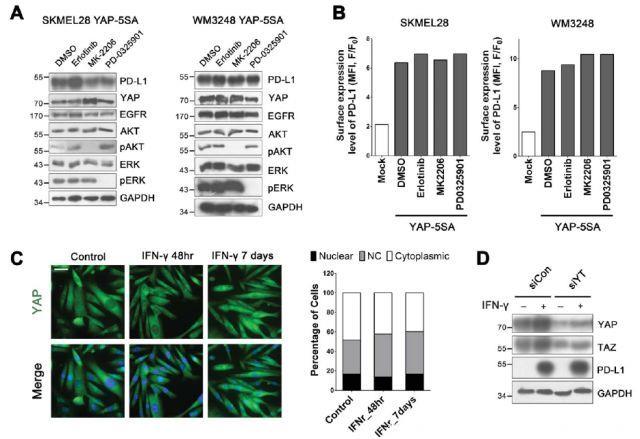
我们知道,EGFR,AKT和MAPK致癌通路激活可以诱导癌细胞上PD-L1表达。为检测这些通路是否参与YAP介导的PD-L1表达,研究人员应用埃罗替尼(EGFR抑制剂),MK-2206(AKT抑制剂)或PD0325901(MEK抑制剂)处理表达YAP-5SA的黑素瘤细胞并检测PD-L1表达。结果表明,很大程度上,PD-L1表达升高不受抑制致癌信号传导通路的影响,这说明YAP介导的PD-L1表达不需要这些通路。在延长的T细胞免疫应答期间,IFN-γ暴露也诱导PD-L1表达,引发适应性免疫逃避,因此研究人员检测了YAP是否参与IFNγ介导的PD-L1上调。短期(48小时)和长期(7天)IFNγ处理不能促进YAP核定位。此外,YAP/TAZ消耗不影响IFNγ诱导的PD-L1。研究人员还检测了YAP激活对JAK / STAT通路(IFNγ信号传导的主要下游效应子)的影响。表达模拟物和表达YAP-5SA的黑素瘤细胞中均无磷酸化STAT1活性,但IFNγ处理的模拟A375SM细胞显示出高磷酸化STAT1。这些结果说明IFNγ通路和YAP独立调节PD-L1表达。
YAP与PD-L1增强子区域结合并促进PD-L1转录
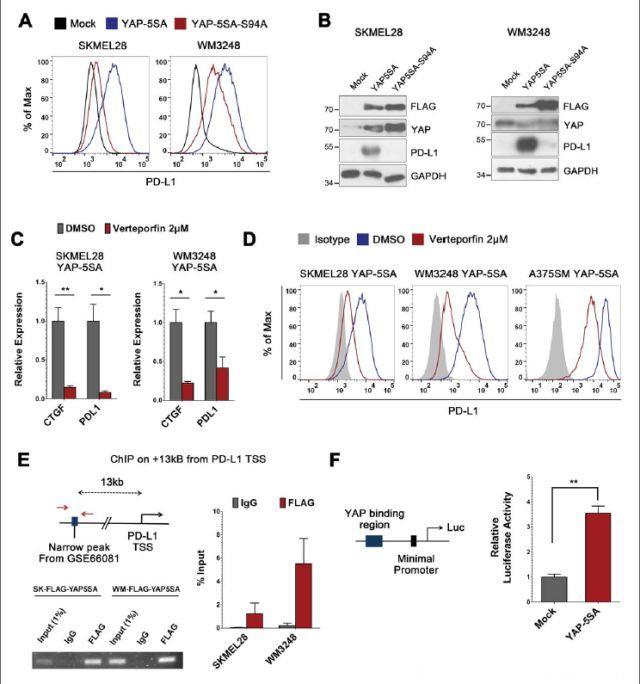
YAP主要通过与TEAD家族转录因子相互作用来促进靶基因转录。在TEAD结合位点引入突变可以显著抑制PD-L1上调。此外,应用维替泊芬处理YAP-5SA表达细胞可减少PD-L1 mRNA和表面表达。因此,完整的YAP-TEAD相互作用是上调PD-L1转录(通过YAP活性)的必要因素。其次,研究人员通过回顾公开可用的ChIP-seq数据,在潜在的PD-L1基因增强子区域探究了YAP-TEAD结合位点。他们在PD-L1转录起始位点的13-kb上游发现了可能提供YAP-TEAD结合位点的一个TEAD4结合窄峰。为确认YAP与这个区域结合,研究人员进行了ChIP分析。他们检测到了YAP-5SA与13kb上游区域特异性结合活性。为验证通过该候选增强子区域,YAP驱动的PD-L1转录激活,研究人员将13kb上游序列(800bp片段)克隆到具有最小启动子的荧光素酶载体中。增强子序列驱动的萤光素酶活性在表达YAP-5SA的HEK293T细胞中显著高于模拟转染的HEK293T细胞。这些结果表明,与13kb上游增强子结合的YAP-TEAD直接诱导PD-L1转录。
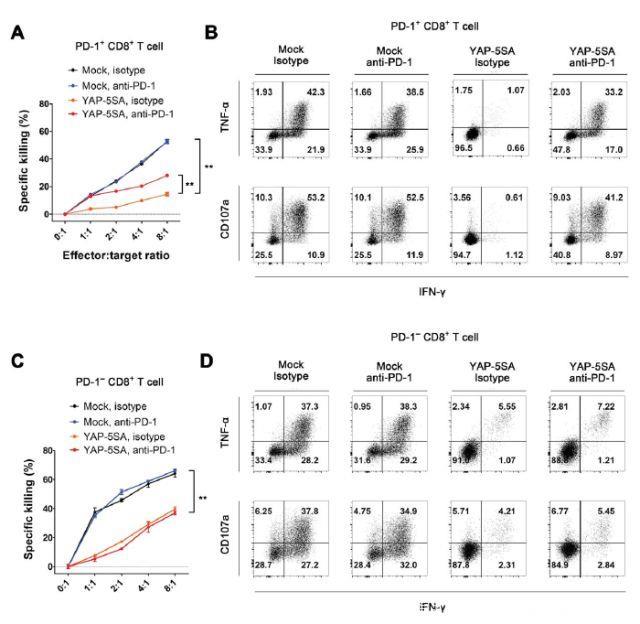
BRAFi耐药性黑素瘤细胞逃避肿瘤抗原特异性CD8+T细胞免疫应答
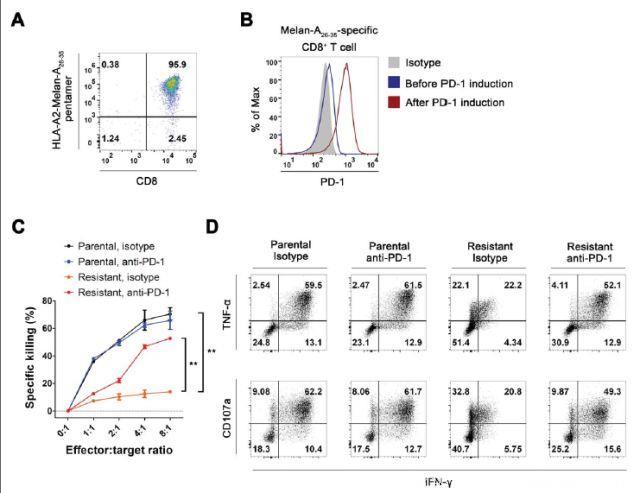
YAP激活促进BRAFi耐药性和PD-L1表达,YAP是BRAFi耐药性和免疫逃逸过程之间的分子桥梁。因此,研究人员研究了BRAFi耐药性黑素瘤细胞中YAP活化对肿瘤抗原特异性CD8+T细胞效应子功能的影响,应用表达HLA-A2的A375SM细胞进行细胞毒性测定。YAP-5SA表达和BRAFi耐药性均不影响HLA-A2表达。研究人员建立了HLA-A2限制性Melan-A肽特异性CD8+T细胞系(来自HLA-A2+健康供体的外周血单核细胞)。所得的细胞培养物含有95.9%的Melan-A26-35特异性CD8+T细胞并表现出最低程度的PD-1表达。为模拟肿瘤微环境中的T细胞耗尽,研究人员应用携带YAP-5SA的Melan-A26-35肽脉冲PD-L1+A375SM黑素瘤细胞培养T细胞系。培养7天后,研究人员观察到T细胞上PD-1表达的强烈诱导。然后,他们检查了PD-1+Melan-A26-35特异性CD8+T细胞抗同源抗原脉冲亲本和BRAFi耐药性A375SM细胞的细胞毒性。CD8+T细胞成功杀死了亲代A375SM细胞,随着效应子/靶标比率的增加,细胞毒性成比例增加。BRAFi耐药性A375SM细胞表现出对CD8+T细胞细胞毒性的抵抗性,它可以通过阻断PD-1而恢复,但抗PD-1抗体不影响亲代细胞的杀伤力。他们还研究了与黑素瘤细胞共培养的T细胞的其他效应器功能。结果表明,与BRAFi耐药性黑素瘤细胞共培养的CD8+T细胞中,IFNγ,TNFα产生显著减少,CD107a表达显著降低。这证实了BRAFi耐药性黑素瘤细胞中T细胞耗竭。与细胞毒性恢复一致,抗PD-1抗体治疗恢复了T细胞效应功能。这些结果表明,BRAFi耐药性黑素瘤细胞通过PD-1依赖性CD8+T细胞耗竭诱导免疫逃逸。
YAP介导黑素瘤细胞中肿瘤抗原特异性CD8+T细胞免疫逃逸
研究人员通过测定抗模拟和表达YAP-5SA的A375SM细胞的细胞毒性,研究了YAP激活对PD-1+Melan-A26-35特异性CD8+T细胞免疫应答的影响。表达YAP-5SA的黑色素瘤细胞比模拟细胞更具耐药性,PD-1阻断逆转了表达YAP-5SA的A375SM细胞的T细胞细胞毒性。Melan-A26-35特异性CD8+T细胞与YAP-5SA-表达细胞共培养减少了IFNγ和TNFα的产生,使CD107a表达减少。PD-1阻断可以恢复IFNγ,TNFα和CD107a表达减少。因为YAP-5SA诱导PD-L2和PD-L1表达,研究人员探究了PD-L1和PD-L2是否有助于YAP介导的T细胞抑制。与抗PD-1类似,PD-L1阻断抗体恢复了T细胞的细胞毒性功能,IFNγ和TNFα产生以及CD107a表达。相反,PD-L2阻断抗体治疗并不影响CD8+T细胞抗YAP-5SA表达黑素瘤细胞的细胞毒性和细胞因子产生,这说明PD-L2上调不是YAP介导的T细胞抑制的必要条件。总之,这些结果表明,黑素瘤细胞中YAP活化可以促进细胞毒性T细胞PD-1/PD-L1依赖性逃避。
PD-1阻断使与表达YAP-5SA的黑素瘤细胞共培养的CD8+T细胞的细胞毒性功能不完全修复。一种可能是PD- /PD-L1相互作用可能不会被抗PD-1完全阻断;另一种可能是YAP可能引起独立于PD-L1的免疫逃避机制。与YAP-5SA-表达黑素瘤细胞共培养后,非耗竭PD-1阴性Melan-A26-35特异性CD8+T细胞的细胞毒性功能和细胞因子产生受抑制,该抑制不受PD-1阻断的影响。这表明,YAP可以以PD-L1依赖性和PD-L1独立的方式,促进黑色素瘤细胞的免疫逃避。
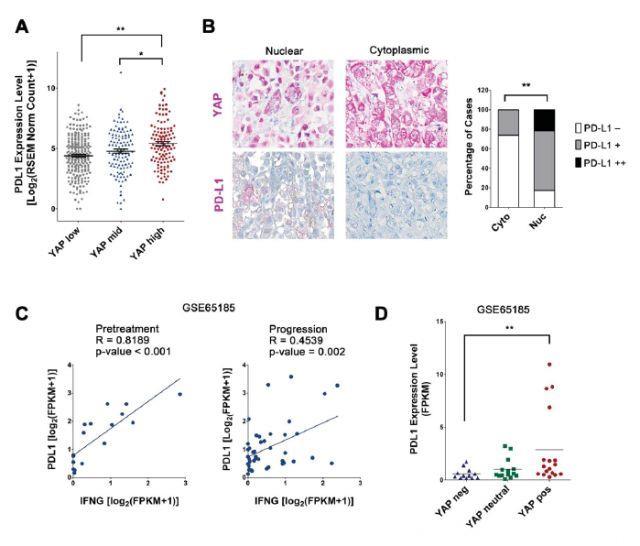
YAP激活与黑素瘤组织中更高的PD-L1表达相关
为验证YAP介导的PD-L1表达的临床意义,研究人员探究了人类黑素瘤肿瘤样品中YAP活性与PD-L1表达之间的关系。首先,他们分析了来自TCGA数据库的472个黑素瘤肿瘤的RNA-seq数据,根据基因组变异分析(GSVA)计算的YAP信号富集分数对肿瘤进行分层。结果表明,具有高YAP富集评分的肿瘤具有显著更高的PD-L1表达。另外,他们对来自65名黑素瘤患者肿瘤标本的YAP和PD-L1进行了免疫组织化学染色。如预期,相较于细胞质YAP染色(低YAP活性)的肿瘤,核或核浆YAP染色(高YAP活性)的肿瘤具有显著更高的PD-L1表达。他们还探讨了BRAFi耐药性黑素瘤既往发布数据中YAP和PD-L1之间的联系。Hugo等人全面分析了BRAFi / MEKi疗法(GSE65185)前后收集的配对黑素瘤样品。他们在某些耐药肿瘤中发现了YAP信号激活。PD-L1表达与预处理肿瘤中的IFNγ表达相关。然而,在获得耐药性后,这种相关性减弱,这表明IFNγ以外的因子在控制BRAFi / MEKi耐药性肿瘤中PD-L1表达中起关键作用。YAP信号富集的BRAFi / MEKi耐药性肿瘤亚组中PD-L1也高度上调。总之,这些数据提供了人黑素瘤肿瘤中YAP介导的PD-L1上调的体内证据。
文章编译自:Min Hwan Kim1, Chang Gon Kim1, Sang-Kyum Kim2, Sang Joon Shin, Eun Ah Choe, Su-Hyung Park1, Eui-Cheol Shin1, Joon Kim1.YAP-induced PD-L1 expression drives immune evasion in BRAFi resistant melanoma. Cancer Immunology Research. January 30, 2018.