【学术前沿】李峻岭医生:针对奥希替尼耐药的策略与思考
EGFR不同类型的敏感突变及其治疗选择,是目前非小细胞肺癌靶向治疗中研究最深入,最成熟的治疗领域。一代和二代的针对表皮生长因子受体小分子酪氨酸激酶抑制剂(EGFR-TKI)的临床应用使具有这类敏感突变的肺癌患者的无疾病进展生存时间较既往有大幅度的提高。
但是令人遗憾的是,几乎所有患者在使用一段TKI类靶向药物都后会出现耐药。T790M作为一代TKI耐药的最主要突变类型,已经有了奥希替尼,即AZD9291作为有效的治疗药物。奥希替尼会出现耐药吗?答案是肯定的。中国患者的肺腺癌的突变率大约为50%,第一代TKI耐药后大约50%-60%的患者为T790M的突变。中国人口众多,肺癌高发,肺癌患者EGFR突变频率高,新药耐药的产生逐渐成为了人们需要面对和思考的问题。
奥希替尼的耐药模式主要有以下几种类型:
1、 EGFR本身相关的耐药
EGFR-C797S突变,以及一些已知的其他罕见突变类型(如C797SG、L798I、L844V等),是指在EGFR基因的整个序列中突变发生了变化,驱动肿瘤增生。C797S的发生比率占奥希替尼整体耐药发生率的30-40%,相对最为常见(这个比率来自与二线治疗的获得性耐药,一线应用发生的比率可能会更大)。
针对这种突变有以下几种类型和策略
ü C797S阳,T790M阳,反式构型(即不在同一条染色体上),可以应用一代和三代TKI联用。
ü C797S阳,T790M阳,顺式构型(即在同一条染色体上),目前无专门针对的策略。
ü C797S阳,T790M阴,换回一代或二代EGFR-TKI,如吉非替尼、阿法替尼等。
对于EGFR三重突变(EGFR活化突变/T790M/C797S)介导的奥希替尼耐药,Brigatinib联合西妥昔单抗的联合治疗方案在临床前研究中被证实有效,可能成为一种新的治疗策略。并且,针对于C797S突变类型的第四代药物正在研发中,如EA1045联合西妥昔单抗在小鼠模型中已获得了疗效。
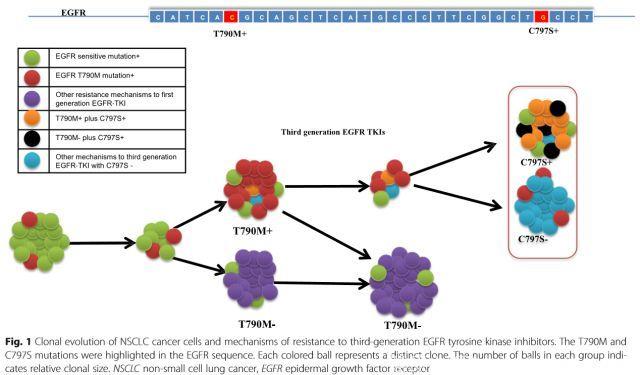
还有一种可能就是T790M不见了,或是T790M还在,但是都没有发现新的突变,这种情况说明驱动肿瘤增殖的主力军是新的未知靶点,这时换用或联用免疫治疗、抗血管生成治疗、化疗等其他方案即成为了选择。

2、 旁路信号激活
MET扩增:
MET扩增不但是一代TKI应用时易出现的耐药机制,同样也是三代EGFR-TKI耐药的可能原因之一。针对MET扩增的靶向药物克唑替尼,在治疗中体现了一定疗效。还有以MET为靶点的新药EGF816、INC280的治疗仍在试验阶段。
HER2突变或扩增:
HER2的扩增与HER2的突变要区分对待。HER2基因扩增更多的是发生在吸烟的男性患者群体,HER2基因突变更多的是发生在不吸烟的女性患者群体。如果是HER2扩增,而且扩增倍数较高,可以使用曲妥珠单抗联合化疗,如果是HER2突变,则可以选择二代EGFR-TKI阿法替尼。

其他突变:
在奥希替尼的旁路激活耐药机制中,HER2和MET扩增大约占到10-20%,除此之外还有很多突变类型在奥希替尼的耐药患者中发现,例如RAS-MAPK通路的激活(包括KRAS/NRAS突变或扩增、BRAF突变、MAK突变、MAPK扩增)、JAK2,PIK3CA突变、FGFR扩增、SCLC转化等等,这些突变少见且复杂,有时是单独出现,有时会伴有其他突变,亦或者是伴随T790M同时出现,对于有相应靶点的靶向药物,可以尝试单用或联用,例如针对于MEK的曲美替尼、BRAF的达拉非尼、小细胞转化可以考虑小细胞肺癌的化疗方案等等。

最后给大家分享几个最新的研究
1、BIM缺失导致的奥希替尼耐药:这是EGFR第一代靶向药物的耐药机制,其也可能会导致第三代EGFR的靶向药物奥希替尼耐药。但是BIM耐药的问题,可以通过第三代靶向药物奥希替尼和伏立诺他(组蛋白去乙酰化酶抑制剂)联合来克服。在体外实验和动物实验中已经证实两种药物联合对BIM缺失的有效性。
2、在体外研究和动物实验中证实,奥希替尼联合MEK抑制剂(司美替尼AZD6244或曲美替尼GSK212)可以很好的起到促进肿瘤细胞凋亡的效果,这可能是因为两者可以在对奥希替尼耐药的肺癌细胞里将Bim基因上调,将Mcl-1基因下调,这些都是奥希替尼诱导细胞凋亡时重要的调控基因。调节这些基因可以使耐药的细胞重新对靶向药物敏感和凋亡,而这两种药物单独使用都不会起到效果。
3、有研究者发现,伴有脑转移的NSCLC患者,在经过一线EGFR-TKI治疗,二线奥希替尼治疗进展后,切除的肿瘤组织带有高的MET扩增表现,此时给予Capmatinib(c-MET抑制剂)单药或联合阿法替尼(ErbB-1/2/4抑制剂)治疗,在裸鼠的移植瘤模型中获得了好的疗效,其中联合方案效果更好(见下图)。研究者同时发现,KRAS G12C克隆在capmatinib或阿法替尼单药治疗的小鼠中出现,并存在KRAS驱动的亚克隆,揭示了获得性MET扩增的奥希替尼耐药肿瘤存在瘤内异质性的可能。

总而言之,奥希替尼的耐药机制相对复杂,没有一类有明显突出的发生率和治疗方法,如果再次做了基因检测,找到了活跃的靶点,可以考虑相应靶点的药物治疗,但是很多仍处在摸索阶段,没有大宗的研究证实,也因为各类突变的少见性和复杂性,使得临床试验的设计和开展非常受限,我们可以根据目前得到的一些证据来选择用药。同时,换一种思路,如果尝试联合免疫检查点抑制剂、抗血管生成治疗等,从另一种角度去攻克肿瘤,或许会收获不错的效果。奥希替尼耐药后的治疗策略,需要综合去评估与制定。
发表自:医科院肿瘤医院李峻岭医生