还记得那个惊艳了ASCO的广谱抗癌新药larotrectinib吗?NEJM发布最新数据:总反应率高达75%
导读
在2017年召开的美国临床肿瘤学会(ASCO)会议上,纪念斯隆-凯特琳癌症中心的David Hyman博士公布了由Loxo Oncology公司研发的抗癌药物larotrectinib(LOXO-101)的早期临床数据,数据显示,Larotrectinib在广泛的年龄和肿瘤类型的TRK融合癌症中,具有持久的抗肿瘤活性作用和良好的耐受性,成为了2017 ASCO大会上的一匹黑马。
时隔半年,美国时间2月21日新英格兰医学杂志(NEJM)在线发表了larotrectinib(LOXO-101)同时进行的三项安全性和有效性研究结果,研究显示对于年龄为4个月至76岁的患者,针对17种不同癌症治疗总体反应率为75%,这无疑令人振奋!
本次公布的数据为larotrectinib同时进行的三项安全性和有效性研究,包括成人I期研究,儿童I-II期研究,以及青少年和成人II期研究(NCT02122913,NCT02637687和NCT02576431)。Larotrectinib的数据非常喜人,有望成为第一个口服、针对17种不同肿瘤、儿童和成年人都可以用的广谱靶向药。我们一起来了解一下它的详细情况。
主要内容:
从2015年3月到2017年2月,研究人员分析了55例参加了3项正在进行的I期、II期临床试验的TRK基因融合患者的数据。
患者年龄从4个月到76岁不等,全部患者(12例儿童,43例成人)患有包括阑尾癌,乳腺癌,胆管癌,结直肠癌,胃肠道间质瘤(GIST),婴儿纤维肉瘤,肺癌,黑色素瘤,胰腺癌,甲状腺癌等17种肿瘤。
这些患者通过检测手段确定属于NTRK1、NTRK2或者NTRK3融合,之前进行过治疗。主要研究终点为总反应率。次要终点包括反应持续时间,无进展生存期和安全性。
主要结果
根据迄今为止评估的55例患者,总反应率为75%,总共13%的患者(7名患者)完全缓解,62%(34)的患者部分缓解,13%(7)的患者病情稳定,9%(5)的患者有进行性疾病,4%(2)由于临床恶化提前退出而未被评估。
研究进行1年时,71%的患者持续缓解,55%的患者无进展。尚未达到中位持续时间和无进展生存期。平均随访9.4个月,86%的患者(44例患者中有38例)正在继续治疗或接受了旨在治愈的手术。
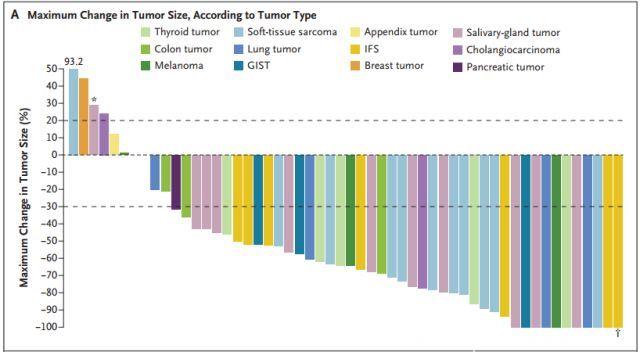
图A:不同肿瘤类型尺寸的最大变化
从上图中可以看到,高达78%患者的肿瘤显著缩小。
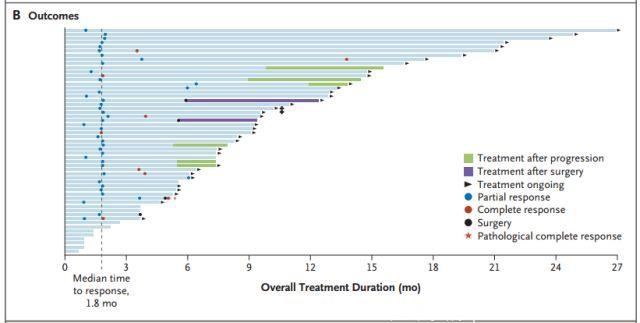
图B:所有患者结果
治疗中出现的不良事件大多为1级,研究人员认为3级或4级不良事件与larotrectinib相关,发生率超过5%。没有患者因为药物相关的不良事件而停用larotrectinib。
最常见的不良事件是贫血(11%),丙氨酸转氨酶或天冬氨酸转氨酶水平增加(7%),体重增加(7%)和中性粒细胞计数减少(7%)。
结论
无论患者的年龄或肿瘤类型如何,Larotrectinib对TRK融合阳性的癌症患者均具有明显且持久的抗肿瘤活性。
larotrectinib的前世今生
TRK融合是一种基因异常,指的TRK基因与其他基因融合,据估计,这种异常的发生占常见肿瘤的0.5% ~ 1%,但在某些罕见肿瘤中所占比例超过90%,例如唾液腺癌、某种青年型乳腺癌和婴儿型纤维肉瘤中,TRK融合在肿瘤发生早期即出现,并在肿瘤生长和播散过程中持续存在。
不同于以往的靶向药物,larotrectinib是作为一款广谱肿瘤药来开发,拟用于所有表达有原肌球蛋白受体激酶(TRK)的肿瘤患者,而不是针对某个解剖位置的肿瘤,这就使得它的治疗范围非常广。
Larotrectinib曾在2016年7月13日被FDA授予突破性药物资格,用于TRK融合基因突变阳性的成人及儿童的不可手术切除或转移性实体瘤。
2017年12月底,larotrectinib已经FDA提交了上市申请,用于治疗带有NTRK融合基因的成人或儿童实体瘤患者,预计2018年上半年,larotrectinib很可能会在美国本土上市。
David Hyman博士表示,如果审批通过,larotrectinib将会成为第一个在成人和儿童中同时开发和批准的治疗方法,并且是第一种跨越所有传统定义的肿瘤类型,分子意义上的肿瘤靶向治疗。
参考文献:
Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children.N Engl J Med. February 22 2018.