转移性乳腺癌治疗添新利器!奥拉帕利新适应证获FDA批准
奥拉帕利成为首个、也是唯一获批能用于卵巢癌领域之外治疗的PARP酶抑制剂。与标准化疗相比,奥拉帕利将疾病进展或死亡风险降低42%!
来源丨医学界肿瘤频道
近日,阿斯利康公司与默沙东公司联合宣布,美国食品药品监督管理局(FDA)已批准Lynparza(奥拉帕利)用于治疗携带有害或疑似有害胚系BRCA基因突变(gBRCAm)、且人类表皮生长因子受体2(HER2)为阴性的转移性乳腺癌患者!
这些患者既往需在新辅助、辅助或转移性治疗中接受过相关化疗。
- 激素受体阳性(HR +)的乳腺癌患者应接受过内分泌治疗,或被认为不适合进行内分泌治疗。
- 患者需接受FDA批准的Myriad Genetics伴随诊断检测,判断他们是否适用这种疗法。
阿斯利康执行副总裁、肿瘤事业部负责人Dave Fredrickson说:
“奥拉帕利获得的这项新批准使其成为首个、也是唯一获批用于治疗转移性乳腺癌的PARP酶抑制剂。它也是目前唯一获批用于卵巢癌领域外的PARP酶抑制剂。
对于乳腺癌患者来说,这是非常重要的事件。这意味着,除了激素受体和HER2状态外,BRCA基因突变的检测也将有望成为治疗此类疾病的关键步骤。”
默沙东研究实验室高级副总裁、全球临床开发负责人兼首席医学官Roy Baynes说:
“我们一直在探索如何治疗携带胚系BRCA基因突变的HER2阴性转移性乳腺癌女性患者,这是非常难治的一类癌症。
而奥拉帕利获得的这项新批准代表着一个重大的进展。此外,这项批准也将推动我们与阿斯利康在癌症药物研发领域进一步展开重要的合作。”
这项批准的基础数据来自随机、开放性的OlympiAD III期试验,已于2017年6月发表在《新英格兰医学杂志》上。

在该项试验中,对照组采用“医生选择”的化疗治疗方案(卡培他滨、长春瑞滨或艾瑞布林)。
试验结果表明,与化疗组相比,奥拉帕利显著延长了患者的无进展生存期(PFS),将疾病进展或死亡风险降低了42%(HR 0.58; 95%CI 0.43-0.80; P = 0.0009,中位7.0 vs 4.2个月)。
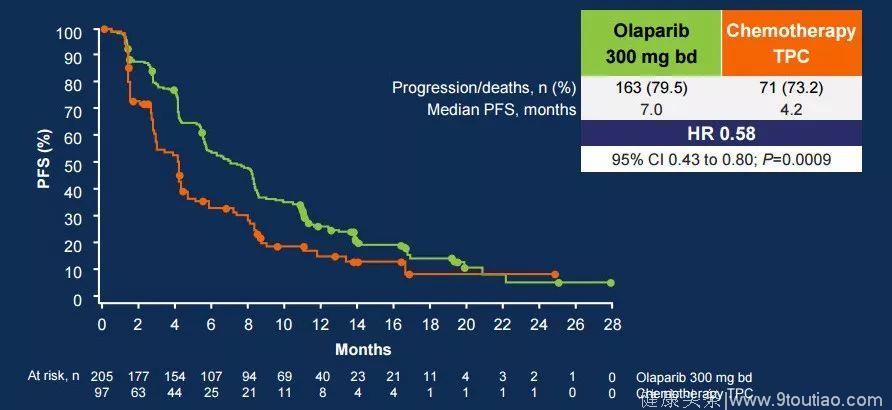
存在可测量病灶的患者服用奥利帕利(n = 167),客观缓解率达到了52%(95%CI 44-60),而化疗组(n=66)的客观缓解率仅为23%(95%CI 13-35)。此外,奥拉帕利组患者的完全缓解率为7.8%,而化疗组仅为1.5%。
隶属于宾夕法尼亚大学艾布拉姆森癌症研究中心的巴瑟尔BRCA基因突变研究中心执行主任、OlympiAD试验的美国全国带头人Susan M. Domchek说:
“相比其他乳腺癌患者,被诊断为BRCA基因突变的转移性乳腺癌患者通常更为年轻,他们的疾病进展也更迅速,更加难以治疗。
虽然转移性乳腺癌目前尚无治愈方法,但奥拉帕利获得的批准提供了一个全新的靶向选择,可能有助于延缓这些患者的疾病进展。”
接受奥拉帕利治疗的患者最常见的不良反应(≥20%)包括恶心(58%)、贫血(40%)、乏力(包括虚弱)(37%)、呕吐(30%)、嗜中性粒细胞减少症 (27%)、呼吸道感染(27%)、白细胞减少(25%)、腹泻(21%)和头痛(20%)。在Lynparza组中,中止治疗的患者比例为5%,而化疗组为8%。
这是奥拉帕利在美获批的第三个适应症。在美国,该药物已被用于治疗近4000名晚期卵巢癌患者。奥拉帕利是临床开发项目范围最广的PARP抑制剂。
阿斯利康和默沙东正在携手努力,将奥拉帕利尽可能快地交付给更多的患者,用于多种癌症领域的治疗,包括乳腺癌、卵巢癌、前列腺癌和胰腺癌。
关于OlympiAD试验
OlympiAD是一项随机、开放性、多中心的III期试验,旨在评估奥拉帕利片剂(300 mg,每日两次)对照“医生选择”的化疗方案,治疗302例HER2阴性转移性乳腺癌伴有害或疑似有害胚系BRCA1或BRCA2突变的患者,观察相关药物的疗效和安全性。这项国际试验在欧洲、亚洲、北美和南美的19个国家开展。
在OlympiAD试验中,HER2阴性的gBRCA1-或gBRCA2-突变乳腺癌患者(HR +或三阴性)采用奥拉帕利治疗转移性乳腺癌。在Lynparza组和化疗组中,大约一半的患者为HR +(n = 152),另一半为三阴性(n = 150)。
在接受Lynparza治疗的205名患者中,中位年龄为44岁(年龄范围:22至76岁)。
- 入组前,患者应在新辅助治疗、辅助治疗或转移治疗环境中接受过蒽环类(除非存在禁忌)和紫杉类化疗,且先前用于治疗转移性疾病的化疗方案不超过两项。
- 激素受体阳性患者需要接受过至少一种内分泌药物治疗,或者被证明不适合接受内分泌药物治疗。
- 先前采用内分泌药物的治疗方案不被视为先前使用过的化疗方案。
这项试验的主要终点为经盲态独立中心评审的无进展生存期。次要终点包括总生存期、二次进展或死亡时间、客观缓解率及对健康生活质量的影响。
关于转移性乳腺癌(MBC)
驱动乳腺癌生长的有三种主要受体,它们分别是孕激素受体(PR)、雌激素受体(ER)和表皮生长因子受体2(HER2)。
- 乳腺癌会检测这三种受体的阳性表达情况。如果肿瘤对PR和/或ER检测呈阳性,则被认为是HR +。
- 如果肿瘤对所有三种受体都呈阴性,则被认为是三阴性。
转移性乳腺癌是乳腺癌最晚期的阶段(第四期),癌细胞已扩散到乳房以外的其他部位。
过去三十年里,尽管相关治疗方案有所增加,目前尚无能够治愈转移性乳腺癌患者的药物。在确诊后,存活期超过5年的患者仅有26.9%。因此,治疗的主要目的是尽可能延缓疾病进展,改善或至少维持患者的生活质量。
据估计,到2018年,美国将有大约15.5万名女性患有转移性乳腺癌。到2020年,这个数字预计将增至约16万。
关于胚系BRCA基因突变
人类基因BRCA1和BRCA2产生的蛋白用于修复DNA损伤,对维持细胞的基因稳定性起到了重要作用。当它们中任何一个基因发生突变或改变后,比如它的蛋白不再产生或是功能发生异常,DNA损伤可能无法正确修复,细胞稳定性受损。因此,细胞将更可能发生额外的基因改变而导致癌症的发生。
关于Lynparza(奥拉帕利)
奥拉帕利是美国FDA批准的首个口服多聚ADP核糖聚合酶(PARP)抑制剂,也是首个有望利用DNA损伤应答(DDR)途径缺陷(如BRCA突变)优先杀死癌细胞的靶向治疗药物。
具体而言,体外研究显示,由奥拉帕利诱导的细胞毒性可能会导致PARP酶活性的抑制,并催生PARP-DNA复合物形成,从而造成DNA损伤和癌细胞死亡。
奥拉帕利正被用于一系列DDR缺陷型肿瘤的治疗研究,它为阿斯利康行业领先的相关药物产品奠定了基础,这些产品都利用了癌症细胞中的DDR机制。
阿斯利康与默沙东的肿瘤战略合作
2017年7月27日,阿斯利康和默沙东公司宣布,在全球范围内达成一项肿瘤领域战略合作,双方将共同对阿斯利康的全球首个领先的PARP抑制剂奥拉帕利,以及潜力新药MEK抑制剂selumetinib就多个肿瘤适应症进行临床开发和商业化推广。
本次战略合作是基于有越来越多的科学证据表明PARP及MEK抑制剂与PD-L1/PD-1抑制剂的联合疗法能治疗多种类型的肿瘤,并旨在最大化奥拉帕利成为联合治疗的首选核心药物的潜力。
通过合作,双方将共同开发并商业化奥拉帕利和selumetinib单药治疗及其他潜在药物的联合疗法,并独立开发并商业化进行奥拉帕利和selumetinib与各自公司的PD-1/PD-L1的联合疗法。
关于阿斯利康的肿瘤研究
阿斯利康在肿瘤领域的研究源远流长,我们迅速壮大的新药组合将可能改变患者的生命,还将为公司未来发展带来无限可能。
凭借2014至2020年间至少6款新药的上市,以及一条由小分子和生物制剂组成的丰富的研发管线,我们将推动肿瘤业务聚焦肺癌、卵巢癌、乳腺癌和血液肿瘤,并致力于成为阿斯利康五大业务增长平台之一。
除核心能力外,我们还将积极寻求创新的伙伴关系和外部投资,如我们投资Acerta制药公司用于血液病研究,以加速实现我们的战略。
通过运用肿瘤免疫疗法、肿瘤的驱动基因及耐药机制、DNA损伤修复和抗体药物复合体四大科学平台,倡导个性化组合的发展,阿斯利康以期重新定义癌症治疗并在未来攻克癌症。
关于阿斯利康
阿斯利康是一家科学至上的全球性生物制药企业,专注于研发、生产及营销处方类药品,重点关注肿瘤、心血管及代谢疾病和呼吸三大核心疾病领域。
同时,阿斯利康也有选择性地积极投入自体免疫、神经科学及感染领域。阿斯利康的业务遍布100多个国家,创新药物惠及全球数百万患者。更多信息,请访问www.astrazeneca.com。