基因剪刀CRISPR能变身“吃豆人”吃掉癌细胞, 治愈绝症
试想一下:安吉丽娜·朱莉不用做乳腺切除手术,而只需服用一剂基因,把可能引发癌症的BRCA2基因剪去。这就是治疗与治愈的区别。
研究人员运用CRISPR蛋白质,以及一个由RNA实现的效果放大过程,以此检测癌细胞的存在。
艾滋病毒(HIV)没有治愈之法。有赖于教育、预防和PrEP(暴露前预防投药)等手段,它不再是八九十年代那种无从化解的灾祸。但治愈仍无从谈起。
原因是多方面的,其中之一是HIV能神不知、鬼不觉地潜入细胞DNA内部,其中包括本应消灭它的免疫细胞的DNA。但HIV也有可能断送在这种能力上,因为CRISPR出现了。对于这种基因编辑技术,人们一度兴奋至极,继而疑虑重重,现在则抱以谨慎乐观的态度,试图以此治愈一大堆难治疾病。
上周,一个生物学家团体发表研究报告,详细介绍了相关原理,即将一个抗HIV的CRISPR系统隐藏于另一种会“偷渡”的病毒之内,偷偷潜入宿主的免疫系统。该病毒在自我复制时,能顺便将HIV从感染细胞中剔除。在目前阶段,这种方法适用于大鼠和小鼠,对人则不适用。但从概念证明的角度看,它意味着我们能开发出类似的系统,以此打击很多类型的疾病——疱疹、囊性纤维化以及各种癌症。
以上疾病都能够不同程度地治疗,可问题在于治疗过程必须持续进行才能有效。“目前针对HIV的抗逆转录病毒疗法能有效抑制病毒的复制,” 费城天普大学神经病学家、此次研究(发表于《分子治疗》杂志)的第一作者卡梅尔·哈利利(Kamel Khalili)说。“但它不能清除已经与基因结合的HIV副本,所以患者一旦停药,病毒就会卷土重来。”另外,治疗也有失败的时候,而且常常如此。
上世纪70年代,两位研究人员首次提出这种概念,即以病毒为媒介,用好的DNA取代坏的DNA。这种基因疗法给医学界带来了变革的希望。80年代,研究人员在小鼠身上测试了首个工作模型。90年代,人们开始用基因疗法治疗免疫和营养缺陷,成效非常有限。及至1999年,参与宾夕法尼亚大学基因治疗试验的病人杰西·盖尔辛格(Genee Gelsinger)死于并发症,导致整个领域紧急刹车。后来,基因治疗开始稳步回归,但2012年人们发现CRISPR技术可以简单、准确地剪切基因,从而加速了基因治疗的发展。
CRISPR作为艾滋病毒治疗的媒介,也有它自己的问题。一方面,在从受感染细胞中去除HIV的同时,它决不能破坏周围的DNA。艾滋病毒处在不断的变异和演化之中,因此,光凭一张基因“快照”来编制CRISPR系统是行不通的。研究人员必须锁定对病毒生存至关重要、且固定不变的片段,而且这样的片段要足够多。
下一个难关是将系统送入足够多的感染细胞之内,以达到临界数量。为此,你首先要骗过免疫系统——它就是为攻击一切外来异物而生的。因此,研究人员用腺相关病毒(AAV)将CRISPR系统包裹起来。“AAV是一种很小的辅助病毒,除非有别的病毒帮忙,否则无法在细胞内自我复制。
“AAV的妙处就在于,它们基本不会引发人体的免疫反应,”西雅图的弗瑞德·哈金森肿瘤研究中心(Fred Hutchinson Cancer Research Centre)微生物学家基恩·杰罗姆(Keith Jerome)说。
但这也并非绝对。1999年的基因疗法试验中,杰西·盖尔辛格正是因为免疫系统对AAV反应过度才不幸殒命。因此,有心使用AAV基因疗法的医生必须清楚患者对AAV的接触史。
要获准进入人体使用阶段,这种CRISPR疗法就必须安全并且有效。这项研究面临着能否有效的严格问题。哈利利和合著者们用不同的艾滋病毒株处理了小鼠和大鼠模型;既有潜伏性毒株,即病毒隐藏在细胞DNA之中,也有活跃复制的毒株。继而,研究人员又用其处理了嫁接人类细胞的小鼠。在以上三种情况下,艾滋病毒的感染率都出现大幅下降。
关于安全性,还有一个好消息:并没有证据表明,有任何非目标位点在试验中被切割。
现在,他们要运行更多的实验,确保万无一失。这些实验可能用到灵长类动物模型,因其DNA更接近人类。他们还须确保该疗法能消灭足够的艾滋病毒,防止它们通过自我复制,恢复到为害人体水平。“在实际的人类患者中,CRISPR基因疗法不可能将艾滋病毒消灭殆尽,”加州大学戴维斯分校干细胞生物学家保罗·克诺普弗勒(Paul Knoepfler)说。“怎样的清除效率才算‘足够’,才能在临床上构成重大影响?”
哈利利认为,他可以足够接近这一目标,据他介绍,CRISPR系统不必消除所有的艾滋病毒感染细胞,只要使它们降至患者免疫系统可以应对的数量即可。“我非常相信基因编辑策略,凭借我30年的艾滋病毒研究,我觉得,这个办法将是最终的答案。”
他并非唯一的乐观主义者。“使用病毒作为传播系统,这样做的优势在于,它几乎能感染每一个细胞。”匹兹堡大学病理学家罗建华说,他正在使用类似的病毒内CRISPR系统来靶向细胞中的癌性DNA。
治愈艾滋病毒也可以证明这一治疗概念,进而推广到其他疾病,乃至先天性遗传病。虽然艾滋病毒最初只是一种感染,但潜入染色体后,它便形同遗传性疾病了。
“吃豆人”CRISPR-Cas13a酶
CRISPR-Cas13a家族(曾被称为CRISPR-C2c2)是CRISPR-Cas9的近亲,后者正将生物生物医学研究和治疗导向基因编辑之途。
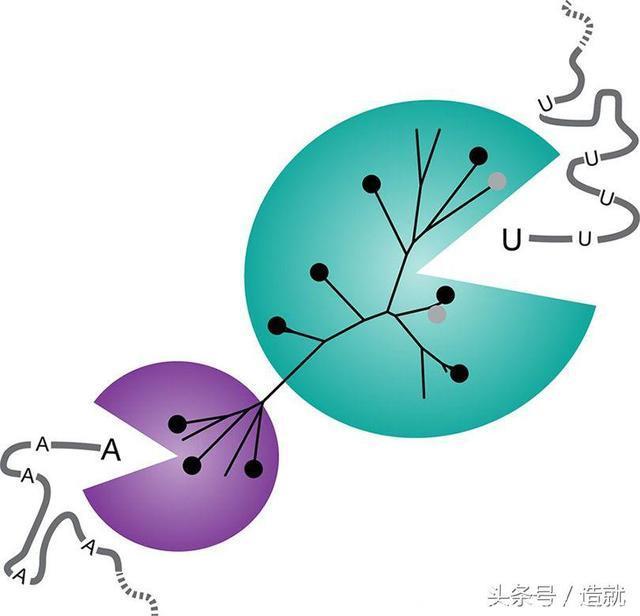
这种Cas13a蛋白是一种核酸切割酶(又称核酸酶)。Cas9蛋白是对双链DNA的特定序列加以切割,Cas13a蛋白则锁定特定的RNA序列。也就是说,它不光剪切那一个特定RNA,还会四处乱跑,切断并摧毁所有在场的RNA。
“对于Cas13a与其RNA靶标之间的结合,我们可以把它想象为一个开关——与目标结合之后,酶得到激活,变成细胞内的‘吃豆人’,把附近所有的RNA都吞噬掉,”研究人员亚历山德拉·伊斯特-希勒斯基(Alexandra East-Seletsky)说。这场RNA大屠杀可能会杀死细胞。
Cas13a的变体中,有三种会在腺嘌呤处切割RNA。有了这种差异,研究人员就可以同时检测两种不同的RNA分子,例如来自两种不同病毒的RNA。
自上述HIV研究发表以来,加州大学伯克利分校的一组生物学家又描述了10种新的CRISPR酶,据称这些酶一旦被激活,就会“像吃豆人一样”蚕食RNA,可用作感染性病毒的敏感检测方式。
这些新的酶是CRISPR蛋白Cas13a(去年9月,加州大学伯克利分校研究人员在《自然》杂志中报告了这一蛋白)的变体,或可用于检测RNA的特异性序列,例如来自病毒的序列。该研究表明,CRISPR-Cas13a一旦与其靶RNA结合,就会开始不分青红皂白地切割所有使之“发光”的RNA,从而便于检测。
博德研究所(Broad Institute)的两组研究人员随后将CRISPR-Cas13a与一个RNA放大过程相结合,表明该系统(被命名为[Sherlock])可以检测到极低浓度的病毒RNA,例如登革热和寨卡病毒RNA。此种系统可用于检测任何类型的RNA,包括特定癌症细胞的RNA。
试想一下:安吉丽娜·朱莉不用做乳腺切除手术,而只需服用一剂基因,把可能引发癌症的BRCA2基因剪去。这就是治疗与治愈的区别。
翻译:雁行
造就:剧院式的线下演讲平台,发现最有创造力的思想