强直患者为何会出现影像学进展?「骨形成」和「骨吸收」的失衡是关键
*仅供医学专业人士阅读参考

骨重塑失衡是AS发生发展中重要的病理过程。
强直性脊柱炎(AS)是一种常见的以病理性新骨形成为主要特征的炎症性自身免疫性疾病。在疾病进展过程中,患者影像学改变可从初期的炎症表现如骶髂关节炎、脊椎炎、椎间盘炎等逐渐发展成不可逆的结构损伤如脊椎骨质及椎间隙破坏、椎体方形化、韧带增生、韧带骨化、脊柱僵硬畸形等。其活动能力因此受限,生活质量受到严重影响。 研究AS影像学进展过程及其特点、探究其病理性骨重塑机制对疾病的早期诊断和治疗具有重要意义。本期,我们将聚焦于此话题展开讨论,并邀请中山大学附属第一医院许韩师教授进行点评和分享。AS的影像学改变有哪些特点?
尽管方形椎及竹节椎是AS的特征性影像学表现,但并非所有的患者都会经历此阶段。AS是一种慢性进展性疾病,在各个病程中,患者将表现不同的影像学改变。研究数据显示,只有不到一半的患者将在长病程下实现完全的脊柱融合[1]。在AS的影像学进展中,骶髂关节一般为最先受累的部位,绝大部分早期AS患者即呈现双侧对称性骶髂关节炎,引起下背部和臀部的疼痛、僵硬。早期炎症变化如骨髓水肿等可通过磁共振成像技术(MRI)进行观测[2]。随着疾病的进展,患者关节面侵蚀和破坏逐渐加重,范围逐渐扩大,上行侵犯至腰椎、胸椎和颈椎,可表现为脂肪沉积、脂肪浸润、骨质疏松、骨质丢失等。同时,病理性新骨形成将造成韧带增生、韧带骨化,新生骨赘的形成将相邻椎体链接起来形成骨桥,导致脊柱融合的发生,患者因而呈现方形椎体和“竹节椎”等不可逆的结构损伤,导致其活动能力的下降[1-3]。除了中轴脊柱关节的影像学进展,许多AS患者还伴有周围关节的影像学改变,这些周围关节病变被证明对预后有显著影响。髋关节是最常受累的周围关节,初期多为单侧,后可发展为双侧对称。国外报道称AS患者出现髋关节受累的比例接近40%,而国内AS患者的比例可能更高[4]。而且研究显示,髋关节受累与更严重的中轴受累相关,是患者发生脊柱竹节样变的高危因素[1, 5]。因此,髋关节受累的患者需接受更积极的临床治疗(包括药物治疗以及关节置换手术)[6]。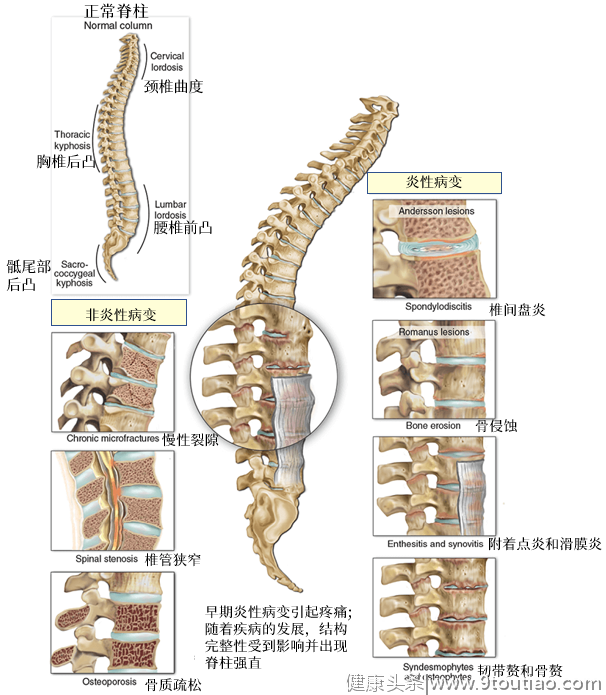
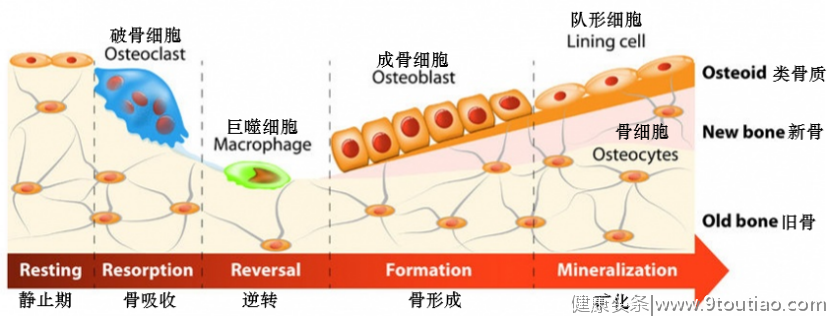
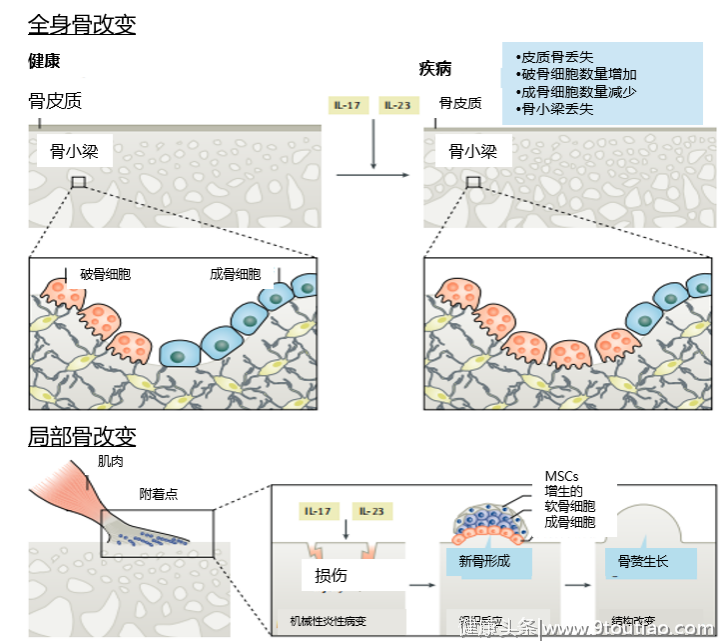
一方面,在病程较早期阶段,破骨细胞数量的增加和成骨细胞数量的减少导致椎体中心骨小梁过多丢失、骨质减少,患者发生骨质疏松、椎体骨折和脊柱畸形风险增加。例如,不同队列研究结果显示,AS患者中发生骨质疏松的概率为19%- 62%,而发生椎体骨折的概率为9%-42%[12];
另一方面,在局部水平上,如附着点处或骨侵蚀部位附近,MSC增殖、成骨细胞分化,导致骨赘形成、关节间隙消失,进而引起骨强直和功能结构的破坏。这是AS区别于RA的主要病理特征。
各种细胞因子对AS骨重塑的调节
在骨重塑过程中,各类型细胞的功能发挥均受到一系列复杂信号分子的调控,如相关转录因子、生长因子和细胞因子的激活以及各种基质蛋白的相互作用。研究细胞因子对AS骨重塑过程的调控作用对于我们理解其发病机制至关重要,它们将免疫调节与骨代谢联系起来,认识这种联系将有助于我们对疾病治疗进行更深入和更具针对性的探索。许多细胞因子是破骨细胞、成骨细胞以及MSC功能的重要调节因子。如白介素-1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)可协同地作用于破骨细胞形成并促进其功能,通过激活核因子κB(NF-κB)、诱导和增强核因子κB受体活化因子配体(RANKL)表达以促进破骨细胞的生存和迁移,并抑制成骨细胞活性[13];IL-17既能促进破骨细胞形成、增加骨吸收,也能诱导MSC分化为成骨细胞,增加成骨细胞活性[14];相反地,Th2细胞因子如IL-4、IL-13和IL-10以及干扰素(IFN)则可以抑制破骨细胞的形成和激活[13]。 表1:各种细胞因子对破骨/成骨细胞的影响及其可能的作用机制[13]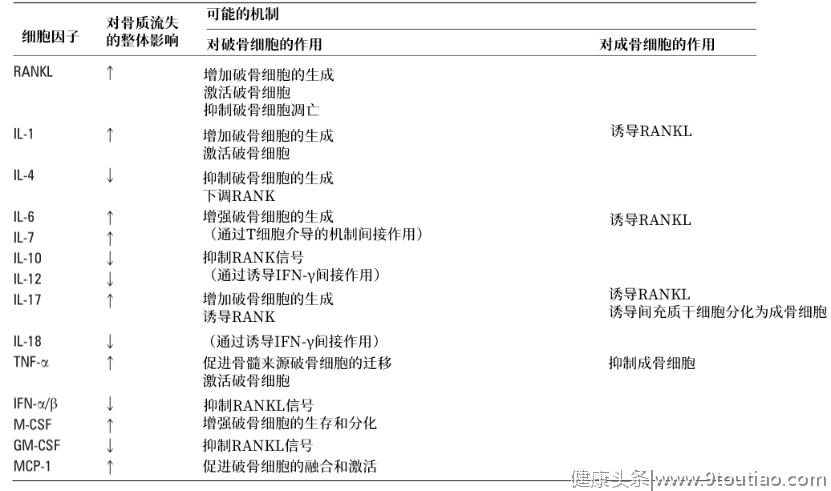
尽管诸多细胞因子对骨细胞均具有调节作用,但在不同疾病的病理机制中,发挥关键作用的细胞因子却有所不同。比如,在AS患者中的血清和骶髂关节中,虽然TNF-α和IL-6的表达水平明显升高,但阻断IL-6受体信号转导未能在AS治疗中显示临床疗效,说明IL-6在AS的发病机制中并不是关键细胞因子;TNF-α抑制剂虽有效地改善了患者疾病症状、身体功能和生活质量,但其对病程中的结构损伤是否具有延缓作用未有定论。近年发现,在AS患者的血清中,IL-17和IL-23呈现高水平的表达,靶向IL-17的治疗方案不仅能显著缓解疾病症状体征,也能有效抑制影像学进展[15]。这提示,IL-17可能是AS骨重塑过程中的关键细胞因子。4
小结
AS是一种在进展过程中影像学异常表现相对明显的疾病,骨骼病变从骶髂关节逐渐向上至脊椎骨,可导致脊柱周围韧带钙化而致骨性强直,致残率高。在这一变化过程中,骨代谢的异常调节和骨重塑的失衡起了关键的作用,不同类型的细胞及细胞因子参与其中,研究它们的作用机制有助于我们探寻疾病有效的治疗方案。下一期,我们将聚焦于细胞因子网络中的“新晋流量”IL-17A,详细探讨其在AS骨代谢、骨重塑过程中的重要作用,敬请期待!

中山大学附属第一医院风湿免疫科副主任,主任医师,教授,博士生导师
主要从事类风湿关节炎的发病机制研究,迄今已主持8个国家自然科学基金资助课题,以通讯作者在J Clin Invest、Arthritis Rheum、J Immunol等国际主流期刊发表SCI论文20多篇
《中华临床免疫和变态反应杂志》、《中华临床免疫和风湿病杂志》编委、《中华风湿病学杂志》通讯编委; Journal of Translational Autoimmunity编委;Nature Review Rheumatology、 Rheumatology、Cell Signal等国际多种期刊审稿专家
国家自然科学基金、荷兰皇家风湿病基金会、奥地利科学基金会、英国关节炎研究基金会的同行评审专家
第二、三届广东医师协会风湿免疫病分会副主任委员、广东省医学会风湿病学分会常委、广东省中西医结合学会风湿病分会副主任委员、广州市医学会风湿病学分会副主任委员、中国医疗保健国际交流促进会风湿免疫病分会委员等
参考文献:
[1] Jang JH, et al. Radiology. 2011, 258(1):192-8.[2] 孙学术, 等. 继续医学教育. 2018, 32(4): 135-138.[3] 马新发, 等. 中华全科医师杂志. 2014, 13(4): 262-264.[4] 胡拯源, 等. 中华内科杂志. 2019, 58(3):167-169.[5] Atagündüz P, et al. Arthritis Rheumatol. 2020; 72 (suppl 10). Abstract #1882.[6] Braun J, et al. Ann Rheum Dis. 2002, 61 Suppl 3(Suppl 3): iii9-23. [7] Goldring SR. Curr Rheumatol Rep. 2013, 15(7):342. [8] Baum R, et al. Clin Rev Allergy Immunol. 2016, 51(1):1-15. [9] Hadjidakis DJ, et al. Ann N Y Acad Sci. 2006, 1092:385-96.[10] Gravallese, E.M.et al.Nat Rev Rheumatol.2018(14):631-640.[11] 胡劲涛, 等. 中国骨质疏松杂志. 2019, 25(6): 875-879.[12] Klingberg E, et al. J Rheumatol. 2014, 41(7):1349-56.[13] Datta HK, et al. J Clin Pathol. 2008, 61(5):577-87.[14] T. Russell, et al. Ann Rheum Dis, volume 79, supplement 1, year 2020, page 1117[15] Amarasekara DS, et al. J Immunol Res. 2015; 2015: 832127.简短处方信息
注意:处方前,应参考完整处方资料。
药品名称:司库奇尤单抗注射液
药品规格:1ml;150mg
包装:预装式注射器装:每盒1支;每盒2支
预装式自动注射笔装:每盒1支(预装式自动注射笔);每盒2支(预装式自动注射笔)
适应症:银屑病用于治疗符合系统治疗或光疗指征的中度至重度斑块状银屑病的成年患者。强直性脊柱炎用于常规治疗疗效欠佳的强直性脊柱炎成年患者。
用法用量:须由在治疗方面有经验的医生指导和监督下使用本品。用量银屑病推荐剂量为每次300mg,分别在第0、1、2、3、4周进行皮下注射初始给药,随后维持该剂量每4周给药一次。300mg剂量分2针给药,每针150mg。同时,对于体重低于60kg的患者,给药剂量可以考虑150mg。强直性脊柱炎本品的推荐剂量为每次150 mg,在第0、1、2、3和4周皮下注射初始给药,随后维持该剂量每4周给药一次。用法本品应皮下注射给药。如可能,应避免在银屑病皮损部位进行注射。注射前,从冰箱中取出本品,在不取下针帽的情况下,待其温度升至室温后(15-30分钟)使用。本品从冰箱取出后须在1小时内使用。给药前,通过目视检查本品有无颗粒物以及是否发生变色。如发现液体内存在可见颗粒物,或液体浑浊、变色,则不得使用。
禁忌:对本品活性成份或任何一种辅料存在重度超敏反应的患者禁用。临床上重要的活动性感染(例如:活动性结核,见【注意事项】)。
注意事项:
感染:本品可能会增加感染的风险。临床研究中,在接受本品治疗的患者中观察到感染的发生(见【不良反应】),大多数为轻度或中度。存在慢性感染或复发性感染病史的患者应慎用本品。应指导患者在出现提示感染的体征或症状时,咨询医生意见。如患者出现严重感染,应对患者进行密切监测,并停用本品,直至感染消退。临床研究中未报告结核病易感性增加,但活动性结核病患者不应给予本品治疗。潜伏性结核病患者在接受本品治疗之前应考虑进行抗结核病治疗。
炎症性肠病:患有活动性炎症性肠病(例如克罗恩病、溃疡性结肠炎)的患者应慎用本品。在临床研究中司库奇尤单抗组和安慰剂组均观察到炎症性肠病加重病例,且某些病例病情较为严重。应对接受本品治疗的活动性炎症性肠病患者进行密切监测。
超敏反应:临床研究中,接受本品治疗的患者中曾观察到罕见的速发过敏反应。如发生速发过敏反应或其它严重的过敏反应,应立即停用本品,并采取适当的治疗措施。
乳胶敏感人群: 本品预装式注射器中可拆卸针帽含有天然胶乳的衍生物,针帽中未检测到天然胶乳。
疫苗:活疫苗不得与本品同时使用。
特殊人群用药:
儿童用药:尚未确定本品在18岁以下患者中的安全性和有效性。
老年用药:老年患者无需调整剂量。
孕妇及哺乳期妇女用药:孕妇:孕妇使用本品的相关数据有限。只有当获益明确大于潜在风险时才可在妊娠期使用本品。哺乳期妇女:哺乳期妇女应慎用本品。
不良反应:本品最常报告的药物不良反应(ADRs)是上呼吸道感染(最常见的是鼻咽炎、鼻炎)。十分常见(≥1/10):上呼吸道感染常见(≥1/100至< 1/10):口腔疱疹、腹泻、流涕偶见(≥1/1,000至<1/100):口腔念珠菌病、中性粒细胞减少症、足癣、结膜炎、外耳炎、下呼吸道感染、炎症性肠病、荨麻疹罕见(≥1/10,000至<1/1,000):速发过敏反应、剥脱性皮炎(在银屑病患者中有病例报道)发生频率未知:粘膜和皮肤念珠菌病(包括食管念珠菌病)所选不良反应的描述感染在本品治疗斑块状银屑病的临床研究中,司库奇尤单抗组和安慰剂组在对照期间分别有28.7%和18.9%的患者报告了感染,这些感染病例大多数是不严重的、轻度至中度的上呼吸道感染,不需要停止本品治疗。粘膜和皮肤念珠菌病的病例也有增加,这些病例严重程度为轻度至中度,不需要停止治疗。在本品治疗强直性脊柱炎等适应症的临床研究中观察到的感染率与本品在银屑病研究中观察到的结果相似。中性粒细胞减少症在银屑病III期临床研究中,司库奇尤单抗组中观察到中性粒细胞减少症的频率高于安慰剂组,但大多数病例为轻度、一过性且可逆的。在强直性脊柱炎等适应症患者中发生中性粒细胞减少症的频率与银屑病患者相似,曾报告了中性粒细胞减少至低于0.5×109/L(CTCAE 4级)的罕见病例。超敏反应在临床研究中,观察到了荨麻疹和速发过敏反应的罕见病例。免疫原性本品治疗银屑病、强直性脊柱炎等适应症的临床研究显示,在长达52周的治疗期间仅有不到1%的患者出现抗司库奇尤单抗抗体。治疗中出现的抗药抗体中半数为中和性抗体,但与药物失效或PK异常无关。药物相互作用:活疫苗不得与本品同时使用。在一项本品治疗斑块状银屑病的研究中,未见本品与咪达唑仑(CYP 3A4底物)间的相互作用。在本品治疗关节炎(包括强直性脊柱炎等)的研究中,当本品与甲氨蝶呤(MTX)和/或皮质类固醇同时给药时,未观察到相互作用。