哮喘药物新靶点,基因组学重新定位治疗
哮喘是一种与气道重塑相关的异质性炎症性气道疾病,患者由于气道阻塞和气道高反应性而出现气短、气喘等症状。预计到2025年,哮喘将影响全球4亿人。目前,哮喘治疗主要基于吸入皮质类固醇和支气管扩张剂,抑制症状而不是改变疾病的自然病史,不足以控制5%-10%的患者的症状。哮喘被认为一种真正的多因素疾病,由多种环境因素和个体遗传组成结合所致的相互作用,但同时也意味着了解哮喘的遗传基础有可能解开致病机制的问题。
在过去30年里,人们对了解哮喘的遗传危险因素的兴趣增加。这些风险因素主要是单碱基对变异,即单核苷酸多态性(SNP),这是一种等位基因频率在人群中超过1%的遗传变异。之后引入阵列技术,并使全基因组关联研究(GWASs)成为可能,分析患有和不患有哮喘的大量人群。在过去3年里,大样本的合作研究以前所未有的速度加速对哮喘遗传基础的理解,使哮喘相关的独立基因座数目增加到128个。
近日,《柳叶刀呼吸医学》杂志发布了哮喘遗传学的最新进展,提供了来自GWASs的最新基因发现;利用表达数量性状位点(eQTL)定位和编码变异,将哮喘相关的SNP与可能的药物靶点联系起来,提出了新的药物靶点;并考虑了基于基因组学的药物重新定位治疗哮喘的可能性。
哮喘的GWAS与基因网络
第一份哮喘GWAS结果于2007年发布,指出了染色体17q12-21的遗传变异与儿童哮喘有关。该位点的哮喘相关SNP与淋巴母细胞系中ORMDL3的mRNA表达水平相关。随后的研究还将该位点的SNPs与全血细胞和肺组织中GSDMA、GSDMB、CRKRS、zpbb2和IKZF2的表达联系起来。2017年研究发现,在一个特定的位点上密切相关的SNP可能都与哮喘有关,但只反映一个独立的信号。在分析SNP的独立性的基础上,产生了31个顶级SNP。截至2019年4月,已发表论文确定了128个独立哮喘相关SNPs。(如图1)
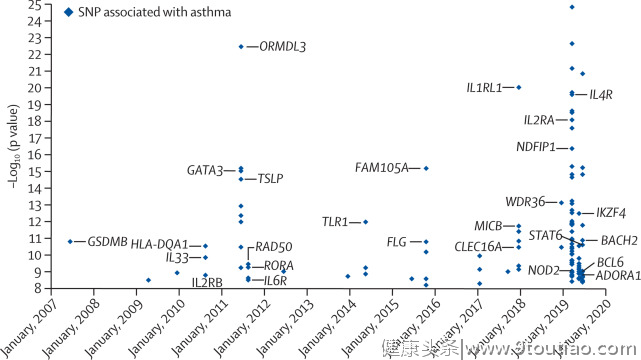
图1 2007-2019年欧洲人群中与哮喘相关的顶级SNPs
值得注意的是,17q12-21位点与儿童期哮喘有关,但与成人期哮喘无关。这一关联表明,遗传危险因素对哮喘患者的亚群可能特别重要。
此外,GWAS可用于识别复杂疾病背后的生物网络。假设哮喘靶基因不是孤立地起作用,而是可能聚集在与疾病发展有生物学相关性的网络中(如图2)。对这些网络的识别可能为下游干预提供新的机会。
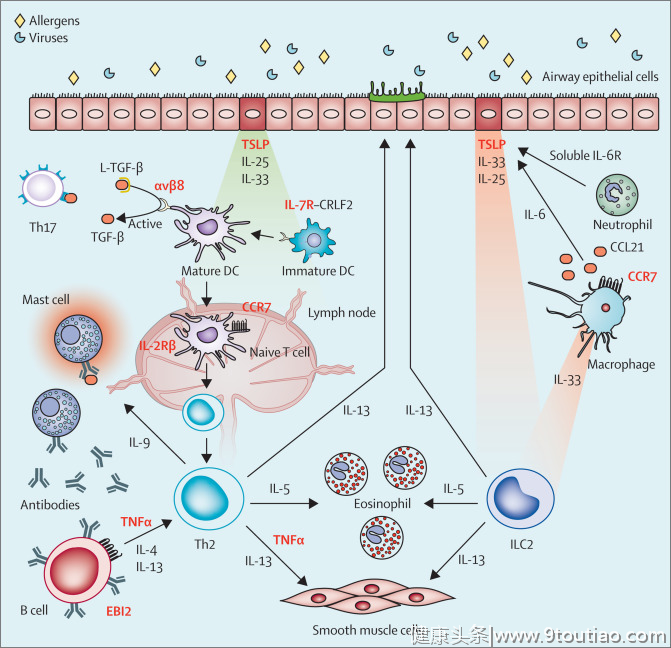
图2 部分关键基因的促炎功能
这种通路阻断的方法通常用于癌症治疗,因为一种癌症可能是由于不同患者的不同基因突变引起,但也可以通过阻断一个共同的下游通路来治疗。GWASs在哮喘中涉及的途径或基因网络如导致嗜酸性粒细胞增多的IL-33–IL-1RL1受体途径(导致嗜酸性粒细胞增多),或T辅助型2(Th2)细胞因子IL-5和IL-4RA受体(导致2型炎症或病毒反应)。
研究将161个哮喘靶基因通过多途径分析,共发现了47条基因富集途径,每条途径中均有3-8个基因。同时,研究观察到免疫通路的优势,尤其是受到MHC II和细胞因子及其受体(IL-33、IL-1RL1、IL-6R、IL-2)驱动的通路,如IL-2和IL-4信号通路、Th2途径、T细胞与B细胞相互作用途径以及腺苷A1受体信号途径。
但与此同时,161个哮喘靶基因中有71个(44%)没有被注释到任何途径,如GSDMB、WDR36、ADAMTS4和PEX14,这表明目前对哮喘靶基因的生物学解释由于缺乏功能证据而受到限制。
基于哮喘遗传学的靶点发现与药物重新定位
为了使药物有效,它需要靶向与疾病因果途径有关的蛋白质或这种因果途径的生理抑制剂。在药物靶点验证之后,药物开发仍然是一个耗时耗资的过程,包括毒理学研究、确定药物的理化性质、优化制造工艺和药物配方,然后进行三个阶段的临床试验。因此,与疾病高度相关但不是致病机制的一部分的生物标志物不是合适的药物靶点。
GWASs可以识别与疾病相关的基因,从而为验证现有靶点和揭示新的药物靶点提供了一种强有力的技术。许多疾病的遗传学研究已经确定了编码蛋白质的基因,这些蛋白质已经被市场上的药物所靶向。例如,一项血脂异常的GWAS鉴定出HMGCR基因,该基因编码HMG-CoA还原酶蛋白。HMGCR的靶向是他汀类药物,他汀类药物被开发用于降低血液中胆固醇的浓度。这一发现具有高度相关性,因为它已经表明,以基因研究为靶点的药物上市成功率(从第一阶段到批准)大约是为没有遗传证据的靶点开发的药物的两倍。虽然呼吸疾病领域没有基于基因组学的靶点发现的例子,但脂质领域的例子可能说明了它的潜力。
遗传学也可以用来帮助预测靶点的“副作用”,比如那些有所谓保护性基因变异的个体。例如,那些在IL33中有一个罕见的遗传变异(rs146597587-C)的人,哮喘发生的风险较低,循环血嗜酸性粒细胞也较低。这表明降低IL-33浓度或部分阻断IL-33功能是安全的。
最新研究将现有的142个蛋白质编码基因(即潜在的哮喘药物新靶点)分为了两类:一,针对药物靶点发现,选择药物处于临床开发1期或更早的靶点;二,对于药物重新定位,选择了在2期临床试验或更高阶段临床开发药物的目标(如图3)。
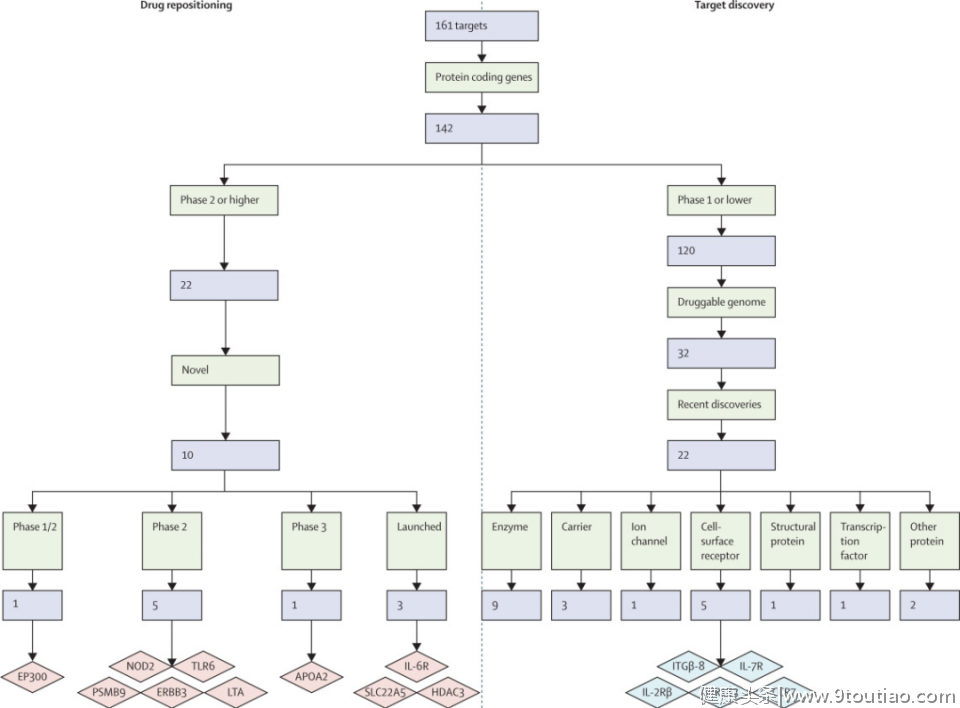
图3 靶点筛选步骤(使用Drug Research Advisor数据库)
根据以上步骤及多次筛选,最终产生了22个药物靶点(如表1)。这22个靶点分为7类,包括酶、细胞表面受体、载体、离子通道、结构蛋白、转录因子等)。细胞表面受体可产生有趣的候选药物,因为它们很容易被激动剂激活,或被竞争性拮抗剂及配体导向、受体导向抗体所拮抗。研究强调了以下编码受体的靶基因:IL7R、CCR7、IL2RB、ITGB8和GPR183。
表1 哮喘新的药物靶点
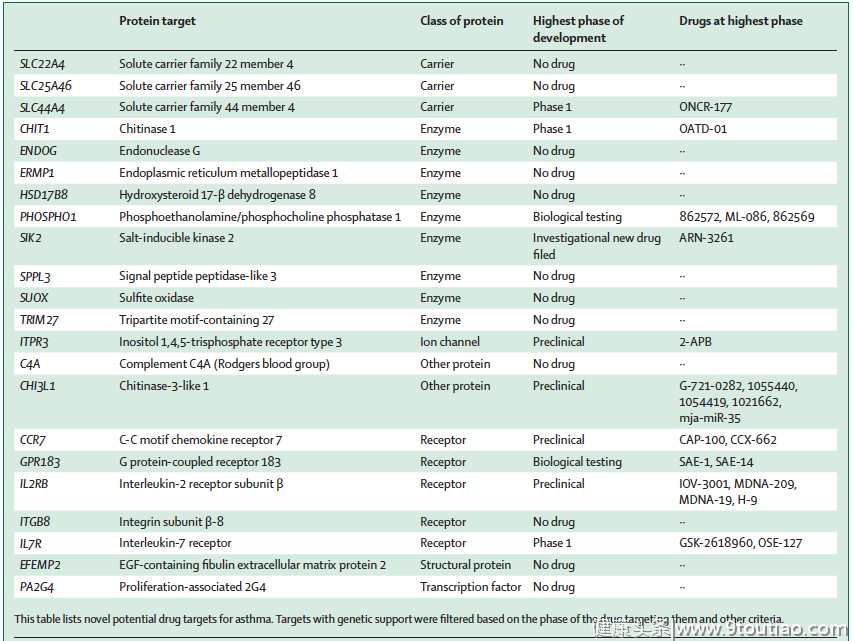
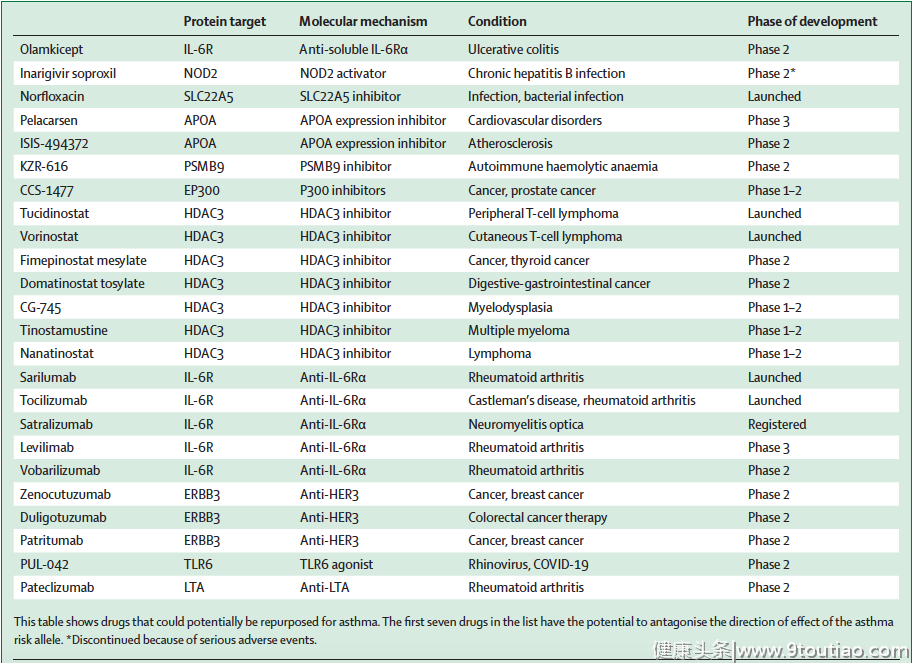
药品重新定位的概念是指对某一特定条件下上市或开发中的药品进行鉴定,目的是将其用于另一种疾病。因为已经建立了药物安全性,这种方法提高了药物开发效率,降低了成本和时间。分析表1中22个靶基因的在研药物发现,有些是目前可用的,有些是在2期或更高阶段的临床研究中。其中10个是针对哮喘的新靶点(见图3)。
在这10个新靶点中,3个靶点的药物已经上市,分别为靶向HDAC3的tucidinostat和vorinostat,靶向IL6R的sarilumab和tocilizumab,以及靶向SLC22A5的诺氟沙星;1个靶点(APOA2)的药物处于3期临床试验;5个靶点处于2期临床试验,分别靶向ERBB3、NOD2、TLR6、LTA、PSMB9;1个靶点(EP300)的药物处于1/2期临床试验。(如表2)其中有两个突出的靶点需要强调,即IL6R和NOD2。
表2 针对哮喘的推荐药物
未来发展方向
在靶向治疗的发展中,使用基因研究方法可能会为精确医学在以下三种不同情况下铺平道路。
第一,基因测试可以识别那些风险基因型与市场上的药物靶点有关的基因型。有遗传风险的个体可能比没有风险基因型的人对这种药物的反应更好。如果相当大比例的疾病是由这种风险等位基因引起的,针对该基因的疗法将可能是成功的。虽然已知哮喘基因变异在人群水平上能够解释哮喘的比例很小,但尚不清楚这些变异及其相互作用在个体水平上的重要性;需要进行干预研究来解决这个问题。
第二,哮喘风险等位基因也可能与生物标记物(如细胞因子或可溶性受体)相连,这些生物标记物可作为选择潜在应答者的标记物。例如,编码IL-33受体IL1RL1的基因中的哮喘风险变体与肺和血清中较低浓度的可溶性受体蛋白IL1RL1-a有关。这一发现可能表明,低浓度IL1RL1-a的个体对抗IL-33–IL1RL1治疗有反应,这有待进一步研究。
第三,对哮喘患者亚组的基因研究可能揭示出对该亚组很重要的基因变异,如儿童哮喘、嗜酸性哮喘或中重度哮喘患者。在这种表型驱动的方法中,针对这些表型特异基因的药物可能对这些患者亚群有效。
除了遗传学,许多因素可能最终决定治疗反应。个体间和个体内治疗反应的这种差异可能是由于不同的因素造成的,如时间特异性和组织特异性表观遗传效应、主要的免疫炎症途径、重塑组织的贡献以及靶点药物的局部效应和浓度。此外,环境因素如吸烟、过敏原暴露、营养或微生物因素可能与遗传因素相互作用,从而影响哮喘的临床特征、病程和治疗反应。
尽管在过去的几年里已经发现了许多新的哮喘靶基因,但一个重要的问题仍然存在:医学和科学领域如何利用这些见解来开发新的药物或重新利用现有治疗哮喘的药物?最近在哮喘基因变异鉴定方面的进展指出了许多有趣的药物靶点,包括经典的表面受体。此外,利用基于基因组学的药物重新定位,如现有的药物olamkicept和inarigivir soproxil,可能会被用于哮喘患者的临床研究。
研究指出,目前的回顾和分析受到在欧洲血统人群研究中占主导地位的限制,迫切需要对其他种族的人群进行更多的研究。更重要的是,对于许多哮喘基因来说,相关的途径研究是缺失的,因为功能证据的出现滞后于基因发现。整合基因发现、功能证据和治疗干预的多学科研究可能为开发急需的哮喘治疗方法提供一条前进的道路。
参考文献
1. The genetics of asthma and the promise of genomics-guided drug target discovery.
2. The global asthma report.
3. Allergic diseases and asthma: a global public health concern and a call to action.
4. Pathophysiology of severe asthma.
5. Genetics of asthma: an introduction for the clinician.
6. Microbial genome-wide association studies: lessons from human GWAS.
7. Sample size for successful genome-wide association study of major depressive disorder.
8. A sequence variant on 17q21 is associated with age at onset and severity of asthma.
9. Lung eQTLs to help reveal the molecular underpinnings of asthma.
10. Lessons from ten years of genome-wide association studies of asthma.
11. Moderate-to-severe asthma in individuals of European ancestry: a genome-wide association study.
12. Molecular mechanisms of disease-causing missense mutations.
13. The druggable genome and support for target identification and validation in drug development.
声明:本文观点仅代表作者本人,不代表药智网立场,欢迎在留言区交流补充;如需转载,请务必注明文章作者和来源。

球点赞
球在看