最新消息!又一款丁肝治疗药物进入Phase 3期临床研究
继专注于罕见和超罕见疾病靶向治疗开发和商业化的生物制药公司 Eiger BioPharmaceuticals 2018年12月宣布公司在研丁型肝炎新药 lonafarnib 进行 Phase 3 期临床试验之后,近期,又一款在研丁肝新药 Myrcludex (Bulevirtide) 开始 Phase 3 期临床试验。

Myrcludex (Bulevirtide) 是一款由 MYR-GmbH Pharmaceuticals 公司研发的用于乙型肝炎和丁型肝炎合并感染治疗的病毒进入抑制剂(Entry inhibitor)。该项研究旨在评估 Bulevirtide 在慢性丁型肝炎(CHD)患者中的长期疗效和安全性。将在48周疗程评估该药的主要疗效和安全性数据,Bulevirtide 的用药剂量为每天2-10mg,并跟 delayed 治疗进行比较。在第48周后,接受的 delayed 治疗的患者将转换为 Bulevirtide 10mg 每日治疗额外的96周。该phase 3期研究的治疗时间将为期144周。

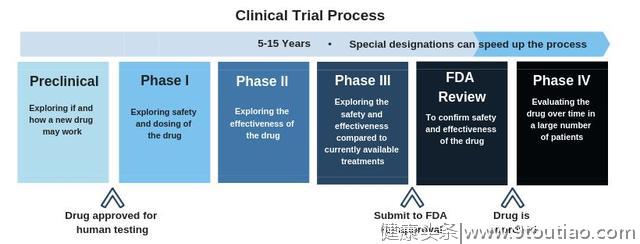
Phase 3 期临床研究将新的可能治疗与当前的标准治疗进行比较,以确定它是否比目前的标准治疗更有效和/或更安全。Phase 3期临床研究是一项随机对照试验,这意味着患者将被分配到几个不同治疗组中的一个。这些研究通常会在一个很长时间周期内对新疗法进行评估,但这种疗法或药物是已获得美国食品药品管理局(FDA)和欧洲药品管理局(EMA)特殊指定资质的,如快速通道,孤儿药,突破疗法指定和 PRIME 资格状态,获得这些资质将有助于加快这一疗法/药物研发进程,并更快地使这些药物获得批准上市。目前唯一批准的丁型肝炎治疗药物是聚乙二醇干扰素,其有效率通常不到30%,因此急需尽快开发更多新型治疗方案以满足未满足的需求。
Lonafarnib 的3期临床试验目前正在美国招募乙型肝炎和丁型肝炎合并感染的患者。还宣布在 92 个国际试验中心开展该项研究,包括比利时,保加利亚,加拿大,法国,德国,希腊,以色列,意大利,摩尔多瓦共和国,新西兰,巴基斯坦,罗马尼亚,西班牙,瑞士,台湾,土耳其举行,英国和越南。这项由 Eiger Biopharmaceuticals 运营的临床试验将测试新药 Lonafarnib 与其他治疗方法的联合用药。MYR-GmbH Pharmaceuticals 公司研发的 Bulevirtide 也宣布其 phase 3期临床试验将会在 2019年开放。试验地点地点尚未公布。Myrcludex 另一个为人所知的是在慢乙肝治疗领域的应用,目前该药用于慢乙肝治疗的临床试验目前已经进展至 Phase 2b 期,若无意外,相信不久也将进入 phase 3期。关于丁型肝炎
丁型病毒性肝炎是由丁型肝炎病毒(HDV)与乙型肝炎病毒等嗜肝DNA病毒共同引起的传染病。本病呈全世界性分布,尤其意大利南部呈高度地方性流行,发展中国家HBsAg携带率较高,有引起HDV感染的基础。我国调查报告提示有地方性流行,各地HBsAg阳性者HDV感染率为0%~32%,总的看,北方偏低,南方偏高。重型肝炎和慢性肝病者HDV感染率先明显高于无症状HBsAg携带者。主要通过输血和血制品传播,与乙型肝炎的传播方式相似。HDV与HBV重叠感染后,可促使肝损害加重,并易发展为慢性活动性肝炎、肝硬化和重型肝炎。
来源:肝脏时间