生物活性肽与酒精性肝病

酒精性肝病 alcoholic liver disease,ALD)是由于过度饮酒,特别是长期过量饮酒导致的肝疾病,初期表现为脂肪肝,进而发展为酒精性肝炎、肝纤维化和肝硬化。ALD是人类已知最古老的肝损伤形式,早在19世纪中叶,就出出现了对酒精和脂肪肝关系的详细描述。目前,ALD给人类健康带来了极大威胁,已经成为全球疾病负担的重要组成部分。在我国ALD是仅次于病毒性肝炎的第二大肝病病因,且随着生活水平的提高,我国酒或含酒精饮料的消耗量大量增加,其发病或死亡近年来呈迅速增长趋势。然而人们对酒精性肝病的认识,并不像对乙型肝炎、非酒精性脂肪性肝病那样重视和全面,尤其是在ALD患者的预防和治疗方面的认识不足更为突出,需要引弓起关注和重视。酒精性肝病在我国近年来有明显增多的趋势,已成为仅次于病毒性肝炎的第二大肝病病因。发病率高,后果严重,加之酒精中毒对神经系统、生殖系统及优生优育的影响,使酒精性肝病已成为一种严重危害人民健康的疾病。
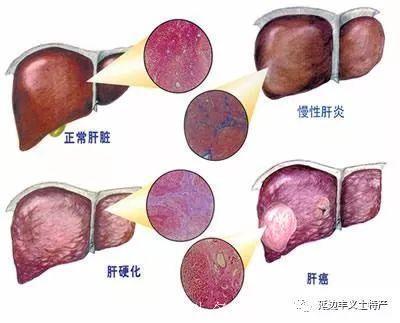
作为一种肝毒素,酒精( alcohol)是所有肝疾病最主要的危险因素,过量或有害的酒精摄入导致肝损伤,从而引引起一系列疾病,称为酒精性肝病( alcoholic liver disease,ALD),主要包括轻症酒精性肝损伤、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化五种,其中中酒精性脂肪肝、酒精性肝炎和酒精性肝硬化在临床上最为常见。肝细胞脂肪变是机体对酒精摄入的早期反应,90%发生于严重酗酒者。疾病的早中期多发生脂肪变,但有约30%的酗酒者发展至严重的酒精性肝病,比如酒精性肝纤维化和肝硬化。严重酗酒时可诱发广泛的肝细胞坏死,甚至造成肝功能衰竭,此时称为重症酒精性肝炎。在酒精摄入过多人群中可以出现严重的肝并发症,主要为门脉高压、肝衰竭及相关临床表现。

ALD的危险因素包括性别,肥胖,饮酒量,年限,酒精饮料种类,饮酒方式,遗传因素,营养状况,吸烟等。一般来说女性对酒精介导的肝毒性更敏感,因为女性体内乙醇脱氢酶( alcohol dehydrogenase,ADH)的的水平较低,且具有更高的体脂含量及较高的雌激素;肥胖可以加速肝纤维化、肝硬化的进程,有研究显示肥胖和酒精摄入参与细胞应激、巨噬细胞激活和脂联素抵抗的过程;种族、遗传及个体差异也是酒精性肝病的重要危险因素。汉族人群的酒精性肝病易感基因乙醇脱氢酶ADH2(alcohol dehydrogenase2)、ADH3( alcoho/dehydrogenase3)及乙醛脱氢酶ALDH2( acetaldehyde dehydrogenase2)等位基因频率以及基因型的分布不同于西方国家,可能是中国嗜酒人群和酒精性肝病的发病率低于西方国家的原因之一。此外,并不是所有的饮酒者都会出现酒精性肝病,只是发生在一小部分人群中,表明同一地区群体之间还存在着个体差异。
肝炎病毒感染与酒精对肝损害起协同作用,在乙型肝炎病毒( hepatitis B virus,HBV)丙型肝炎病毒( hepatitis C virus,HCV)以及人类免疫缺陷病毒( human immunodeficiency virus,HV)感染基础上饮酒,或在酒精性肝病基础上并发HBV或HCV感染,都可加速肝病的发生和发展。

ALD可分为轻症型酒精性肝病( mild alcoholic injury,MAI)、酒精性脂肪肝( alcoholicfatty liver,AFL)、酒精性肝炎( alcoholic hepatitis,AH)、酒精性肝纤维化( alcoholic hepatic fibrosis,AHF)和酒精性肝硬化( alcoholic cirrhosis,AC)等5种类型。
轻症型酒精性肝病:轻症型酒精性肝病是指短时间饮入过量酒精引起的肝急性应激反应和损伤。酒精精吸收入血后大部分被肝乙醇脱氢酶系统代谢成乙醛,而后被乙醛脱氢酶氧化成乙酸,最后氧化成二氧化碳和水。乙醛代谢缓慢容易蓄积,对肝细胞具有直接毒性作用。而且,乙醛及酒精代谢途径CYP2E1都会引弓起活性氧和活动氮增多,干扰肝细胞的正常生理功能,从而造成损伤。
酒精性脂肪肝:长期酗酒会造成脂肪酸在肝蓄积,其原因可能与酒精代谢过程中对NAD+的需求过多有关。高水平NADH会促进脂肪酸的合成,而低水平NAD+会抑制脂肪酸的氧化分解,从而导致脂肪酸浓度升高,促进肝脏三酰甘油的合成。另外,肝细胞氧化还原状态失衡、自由基生成过多以及乙醛蓄积也是引起脂质过氧化的重要因素。
酒精性肝炎:10%~30%的酗酒者会发展成酒精性肝炎,但其机制与酒精摄入的剂量无明显相关,具有很强的个体差异性。酒精性肝病患者体内炎症调节因子(如TNF-a、黏附因子、ROS、RNS,肿瘤坏死因子受体)、细胞因子和趋化因子(如L-6和和L-8、MCP-1、MP-1)含量升高,通过炎症反应造成肝损伤。其发展的机制与肝细胞脂肪变性有很大的关系,并且更容易发展成为肝纤维化。
酒精性肝纤维化、肝硬化:酒精肝损伤过程中,在坏死性炎症区域会出现大量的肌纤维母细胞,这些肌纤维母细胞通过分泌大量的胶原蛋白I、Ⅲ,造成肝细胞外基质成分改变,并且通过表达高水平的TIMP-1(金属蛋白酶组织抑制剂)阻止这些基质成分的正常降解,从而弓引起肝纤维化。酒精性肝纤维化伴有肝硬化是酒精性肝病的晚期病理变化,伴随肝炎症、纤维化和细胞损伤等,最终出现瘢痕和坏死。主要症状有黄疸、细胞肿大、疼痛和肝实质硬化,最终出现肝衰竭。

ALD已成为一个世界范围内的公共卫生问题,全球各地区及各国都在致力于减少酒精的有害使用,降低ALD的发病率,虽然现代医学获得了突飞猛进的进展,但是目前临床上仍缺乏治疗ALD的有效手段。近年来,来源于食品的生物活性肽由于具有多种生理功能益得到研究者的关注。生物活性肽对于肝的保护作用已有报道,如谷胱甘肽、大豆多肽、灵芝肽、玉米肽/鲨肝活性肽、脑利钠肽和血管活性肠肽等。目前生物活性肽已经在临床上有了一定的应用,如谷胱甘肽,且对于其疗效的评价已进行了多项研究。如桂英等通过建立小鼠肝损伤模型,然后再给予大豆多肽(大豆蛋白经复合酶水解并纯化的一种活性多肽),研究发现大豆多肽可显著降低肝损伤动物的肝三酰甘油油含量,并可以明显地减轻酒精所造成的肝组织结构改变:肝细胞内无明显空泡及疏松,脂滴沉着较少,脂肪变性的肝细胞百分比随着大豆多肽剂量的升高而明显降低。
当前小分子肽类的抗氧化作用已经取得了大部分研究者的共识,而氧化应激被认为是酒精代谢致肝损伤的主要因素,并且已经有实验报道小分子肽可改善早期肝损伤,如人参低聚肽、海洋胶原肽、大豆肽等。小分子肽类是现今防治ALD发展展的潜在方向,作为防治ALD的药物在保健食品的开发领域里具有广泛的前景。