Nature:科学家发现β细胞中的新型胰岛素信号抑制因子!可能造福糖尿病患者
糖尿病是我们人尽皆知的内分泌疾病,在全球范围,糖尿病的患病率和发病率都急剧攀升,威胁人类的身体健康。但具体病因和发病机制尚不明确,可能是遗传和环境因素的共同参与,由于免疫介导的胰岛B细胞的选择性破坏所致。因此,使胰腺β细胞对胰岛素敏感的疗法可以保护糖尿病患者免于β细胞衰竭。
2021年1月27日,德国亥姆霍兹慕尼黑中心Heiko Lickert团队在《自然》杂志上在线发表了篇为“Inceptor counteracts insulin signalling in β-cells to control glycaemia”的文章,文章揭示在β细胞中发现一种新型胰岛素信号通路的抑制因子,可控制血糖。 DOI: 10.1038/s41586-021-03225-8在本篇文章中,研究人员在鉴定新的胰腺调节因子的过程中,发现5330417C22Rik mRNA在胚胎期胰腺中强表达。其相关基因叫做雌激素诱导基因(EIG121,也称为ELAPOR1或KIAA1324),在小鼠中其基因位于3号染色体上,有22个外显子,通过3个选择性剪接变异体转录,翻译成一个单程I型跨膜蛋白。与β细胞中胰岛素受体(INSR)的富含半胱氨酸结构域(CRD)和胰岛素样生长因子1(IGF1)受体(IGF1R)相比,KIAA1324的生物信息学分析揭示出该生长因子受体结构域4的CRD中的半胱氨酸残基具有保守性。此外,KIAA1324的甘露糖6-磷酸受体(M6PR)结构域与阳离子依赖性M6PR (CD-M6PR)和阳离子非依赖性M6PR (CI-M6PR)相似。因此由于KIAA1324与INSR、IGF1R和IGF2R在胞外结构域和KIAA1324抑制功能方面的相似性,研究人员将KIAA1324重新命名为胰岛素抑制受体(由基因Iir编码)。
DOI: 10.1038/s41586-021-03225-8在本篇文章中,研究人员在鉴定新的胰腺调节因子的过程中,发现5330417C22Rik mRNA在胚胎期胰腺中强表达。其相关基因叫做雌激素诱导基因(EIG121,也称为ELAPOR1或KIAA1324),在小鼠中其基因位于3号染色体上,有22个外显子,通过3个选择性剪接变异体转录,翻译成一个单程I型跨膜蛋白。与β细胞中胰岛素受体(INSR)的富含半胱氨酸结构域(CRD)和胰岛素样生长因子1(IGF1)受体(IGF1R)相比,KIAA1324的生物信息学分析揭示出该生长因子受体结构域4的CRD中的半胱氨酸残基具有保守性。此外,KIAA1324的甘露糖6-磷酸受体(M6PR)结构域与阳离子依赖性M6PR (CD-M6PR)和阳离子非依赖性M6PR (CI-M6PR)相似。因此由于KIAA1324与INSR、IGF1R和IGF2R在胞外结构域和KIAA1324抑制功能方面的相似性,研究人员将KIAA1324重新命名为胰岛素抑制受体(由基因Iir编码)。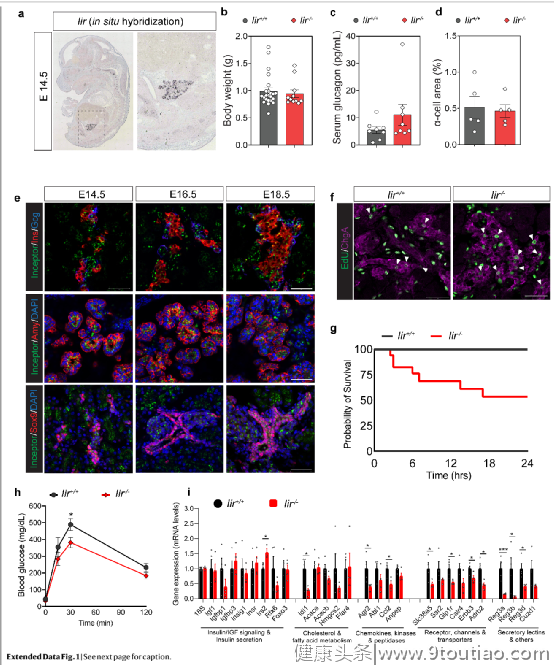 受体在所有胰腺谱系中的表达随后,作者进行了一系列的实验,证实受体调节β细胞的质量和血糖控制情况,发现缺乏受体(Iir-/-)的基因敲除小鼠表现出高胰岛素血症和低血糖症的迹象,并在出生后数小时内死亡。这说明Iir敲除导致胰腺发育过程中β细胞增殖和质量增加,并影响出生后的葡萄糖稳态。之后对Iir-/-小鼠的胚胎和产后胰腺进行分子和细胞分析表明,Iir-/-胰腺组织中INSR-IGF1R的激活增加,导致β细胞的增殖和质量增加。同样,成年小鼠和离体胰岛中可诱导的β细胞特异性Iir-/-敲除导致INSR–IGF1R的激活增加和β细胞增殖的增加,从而提高了体内的葡萄糖耐受量。
受体在所有胰腺谱系中的表达随后,作者进行了一系列的实验,证实受体调节β细胞的质量和血糖控制情况,发现缺乏受体(Iir-/-)的基因敲除小鼠表现出高胰岛素血症和低血糖症的迹象,并在出生后数小时内死亡。这说明Iir敲除导致胰腺发育过程中β细胞增殖和质量增加,并影响出生后的葡萄糖稳态。之后对Iir-/-小鼠的胚胎和产后胰腺进行分子和细胞分析表明,Iir-/-胰腺组织中INSR-IGF1R的激活增加,导致β细胞的增殖和质量增加。同样,成年小鼠和离体胰岛中可诱导的β细胞特异性Iir-/-敲除导致INSR–IGF1R的激活增加和β细胞增殖的增加,从而提高了体内的葡萄糖耐受量。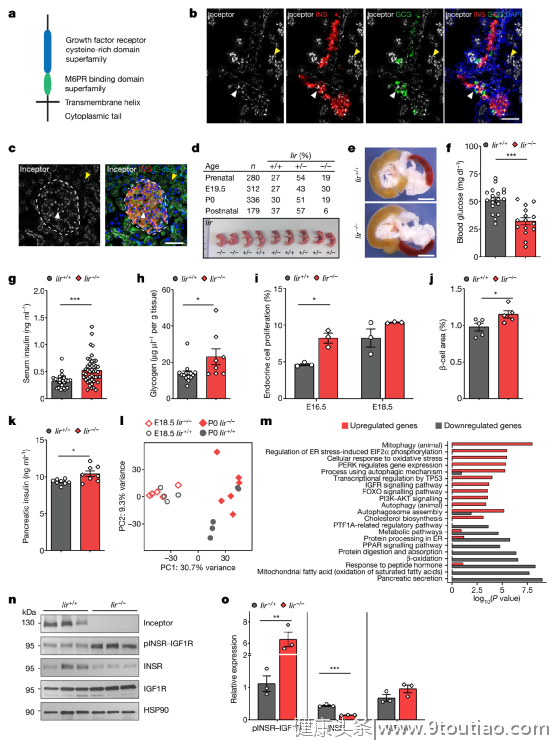 研究团队也对其产生的作用进行了机制研究,发现受体使网格蛋白介导的内吞作用成为可能。从机理上讲,受体与INSR–IGF1R相互作用以促进网格蛋白介导的内吞作用,使受体脱敏。而使用针对受体胞外域的单克隆抗体阻断这种物理相互作用时会导致受体和INSR保留在质膜上,从而维持β细胞中INSR–IGF1R的活化。
研究团队也对其产生的作用进行了机制研究,发现受体使网格蛋白介导的内吞作用成为可能。从机理上讲,受体与INSR–IGF1R相互作用以促进网格蛋白介导的内吞作用,使受体脱敏。而使用针对受体胞外域的单克隆抗体阻断这种物理相互作用时会导致受体和INSR保留在质膜上,从而维持β细胞中INSR–IGF1R的活化。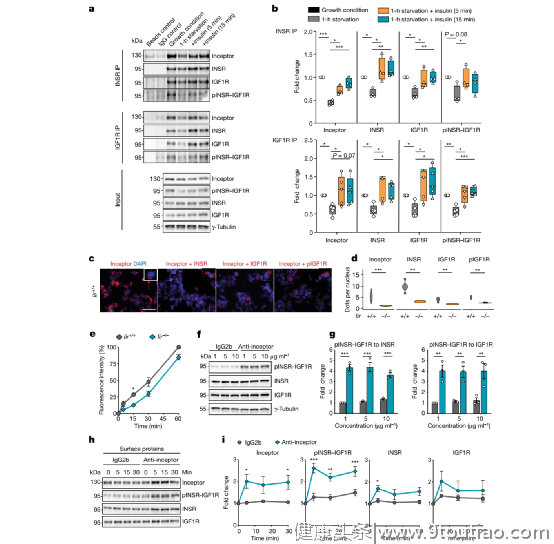 受体与INSR和IGF1R物理相互作用,以增强受体内化和脱敏总之,这些研究结果表明,受体可以保护胰岛素生产性β细胞免受组成途径的激活,并将受体鉴定为INSR–IGF1R敏感化和糖尿病治疗的潜在分子靶标。
受体与INSR和IGF1R物理相互作用,以增强受体内化和脱敏总之,这些研究结果表明,受体可以保护胰岛素生产性β细胞免受组成途径的激活,并将受体鉴定为INSR–IGF1R敏感化和糖尿病治疗的潜在分子靶标。
2021年1月27日,德国亥姆霍兹慕尼黑中心Heiko Lickert团队在《自然》杂志上在线发表了篇为“Inceptor counteracts insulin signalling in β-cells to control glycaemia”的文章,文章揭示在β细胞中发现一种新型胰岛素信号通路的抑制因子,可控制血糖。
 DOI: 10.1038/s41586-021-03225-8在本篇文章中,研究人员在鉴定新的胰腺调节因子的过程中,发现5330417C22Rik mRNA在胚胎期胰腺中强表达。其相关基因叫做雌激素诱导基因(EIG121,也称为ELAPOR1或KIAA1324),在小鼠中其基因位于3号染色体上,有22个外显子,通过3个选择性剪接变异体转录,翻译成一个单程I型跨膜蛋白。与β细胞中胰岛素受体(INSR)的富含半胱氨酸结构域(CRD)和胰岛素样生长因子1(IGF1)受体(IGF1R)相比,KIAA1324的生物信息学分析揭示出该生长因子受体结构域4的CRD中的半胱氨酸残基具有保守性。此外,KIAA1324的甘露糖6-磷酸受体(M6PR)结构域与阳离子依赖性M6PR (CD-M6PR)和阳离子非依赖性M6PR (CI-M6PR)相似。因此由于KIAA1324与INSR、IGF1R和IGF2R在胞外结构域和KIAA1324抑制功能方面的相似性,研究人员将KIAA1324重新命名为胰岛素抑制受体(由基因Iir编码)。
DOI: 10.1038/s41586-021-03225-8在本篇文章中,研究人员在鉴定新的胰腺调节因子的过程中,发现5330417C22Rik mRNA在胚胎期胰腺中强表达。其相关基因叫做雌激素诱导基因(EIG121,也称为ELAPOR1或KIAA1324),在小鼠中其基因位于3号染色体上,有22个外显子,通过3个选择性剪接变异体转录,翻译成一个单程I型跨膜蛋白。与β细胞中胰岛素受体(INSR)的富含半胱氨酸结构域(CRD)和胰岛素样生长因子1(IGF1)受体(IGF1R)相比,KIAA1324的生物信息学分析揭示出该生长因子受体结构域4的CRD中的半胱氨酸残基具有保守性。此外,KIAA1324的甘露糖6-磷酸受体(M6PR)结构域与阳离子依赖性M6PR (CD-M6PR)和阳离子非依赖性M6PR (CI-M6PR)相似。因此由于KIAA1324与INSR、IGF1R和IGF2R在胞外结构域和KIAA1324抑制功能方面的相似性,研究人员将KIAA1324重新命名为胰岛素抑制受体(由基因Iir编码)。 受体在所有胰腺谱系中的表达随后,作者进行了一系列的实验,证实受体调节β细胞的质量和血糖控制情况,发现缺乏受体(Iir-/-)的基因敲除小鼠表现出高胰岛素血症和低血糖症的迹象,并在出生后数小时内死亡。这说明Iir敲除导致胰腺发育过程中β细胞增殖和质量增加,并影响出生后的葡萄糖稳态。之后对Iir-/-小鼠的胚胎和产后胰腺进行分子和细胞分析表明,Iir-/-胰腺组织中INSR-IGF1R的激活增加,导致β细胞的增殖和质量增加。同样,成年小鼠和离体胰岛中可诱导的β细胞特异性Iir-/-敲除导致INSR–IGF1R的激活增加和β细胞增殖的增加,从而提高了体内的葡萄糖耐受量。
受体在所有胰腺谱系中的表达随后,作者进行了一系列的实验,证实受体调节β细胞的质量和血糖控制情况,发现缺乏受体(Iir-/-)的基因敲除小鼠表现出高胰岛素血症和低血糖症的迹象,并在出生后数小时内死亡。这说明Iir敲除导致胰腺发育过程中β细胞增殖和质量增加,并影响出生后的葡萄糖稳态。之后对Iir-/-小鼠的胚胎和产后胰腺进行分子和细胞分析表明,Iir-/-胰腺组织中INSR-IGF1R的激活增加,导致β细胞的增殖和质量增加。同样,成年小鼠和离体胰岛中可诱导的β细胞特异性Iir-/-敲除导致INSR–IGF1R的激活增加和β细胞增殖的增加,从而提高了体内的葡萄糖耐受量。 研究团队也对其产生的作用进行了机制研究,发现受体使网格蛋白介导的内吞作用成为可能。从机理上讲,受体与INSR–IGF1R相互作用以促进网格蛋白介导的内吞作用,使受体脱敏。而使用针对受体胞外域的单克隆抗体阻断这种物理相互作用时会导致受体和INSR保留在质膜上,从而维持β细胞中INSR–IGF1R的活化。
研究团队也对其产生的作用进行了机制研究,发现受体使网格蛋白介导的内吞作用成为可能。从机理上讲,受体与INSR–IGF1R相互作用以促进网格蛋白介导的内吞作用,使受体脱敏。而使用针对受体胞外域的单克隆抗体阻断这种物理相互作用时会导致受体和INSR保留在质膜上,从而维持β细胞中INSR–IGF1R的活化。 受体与INSR和IGF1R物理相互作用,以增强受体内化和脱敏总之,这些研究结果表明,受体可以保护胰岛素生产性β细胞免受组成途径的激活,并将受体鉴定为INSR–IGF1R敏感化和糖尿病治疗的潜在分子靶标。
受体与INSR和IGF1R物理相互作用,以增强受体内化和脱敏总之,这些研究结果表明,受体可以保护胰岛素生产性β细胞免受组成途径的激活,并将受体鉴定为INSR–IGF1R敏感化和糖尿病治疗的潜在分子靶标。End
参考资料:
[1]Ansarullah, Jain, C., Far, F.F. et al. Inceptor counteracts insulin signalling in β-cells to control glycaemia. Nature (2021)
[2]https://doi.org/10.1038/s41586-021-03225-8
[3]https://www.nature.com/articles/s41586-021-03225-8
本文系生物探索原创,欢迎个人转发分享。其他任何媒体、网站如需转载,须在正文前注明来源生物探索。往期精选
围观
好消息!Nature发文:面对新冠病毒突变,人体的免疫系统也在不断应对进化!热文
遗憾!制药巨头默沙东成为首个宣布放弃COVID-19疫苗研发的跨国药企热文
苏州又一家独角兽赴港上市,这家公司做了两件大事:填补临床空白和建立三代生态圈热文
比Remdesivir强27.5倍,强效抑制变异毒株!这款抗癌药或为COVID-19治疗新希望热文
新发现!肠道菌群和血型竟被同一基因调控,肠炎或与你的血型有关免疫疗法 | 生物仿制药 | 疫苗 | 耐药性 | 药物靶点 | 健康生活 | 药企新闻 | 药物盘点 | 制药技术 | 药物副作用
基础研究/转化医学白血病 | 肺癌 | 胃癌 | 结直肠癌 | 肝癌 | 乳腺癌 | 胰腺癌 | 心血管疾病 | 神经退行性疾病 | 肠道微生物体外诊断 | 医疗器械 | 生物纳米 | 3D打印 | 基因检测 | 单细胞测序 | 基因编辑 | 辅助生殖 | 人工智能 | 精准医学政策抗癌药 | 4+7带量采购 | 耗材 | 备案制 | 注册人制度 | 健康中国 | 新版基药目录 | AI医疗器械 | 远程医疗 | 同股不同权市场/资本IPO | 融资 | 合作 | 基金 | 港交所 | 科创板 | 创业板 | 研发投入 | 收购 | 市场&消费