速递 | 预防1型糖尿病,创新CD3抗体获FDA优先审评资格
▎药明康德内容团队编辑
今日,Provention Bio公司宣布,该公司已经向美国FDA递交了其CD3单克隆抗体teplizumab的生物制品许可申请(BLA),用于延迟或预防高危个体的临床1型糖尿病(T1D)。FDA已经授予这一申请优先审评资格,预计在今年7月21日之前做出回复。新闻稿指出,如果获得批准,teplizumab有望成为首个改变1型糖尿病疾病进程的获批疗法。
作为一种慢性自身免疫性疾病,1型糖尿病患者的免疫系统会错误地攻击自身胰岛β细胞,导致β细胞功能逐步受损和死亡,最终患者需要依赖外源性胰岛素来进行治疗。对于1型糖尿病遗传易感人群,在出现明显高血糖症状前,疾病已经开始发展,主要表现为自身抗体(抗胰岛素和抗胰腺抗体等)的出现。在这期间,胰腺中的β细胞基本上仍完好无损,这为干预和保存β细胞提供了一个至关重要的窗口。目前,缺乏预防高危人群1型糖尿病发病的方法。
Teplizumab是一种靶向T细胞表面CD3抗原的单克隆抗体,它的Fc区经氨基酸修饰后,减少了与补体和Fc受体的结合,降低了其潜在毒性。Teplizumab能减弱对胰岛β细胞的自身免疫攻击,从而保护β细胞不受破坏,进而预防或推迟1型糖尿病的发生。它曾经获得FDA授予的突破性疗法认定。
目前已有超过800名患者在多项临床试验中接受teplizumab的治疗。去年在《新英格兰医学杂志》发表的一项2期临床试验结果显示,teplizumab能延迟1型糖尿病发病2年以上。接受一个疗程的teplizumab治疗的患者组被诊断为1型糖尿病的中位时间为48.4个月,而安慰剂组的这一数值为24.4个月。统计显示teplizumab将1型糖尿病发病风险降低了59%(HR=0.41;95% CI,0.22-0.78;P=0.006)。
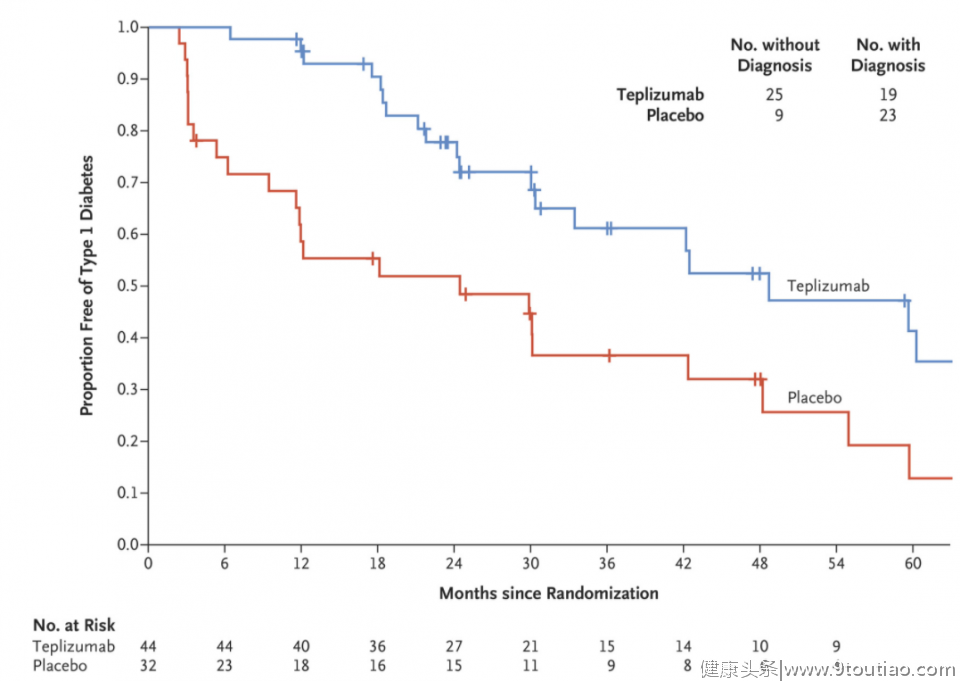
▲Teplizumab对1型糖尿病发病风险的影响(图片来源:参考资料[2])
在对新确诊1型糖尿病患者的研究中,teplizumab始终表现出保留β细胞功能的能力,并相应地减少患者对外源性胰岛素使用的需求。
“FDA接受我们的BLA,代表了Provention Bio开发改变1型糖尿病疾病进程疗法方面的重要里程碑,它可能改变有患病风险个体的治疗范式。”Provention Bio的首席执行官和联合创始人Ashleigh Palmer先生表示,“我们将与FDA密切合作,支持teplizumab审评,同时也为在2021年第三季度推出这一产品做准备。”
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] Provention Bio Announces U.S. FDA Filing of a Biologics License Application (BLA) and Priority Review for Teplizumab for the Delay or Prevention of Clinical Type 1 Diabetes in At-risk Individuals. Retrieved January 4, 2021, from https://www.prnewswire.com/news-releases/provention-bio-announces-us-fda-filing-of-a-biologics-license-application-bla-and-priority-review-for-teplizumab-for-the-delay-or-prevention-of-clinical-type-1-diabetes-in-at-risk-individuals-301199992.html
[2] Herold et al., (2019). An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. NEJM, DOI: 10.1056/NEJMoa1902226