【中西合璧】胶质细胞串扰和突触可塑性介导的中枢敏化在针刺镇痛中的作用

背景:
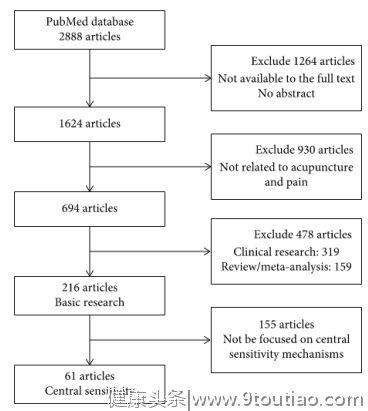
虽然疼痛被视为全球公共卫生重要事项,但镇痛治疗仍然是一个重大挑战。疼痛是由外周和中枢敏化引起的一种过敏状态,后者被认为是慢性疼痛的罪魁祸首。本研究从神经胶串和突触可塑性的角度总结了中枢敏化的发病机制,并强调了针灸的相关镇痛机制。中枢敏感性由在上升兴奋通路和下降性疼痛调节系统中涉及的神经递质和神经肽调节。针灸镇痛与上升兴奋通路中低调节谷氨酸和上调节阿片类药物、γ-氨基丁酸、去甲肾上腺素和下降疼痛调节系统中的5-羟基三聚胺有关。此外,人们越来越认识到,神经递质、细胞因子和化疗与神经胶质相声和相关可塑性有关,从而有助于中心敏感性。针灸通过抑制细胞因子产生镇痛作用, 如白细胞素-1-1-β、白细胞素-6、肿瘤坏死因子-α,以及调节胰腺素-10,以及调节化疗素及其受体,如CX3CL1/CX3CR1、CXCL12/CXCR4、CCL2/CCR2和CXCL1/CXCR2。这些因素通过针灸通过激活多个信号通路进行调节,包括米根激活蛋白激酶信号(例如,p38,细胞外信号调节激酶和c-Jun-N-终端激酶通路),有助于激活异常神经元。然而,化疗对针灸的反应因疼痛模型、针灸方法和刺激参数而异。因此,确切的机制需要今后作出澄清。综合起来,抑制由神经胶质调节的中枢敏感调节是针灸镇痛的核心,为针灸镇痛的临床应用提供了新颖的见解。 疼痛由感知性神经纤维调节,是一种生理报警响应,通过减少损伤造成的组织损伤来保护身体。百分之三十到五十的病理疼痛患者在伤口愈合后长期患有焦虑和抑郁。痛苦和不愉快的情绪都会影响他们的生活质量,并造成严重的社会和经济后果。然而,解决慢性疼痛仍然是全世界的一个重大挑战。口服药物往往是首选,近年来其使用量呈指数级增长 .不幸的是,镇痛药的广泛应用可能导致器官损伤和滥用,并造成严重的社会问题 .例如,长期过度使用阿片类药物(最常见的处方止痛药)会导致成瘾、耐受和嗜睡等副作用,以及记忆、注意力和判断力受损。阿片类药物滥用也可能导致呼吸抑郁症。因此,一种自然镇痛剂,也可以调节疼痛相关的情绪和认知障碍是必要的。 针灸疗法是一种起源于中国、已应用于世界183个国家和地区的著名疗法。长期的临床实践证明,针灸是缓解疼痛的有效治疗方法。世界卫生组织推荐针灸治疗30多种疼痛疾病,包括腰痛、头痛、坐骨神经痛和术后疼痛。参考国家准则信息交换所(http://www.guidelines.gov/),针灸有49项具体的医学建议,其中37项(75.51%)是疼痛相关的疾病。目前,许多临床随机对照试验(RRT)已显示出针灸的镇痛作用。如16周的RCT所示,与假针灸治疗和等待治疗组相比,针灸治疗可以显著降低偏头痛的发病率,而没有预监测偏头痛,这种影响至少持续24周。Vickers等人的荟萃分析分析了非特异性肌肉骨骼疼痛、骨关节炎、肩痛和慢性头痛的 RRT 患者的个人数据,结论是针灸对慢性疼痛的治疗有效,具有持久的治疗效果。这些研究表明,针灸镇痛是有效和安全的,可以改善疼痛患者的生活质量。 疼痛是由组织损伤或类似的病理生理原因引起的。疼痛敏感性在疼痛的发生和维护中起着关键作用。疼痛敏感从周围神经的敏感性开始,涉及脊髓和大脑的一系列神经可塑性变化,即中枢敏化。神经递质、神经营养因子、脂质和细胞因子/化疗在周围和中枢敏感神经元和胶质细胞之间的交流中起着重要的作用。有趣的是,越来越多的证据表明,针灸可以缓解由胶质细胞诱发的炎症引起的中央敏感性,以实现镇痛。因此,我国学者从神经胶质相声和神经可塑性集中敏感性的角度总结了针灸的镇痛机制,突出了中央神经免疫调节机制,为针灸的临床应用提供了新的证据,并发表于2021年1月的Neural Plasticity杂志,在此作简单翻译仅供参阅。 文献学习: 在这些文章中,由于没有摘要或缺乏全文,排除了1264篇文章,留下1624篇文章。手工搜索是通过筛选符合标准的文章的参考列表,基于标题和摘要。其中,在全文评估导致694篇文章之前,我们在标题和摘要中排除了930篇与针灸和疼痛无关的文章。其中包括216篇基础研究文章、319篇临床研究文章和159篇评论文章或元分析文章。获得并仔细阅读了216篇符合纳入标准的基础研究文章全文。其中,155篇文章被排除在216项基础研究之外,因为没有集中于中心敏感性机制,导致61篇文章。搜索过程的流程图如图所示1.
数据提取
在61项中央机制基础研究中,35项典型和最近发表的研究信息列在表中1由于一些研究的相似性,分析针灸镇痛的中央敏感性相关机制。研究设计数据使用预定义的数据提取形式提取和分类,该表指定疼痛模型类型、干预(方法、穴位、针灸参数)和结果度量(疼痛相关行为、机制指标)。数据主要由一位作者提取,其他作者检查。

神经免疫串扰在外周敏感中的作用
疼痛生成的基本过程发生时,位于肽和非受体原性受体的外围有选择性地对热、机械性异常和刺激性化学物质有反应。在这个过程中,在后根神经带相关神经元去极化并产生受体电位,将物理或化学信息转换为电气信息。电信息沿着感官途径传输到脊髓和其他主中心。来自初级中心的集成信息可以传输到大脑中更高的中心,以形成疼痛感,或传送到前角的运动神经元,以产生反射。 疼痛敏感性是中央和周围受体的重塑机制。持续刺激,如组织和神经损伤重塑受体产生疼痛敏感性,特别是外周敏感性,包括周围偏心受体和背根结节DRG 。神经免疫相互作用对于外周敏感至关重要。有两种类型的周围炎症:组织和神经原发性炎症。组织损伤可导致组胺、血管分裂、血流量增加和血管外化的局部释放,以及各种细胞因子/化疗因子和凝血因子的释放。免疫细胞(包括巨噬细胞、乳腺细胞、嗜中性粒细胞和淋巴细胞)释放炎症介质以加重疼痛,同时释放内源性阿片肽以抑制周围炎症性疼痛。近年来,细胞因子/化疗素被发现参与调节和敏感受体的兴奋性。炎症细胞因子(白细胞素-1β (IL-1 β),IL-6 和肿瘤坏死因子 -α(TNF-α)中调解异感(疼痛导致从通常不会引起疼痛的刺激),高血糖(增加对有毒刺激的反应),并增加物质P(SP)和前列腺素E2(PGE2)在神经元和胶质细胞在 DRG 的表达水平。在结构上,化疗素与细胞因子相似,其受体在 DRG 中表达。例如,单细胞化疗蛋白-1(CCL2)及其受体C-C化学受体2型(CCR2)均在神经损伤模型中增加。此外,CCL2可以促进免疫细胞和受体之间的相互作用,从而在炎症和神经病变疼痛中发挥关键作用。同时,细胞因子/化疗素对异常神经元的兴奋作用表现为调节离子通道的打开;具体来说,化疗受体的激活可以调节电压门状钙通道(VGCCs)中的电流。 神经性炎症是由从原发性吸附神经元释放的化学物质引起的,如SP和降钙素基因相关肽(CGRP)。在外周组织损伤时,持续偏向刺激或炎症使鼻觉感知器敏感。这些放电通过作用于脊髓中间神经元中的N-甲基-D-阿斯巴酸(NMDA)或非NMDA受体来激活γ-氨基丁酸(GABA)神经元,并作用于相邻的原发端子,导致去极化。放电也产生一个后根反射逆行,导致由神经原发性炎症调解的伤害受体的再感化,并最终诱导全身麻醉。此外,交感神经系统参与加强神经原发性炎症过程,神经免疫在外周敏感性中起着重要作用。
疼痛传播和调节通路中的中枢敏感性是针灸镇痛的关键目标
中枢敏感性,即继发性高敏性,包括上调兴奋途径和下降疼痛调节系统的失衡,在慢性疼痛的发展和维持中起着至关重要的作用。在上调的兴奋通路中,中枢神经系统(CNS)内神经信号的扩增在脊髓和大脑中产生神经元多动和超兴奋状态,导致超高痛感。这主要发生在脊髓的层 I 和层状 V 神经元中, 以及脑膜内皮形成、 丘脑、 下丘脑、 角脑、 杏仁核、 基巴神经节、 海马、皮层 S1 和 S2,前皮层 (ACC), 前额皮质, 以及皮叶和叶的一些相关皮质区域。下降的疼痛调节系统产生于一些超面位点,包括中脑腹膜灰色(PAG),通过左脑腹膜(RVM),横向和骨道背状核(DRN)和心室膜,其中PAG-RVM系统已研究最多。 如表所示1,神经病变疼痛模型,包括慢性收缩损伤、化疗诱发疼痛、脊髓神经结扎,脊髓损伤引起的疼痛,已广泛应用于中枢敏感性介导针灸镇痛的研究。由完全Freund的辅助剂的给药引起的炎症性疼痛也会导致中枢敏感性,包括外周和中枢敏感性的双重机制。许多这些研究都使用了电针灸(EA),而不是人工针灸,并且使用最多的穴位ST36和SP6。2-15 Hz 的低频和 2 Hz 和 100 Hz 之间的较高频率在 EA 镇痛中均有效,为在临床环境中最大限度地提高针灸镇痛效果提供了有用的信息。
针灸抑制上调的兴奋途径
如所述1, 嗅觉受体由A型 δ 和 C 型感官纤维组成,这些纤维将有害刺激从受损的外围组织转用于脊髓。脊髓背角的神经可塑性有助于和增强异常神经元的疼痛感知。中枢处理包括三个过程:激活、传导和调节。这些特征是兴奋性后突触电流(EPSC)增加,包括结束、长期电位(LTP)和抑制。其中,由高频率和低频电刺激、神经损伤或组织损伤引起的LTP是一个瞬态突触活动可以产生突触强度长期增加的过程。LTP 依靠 NMDA 受体 (NMDARs) 和电压依赖钙通道,导致钙流入,从而激活蛋白质激酶 A、蛋白质激酶 C 和钙/亚多杜林依赖蛋白激酶 II (CaMKII)。蛋白质合成是晚期LTP(L-LTP)所必需的,在脊柱后角和海马中管理脑源神经营养因子(BDNF)可以诱导C纤维电位L-LTP。抑制包括减少GABAergic和/或甘油抑制和增强A β C纤维敏感性。抑制性内性神经素的丧失、抑制性神经递质的储存和/或释放,以及受损的后突触受体活性,被提出为抑制基础的机制。最后,集成信号通过脊髓传递到丘脑,在那里处理疼痛的位置和强度。然后,信号被传递到经典的疼痛神经回路,大脑感觉皮层(S1,S2),它区分疼痛的位置和持续时间。除了S1和S2,ACC、孤岛皮层和杏仁核的神经元活动也有助于疼痛感知的各个方面,包括不适体验。 在分子机制方面,原发性异常神经元将谷氨酸、SP、CGRP、三磷酸腺苷(ATP)和神经因子-1(NK1)释放到脊髓中。这些分子与受体相互作用,包括 NMDER、α-氨基-3-羟基-5-甲基-4-异氧乙酸受体(AMPAR)、代谢性谷氨酸受体(mGluR)、SP受体(NK1R)、降钙素受体样受体(CRLR)和脊髓认知投影神经元的纯素受体(P2X、P2Y)。这就导致涌入脊髓的疼痛神经元 , 激活钙依赖细胞内级联, 诱导 NMDAR 磷酸化, 最终导致在整个脊柱疼痛通路生成感知信息。因此,这些由无意义神经元释放的中介引起神经兴奋和异常传播。 谷氨酸是中枢系统中最重要和分布最广的兴奋性神经递质,在上调的兴奋途径中起着至关重要的作用。谷氨酸受体大致分为两组,代谢性谷氨酸受体(mGluRs)和阳离子性非糖受体(iGluRs),它们又被细分为NMDAR、Kainate型iGluR和APAR。兴奋性谷氨酸传播在慢性疼痛发作中起着至关重要的作用,其特点是谷氨酸浓度增加和受体刺激,导致疼痛信息的传递 。Somers等人调查了皮后电神经刺激(TENS)对慢性收缩损伤(CCI)引起的神经病变疼痛的影响和潜在机制。机械的刺激感被低频和高频 TENS 的兴奋谷氨酸浓度降低而得到缓解。最近的证据表明,2 Hz EA双边刺激Zusanli(ST36)和Sanyinjiao(SP6)穴位通过N-甲基-D-阿斯巴酸受体类型2B(NR2B,NMDAR亚单位)的降低产生镇痛作用,抑制了CCI大鼠模型中疼痛信息的传递|42].AMPAR 由四个子单元 (GluR1-R4) 组成。EA 已被证明可防止 AMPAR 的磷酸化, 尤其是 GluR2 亚基, 在完全弗伦德的佐剂 (CFA) 模型中。此外,EA的抗知觉作用被提出与谷氨酸运输器(GT)表达的恢复有关,这种表达可以从突触裂口中去除多余的谷氨酸。脊髓谷氨酸-部分质运输器和GT1,主要分布在胶质细胞中,在CFA注射大鼠的EA治疗后,由于蛋白酶体下调节的结果增加。在用 EA | 治疗的神经病变疼痛模型中也观察到类似的反应。胶质突触传输与多余的 Ca 相结合2°进入投影神经元,并导致Ca的激活2°- 依赖酶 Ca2°/calmodulin依赖蛋白激酶II(CamKII)和NMDAR的NR2B亚基在ACC的后突触位点进行磷酸化,从而调节内脏超敏模型中的内脏疼痛 。据报道,ST36和昆仑(BL60)的EA可以逆转钙电压门通道亚单元和钙电压门通道辅助子单元γ的作用,从而减少CFA大鼠的慢性炎症性疼痛(CIP)。
针灸调节降痛疼痛调节系统
现在很清楚,下降的疼痛调节通路可以促进和抑制,在两个功能之间的动态平衡。当急性疼痛转向慢性疼痛时,下降促进功能占主导地位,导致疼痛敏感增强,甚至"镜面疼痛",其中胃膜RVM起着关键作用。从RVM下降投影,确定为开和 OFF 细胞,分别促进和抑制脊柱的异常传播。例如,RVM病变或功能沉默可以防止神经损伤引起的疼痛敏感。兴奋氨基酸、AMPAR、NMDAR 和 BDNF/TrkB 信号通路也参与下降促进过程。几个神经递质(例如,阿片类药物、GABA、去甲肾上腺素和5-羟基三聚胺(5-HT))参与这些下降途径。已经证明,针灸主要通过促进下降抑制系统来缓解疼痛而起作用,而对针对下降促进系统的调节知之甚少。有限的结果表明,EA通过抑制中枢下行促进系统中p38丝裂原激活的蛋白激酶(MAPK)的激活来减轻炎症性疼痛。此外,EA通过对GABA能而不是谷氨酸能神经元的大麻素受体增强了延髓对5-HT的抑制抑制作用,从而抑制了膝骨关节炎的疼痛。 针灸对阿片类药物及其受体的调节作用 阿片类药物及其受体有助于减少中脑下降途径中的兴奋性递质释放,尤其是在PAG-RVM系统中。Kissiwaa等。发现阿片受体,主要是μ阿片受体(MOR),可以抑制杏仁核突触中谷氨酸的释放。此外,PAG中MORs的镇痛能力受到与谷氨酸结合的NMDAR NR1亚基的负调控。到目前为止,内源性阿片类药物(例如脑啡肽,β-内啡肽和强啡肽)/阿片受体(例如μ和δ阿片受体)的激活是针刺镇痛的最佳理解机制。尽管阿片拮抗剂纳洛酮可以逆转不同频率的EA,但介导EA效果的阿片类药物的类型会根据EA频率而有所不同。例如,在ST36处单次以2 Hz EA进行20分钟可以通过在外侧ha(LHb)(富含MORs的上丘脑结构)中介导MOR来缓解乙醇戒断过程中的痛觉过敏。MORs的激活可以抑制LHb中谷氨酸的释放,这可以阻止从LHb到PAG的下行伤害性信号,从而减轻疼痛[50]。除MORs外,环iao(GB30)的10 Hz EA还可通过δ或κ阿片类受体显着缓解紫杉醇诱发的机械性异常性疼痛和痛觉过敏[。 针刺对类诺皮样神经递质的调节 (1)GABA能抑制性中间神经网络。GABA是一种重要的抑制性神经递质,可通过突触前抑制来减轻疼痛感。兴奋性谷氨酸能和抑制性GABA能传递之间的失衡,特别是在脊髓疼痛回路中对GABA能突触传递的抑制作用降低,被认为是中枢敏化发展的基础。还发现RVM GABA能神经元可以通过抑制背角脑啡肽能/ GABA能神经元来促进机械性疼痛。Ea 可能通过增加 PAG 中疼痛调节通路上的 GABA 表达来启动镇痛。此外,GABA受体,一种配体门的免疫受体,主要位于联合后神经元中,有助于快速突触抑制的启动,因此是产生水合的主要靶点。EA 在双边 L4 和 L6的华图佳吉点(EX-B2)或ST36和阳陵泉(GB34)点可以通过增加脊髓中的GABA受体来显著减少神经病变疼痛。此外,EA 可以通过降低 GABA 再摄取率来支持 GABAergic 系统。GABA 运输机-1 (GAT1),占主导地位的神经元 GABA 运输器,控制 GABA 浓度,EA 被发现通过激活PAG 中的 δ-阿片受体来降低 GAT1 活性。综合起来,针灸可以通过增加GABA表达,激活GABA受体,抑制GABA再摄取来调节GABAergic系统。 去甲肾上腺素。去甲肾上腺素从下降投影释放到背角,并有助于唤起抗听效应。在慢性疼痛大鼠模型中,脊髓去甲肾上腺素的耗竭导致机械过敏,以剂量依赖的方式 。研究表明,去甲肾上腺素参与针灸镇痛。Choi等人先前的一份报告表明,在双边ST36的EA刺激(2 mA,2 Hz,30分钟,每两天一次)可以显著减少太平洋基塔塞尔引起的神经病变疼痛。进一步的研究表明,EA的抗接受效应是通过小鼠的α 2-和β-脊髓受体的激活,通过脊柱下降的肾上腺素通路进行调节的。与这些结果一致,研究表明,在脚踝扭伤的老鼠模型中,EA诱导的镇痛主要是通过α-肾上腺素受体抑制手角神经元活动。此外,研究表明,10-Hz-EA的镇痛作用由脊柱α 2a-肾上腺素受体调节,相比之下,CFA引起的炎症疼痛模型中的α2b-肾上腺素受体。还发现,在细胞内注射脱西丙胺,一种选择性的诺拉德肾上腺素吸收抑制剂,增加了脊柱诺拉德肾上腺素的可用性,并延长了EA的抗受体作用。 5-HT(也称为血清素)主要来自RVM到脊髓,并在下降促进和抑制通路中施加双相调节。通过分别通过招募RVM ON或 OFF细胞,对脊柱处理的促进和抑制影响,并依赖于急性或慢性疼痛状态和作用对。低剂量的5-HT产生脊髓中快速EPCS的促进,而5-HT的高剂量可抑制AMPA/凯尼特受体的调节EPCS 。许多研究表明,5-HT和5-HT受体参与针灸镇痛效果 。EA 在 100 赫兹, 但不是 2, 50, 或 2/100 Hz, 是有效的缓解疼痛抑郁症 dyad 和调节 5 - HT 在雷塞平注射大鼠的 Drn 。在CFA炎性疼痛模型中,10 Hz EA 通过激活脊柱 5-羟基三聚胺 1A 受体 (5-HT1AR) 来抑制热超胃病,但不是 5-HT2BR、5-HT2CR 或 5-HT3R 。与这些结果一致, EA 激活脊柱 5-HT1AR, 以减轻 Cip 大鼠的过敏症和高血压。在骨关节炎模型中,EA的有效性和机制侧重于脊柱 5-HT2A/2C 受体的参与。综合起来,这些数据表明,脊柱5-HT及其受体参与针灸镇痛,但效果因动物模型和EA频率不同。
三方突触在针灸镇痛中的作用神经胶质串扰调节神经可塑性
弗拉基米尔·帕尔普拉于1994年首次提出"三方突触"的概念 。这个概念增加了胶质细胞(星细胞和微胶质)到原始的经典前和后突触神经元细胞,从而强调胶质细胞在突触传播和调节中的重要作用。值得注意的是,最近的研究表明,由中枢炎引起的中央敏感伴有胶质活化,包括脊髓和大脑中星形细胞、微胶质和寡头细胞的活化。刘和同事发现,L5脊髓神经结扎(SNL)导致脊柱微胶质细胞和神经元细胞中环氧酶-1(COX-1)和COX-2的调节;这些酶通过厌食酸通路参与前列腺素 (PGs) 的生产, 进而导致神经病变疼痛的发展 。功能成像还显示,在慢性中低背疼痛患者中,转位蛋白(胶质活化标记)的脑水平升高。 越来越明显的是,神经可塑性是由神经胶质相声调节的。在外周组织或神经损伤后,神经递质,如谷氨酸,SP和CGRP从后角的嗅觉原发性纤维释放,不仅导致神经后突入受体的强烈高频激活和后突触电流的放大,而且与微胶质和星形细胞上的相应受体相互作用,激活电压依赖性钙通道,诱导钙进入神经元。胶质衍生物质被指胶质递递器,包括细胞因子(IL-1、IL-6和TNF-α),化疗素(CCL2 和 CXCL1和炎症介质(例如,布莱基宁、PGs 和一氧化氮)。这些化学物质促进炎症环境并充当化学中介,以准理的方式放大神经胶质反应,有利于这些调停器在脊髓的后角的升高。例如,TNF-α在TNF-α受体1(TNFR1)的作用,通过促进兴奋性突触信号在急性阶段后,在CCI小鼠神经损伤后与假对照小鼠 。TNF-α通过以下机制促进神经可塑性,包括降低GTs的调节,提高突触中谷氨酸浓度的调节,以及NMDAR的磷酸化。TNF-α促进兴奋性突触传播的促进,并抑制GABA受体的表达,从而减少兴奋性传播的抑制力。化学素还可以调节神经元和胶质细胞的相互作用,例如,从星形细胞中提取的CCL2可以通过c-Jun-N-终端激酶(JNK)MAPK调节神经元活动来"与"神经元"交谈。这些由活性胶质细胞产生的中介有助于神经可塑性。在这个过程中,活性胶质可以释放前列腺素、BDNF、一氧化氮等神经活性物质;减少GABA的抑制作用;并调节 NMDARS 的表达,从而提高神经兴奋性,保持神经病变疼痛。此外,大脑中胶质细胞数的修改可能与疼痛的情绪体验以及抑郁和焦虑等情绪障碍相关。一旦激活,脊髓中的胶质细胞释放细胞因子,提供正反馈,进一步增强兴奋性突触传输。
针灸抑制胶质活动
研究表明,在SNL诱导的神经病变疼痛模型中,脊髓微胶质和星形细胞的抑制分别调解了直接和长期的EA镇痛。另据报道,EA的镇痛功效可能与微胶质和星细胞活化的调制有关。据报道,针灸抑制信号转导通路和关键分子,包括p38 MAPK、细胞外调节激酶(ERK)和JNK,在疼痛处理中微胶质和星细胞活化。先前的结果观察到,针灸镇痛作用与脊柱细胞因子和胶质细胞释放的神经营养因子有关。在双边ST36和GB34点重复进行EA治疗,每天一次,可以缓解慢性疼痛,抑制CCCI大鼠脊髓TNF α和IL-1β的升高mRNA表达。EA(2/100 Hz,2 mA)连续五天可以显著增加CFA注射后机械阈值和热延迟。这可能部分与抑制前炎细胞因子(例如TNF-α和IL-1β)和刺激IL-10在脊髓中有关。IL-10,由脊髓产生,是缓解两种炎症性疼痛的关键抗炎细胞因子和神经病变疼痛。Paclitaxel显著激活微胶质和星形细胞,并增加腰椎脊髓中炎症细胞因子(IL-1 β和TNF-α)的表达。在大鼠的双边ST36点进行EA治疗(10赫兹,1 mA),通过TLR4/NF-α B通路下调节,抑制活性微胶质和星形细胞,抑制炎症细胞因子的表达。除了 Tlr4, 据报道, 在脊髓和丘脑中 Tlr2 的表达增加也被 Ea 在 Cfa 模型中抑制了 。因此,针灸对胶质递质的降低可以阻止神经胶质相声的激活,从而有助于缓解慢性疼痛。然而,关于针灸如何调节胶质细胞以抑制兴奋性突触传递的证据仍然不完整。
趋化因子及其受体在针灸镇痛中的作用趋化因子系统简介
趋化因子,8-12 kDa分泌蛋白质,构成最大的细胞因子家族。根据半胱氨酸的数量和间距,化疗由两个主要家族组成,CC(CC)1-28) 和 CXC (CXC1-16)化学,以及两个次要的家庭,XC (XC1-2) 和 Cx3c (CX3CL1) 化疗 |123].所有的化疗素都与七个跨膜异质G蛋白耦合受体(GPCRs)家族的成员结合。化学素被认为是炎症的重要中介,有助于控制免疫细胞的定位和迁移模式。免疫细胞在原发性(T细胞,B细胞),二级(淋巴结,脾脏,Peyer的斑块)和三级淋巴器官的精细控制下,这个复杂的系统约50内源化疗。胸腺中T细胞的发育取决于上皮衍生的CCL21、CCL25和CXCL12与CCR7、CCR9和CXCR4的相互作用,分别表达在T细胞祖细胞上。与胸腺相比,骨髓中免疫细胞的平衡和发育似乎受CXCL12/CXCR4和CCL2/CCR2之间相互作用的对立力量控制。趋化因子基因被认为是周围免疫细胞迁移的调节剂,能够诱导T、NK细胞、树突状细胞和/或巨噬细胞的迁移。人们越来越认识到化疗素系统能协调免疫细胞迁移(例如巨噬细胞 和淋巴细胞进入 DRG 和 CNS。这在疼痛感知的早期启动中对中央敏感起着至关重要的作用。此外,由CNS中的神经元和胶质细胞表达的化疗素及其受体已被证明可以调解神经胶质通信和在不同解剖位置的异常信号传输,包括神经、DRG、脊髓和大脑。
针灸镇痛通过调节趋化因子及其受体
随着针灸缓解疼痛的日益增多,近年来从化疗的角度对针灸镇痛的机理也十分关注。 (1) CX3CL1/CX3CR1.CX3CL1 在神经元中特别表达,并结合到微胶质细胞膜上的 CX3CR1 受体、激活 MAPK 路径。MAPK在神经元和胶质细胞之间的信息传递以及CX3CL1/CX3CR1引起的疼痛超敏性的起源中起重要作用。Gao等人报告说,对原发性异常神经元的外周损伤导致CX3CL1释放到脊髓中,从而在微胶质的p38 MAPK依赖机制中激活了TNFα的产生。反过来,TNF-α以JNK MAPK依赖的方式调节星细胞中的CCL2表达。CCL2随后通过CCR2激活中央神经元,最终导致神经病变疼痛。CX3CL1 或 CX3CR1 的中和抗体可以减轻神经病变疼痛模型中的机械高腹痛。已经证明,神经元-微胶质相互作用由纯能受体进行调节,随后由CX3CL1/CX3CR1进行调节。净化P2X7R/CX3CL1/CX3CR1通路,微胶质p38 MAPK细胞内磷酸化随后刺激 IL-6 和 IL-1 的释放β,在感知信号传输中发挥关键作用。 在大鼠颈部切口疼痛模型中,高等人发现,在扶突穴(LI18)、合谷穴(LI4)、内关(PC6)或ST36、GB34的两次EA可以显著缓解热痛,随后ATP/P2X7R/CX3CL1/CX3CR1信号的降低,以及三次后上颈椎的下游p38 MAPK通路抑制。因此,EA 抑制了 ATP/P2X7R/CX3CL1/CX3CR1/p38 MAPK 诱导的神经胶质相声在疼痛处理。结果与李氏报告一致,即ST36的2Hz EA 30分钟减少了CX3CL1在CFA模型大鼠脊髓中CX3CL1的超量表达。EA抑制神经元和微胶质细胞的激活,减少p38 MAPK信号和下游前炎细胞因子IL-1、IL-6和TNF-α。他们还发现,EA没有抑制p38 MAPK的表达,但抑制了其磷酸化。与结果略有不同,Li等人的报告证明针灸结合麻醉(ACA)显著抑制了针灸合并麻醉,使针灸结合麻醉明显抑制了机械性腹痛和热痛引起的高腹痛。然而,ACA的镇痛作用在CX3CR1敲除小鼠中并不明显,当CX3CR1的中和抗体在C57BL/6J小鼠的ACA之前1小时在甲型HCA中注射时也受阻,这表明微胶质中的CX3CR1不仅涉及术后疼痛,而且也涉及ACA诱导的镇痛。 (2) CXCL12/CXCR4.CXCL12 和 CXCR4 分别用中枢神经系统的神经元和胶质细胞表达,CXCL12/CXCR4激活导致脊髓疼痛敏感性增加。Luo等人的一项研究表明,CXCL12和CXCR4在慢性术后疼痛(CPIP)小鼠的脊髓背角中受到调节。CXCR4 的校内阻塞改善了机械性,表明脊柱 CXCL12/CXCR4 信号在改善疼痛反应方面的重要作用。Hu等人发现,EA通过抑制脊髓后角CXCL12/CXCR4的过度表达,对CPIP的同一大鼠模型产生了镇痛作用。此外,他们发现EA可以有效地抑制脊髓中胶质细胞的过度激活,显著减少下游ERK通路激活,从而减少中枢敏感性,发挥镇痛作用。 (3) CCL2/CCR2.CCL2以脊柱星形细胞表示,通过CCR2诱导神经元激活,增加兴奋性突触性传播(星形细胞到神经元信号),有助于中央敏感性和神经病变疼痛发展。研究表明,CCL2/CCR2在SNL。CCL2 还可以迅速增加 NMDA 诱导的电流和自发 EPSC或抑制 GABA 引起的电流在背角神经元中,所有这些都严重地参与疼痛的维持。Lee等人在水沟(GV26)和GB34示范针灸,在L4-L5脊髓损伤后显著缓解了机械性过敏症和热过敏症。值得注意的是,针灸抑制了CCL2的星细胞表达,众所周知,通过JNK通路进行调解,有助于兴奋性突触性传播。除了CCL2的发现外,Lee还表明,通过针灸治疗,JNK依赖的CCL4和CCL20表达显著减少。 (4) CXCL1/CXCR2.CXCL1 和 CXCR2 分别用脊柱细胞和神经元表示,腰椎中 CXCL1/CXCR2 已被证明在疼痛处理中起到关键角色。CXCL1在脊髓中的应用作用于CXCR2,诱导在脊髓神经元中产生磷酸化ERK和CAMP反应元素结合蛋白、c-fos和COX-2的表达,导致神经病变疼痛的后续维持。同样,曹和同事显示,星形细胞在炎症后被激活,并在脊髓中释放CXCL1,然后可以在CXCR2上作用,诱导ERK激活,突触传输和COX-2表达在背角神经元,最终促成了CFA引起的炎症疼痛的发病机制。此外,徐等人发现,星形细胞分泌的CXCL1激活脊髓背角神经元,以表达CXCR2在癌症疼痛模型中。综合起来,CXCL1/CXCR2参与神经病变、炎症和癌症疼痛的发展。 然而,也证明CXCL1/CXCR2参与止痛。此前,Cao等人的研究表明,野生型小鼠的重组CXCL1的电内给用显著降低了脊髓神经L5转导(L5Tx-)诱导的机械过敏。由于CXCL1的化疗,它能够与通过渗透腰椎中嗜中性粒细胞而产生的阿片类肽数量增加联系起来。同样,郭和他的同事也表明,骨髓生成细胞诱导的单核细胞分泌CXCL1,可以跨越血脑屏障,有助于止痛。CXCL1/CXCR2 信号通过激活 RVM中μ-阿片受体来触发阿片类药物释放。此外,我们在CFA大鼠模型中观察到针灸衍生的CXCL1的一种新功能。在我们未公布的数据中,发现ST36的针灸可以诱导CFA大鼠血清中的CXCL1水平高。CXCL1中和抗体将针灸镇痛效果降低20%。我们的结果表明,针灸衍生的CXCL1可以诱导脊髓CXCR2脱敏,阻断COX2在脊髓中的产生。这些现象表明,参与疼痛敏感性的化疗素也可能在一定条件下促进神经保护和促进止痛。
结论
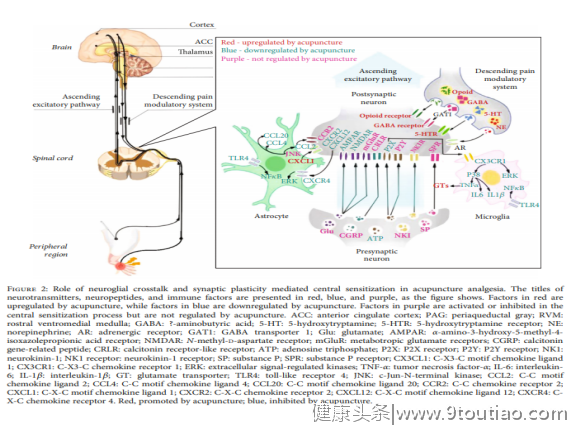
最后(如图2所示),众所周知,疼痛是由外围和中央敏感引起的超敏状态。中央敏感性由上升的兴奋途径和下降的疼痛调节系统调节。随着"三方突触"概念的出现,神经胶质细胞被认为是突触神经元的活性伙伴,有助于集中衰老。人们越来越认识到神经递质(如谷氨酸、阿片类药物、GABA、去甲肾上腺素和5-HT)、炎症细胞因子和化疗素与这种相声有关。针灸镇痛涉及上升兴奋途径和下降疼痛调节系统,通过谷氨酸的降序和阿片类药物,GABA,去甲肾上腺素,和5-HT的调节。证据表明,疼痛的发生和维持与免疫反应密切相关,细胞因子/化疗在神经胶质传播中的作用近年来已引起广泛关注。针灸镇痛也已被证明抑制细胞因子,如IL-1β,IL-6和TNF-α和上调节IL-10,以及调节化疗素及其受体,如CX3CL1/CX3CR1,CXCL12/CXCR4,CCL2/CCR2,和CXCL1/CXCR2。此外,针灸被发现调节下游神经 MAPK 信号(例如,p38,ERK 和 JNK 通路),有助于激活感知神经元。然而,化疗素对针灸的反应在疼痛模型类型、针灸方法和参数之间有所不同,需要将来澄清确切的机制。综合起来,抑制神经胶合性集中增效是针灸镇痛的关键机制之一,有助于针灸的更广泛地应用,单独或与止痛药相结合,在提高治疗效果和降低止痛药剂量和降低衰弱的不良反应的风险。这些研究中描述的针灸参数,特别是EA刺激的参数,也为在临床环境中提高针灸效果提供了重要的信息。
02
中西合璧述评
关于针刺镇痛原理的研究很多,其机制也被不断的探索并被发现。早期的研究认为穴位刺激可以促进乙酰胆碱的释放,阻碍痛觉信号的传导,从而起到镇痛作用;后续研究中发现针刺可以干扰痛觉信号的传导,从而达到镇痛的目的;对中枢神经因子的研究中发现,针刺可以促进五羟色胺,CCK-8,阿片肽等镇痛物质的分泌,从而起到镇痛的作用。 在近期的研究中也发现了针刺可以调节中枢敏化达到调节疼痛的目的。本研究则把众多的研究进行综合分析,将机制进行了系统整理,以便为进一步的深入研究梳理思路,明确研究方向。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])