乳腺癌剂量密集方案 or 标准方案,如何选择?
30 年前,Norton 教授通过对人类乳腺癌细胞 Gompertzian 模型的研究发现,肿瘤生长的初始阶段癌细胞增殖较快,但肿瘤增长到一定体积时癌细胞增殖就会减慢;药物杀伤癌细胞的速度与癌细胞增殖速度呈正比;肿瘤体积缩小的速度与癌细胞再增殖的速度成正比。
如果肿瘤体积缩小较快但仍存在癌细胞残留,那么癌细胞再生长至原来体积的速度更快;缩短给药间隔能够有效控制癌细胞的再生长,剂量密集型给药方案能够杀伤更多癌细胞。这些基础研究的实验结果为乳腺癌剂量密集化疗方案的相关临床试验提供了转化研究思路。
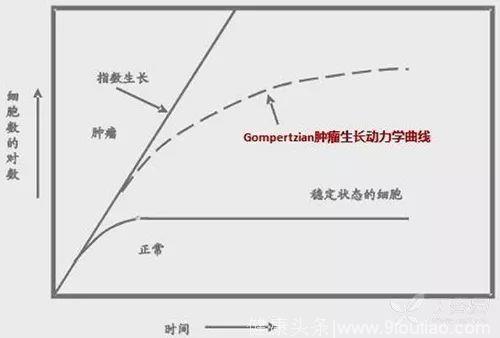
20 年前,Norton 教授提出了 3 种提高化疗剂量强度的方法:
1. 提高每周期药物剂量
2. 缩短治疗周期间隔时间
3. 序贯用药
临床医生一直在探索以上方法的不同疗效,相关研究的结果改变了乳腺癌临床实践指南,同时也影响着目前临床治疗方案的选择。
1
NCCN 指南推荐
CALGB9741 临床试验的结果证实,含蒽环紫杉类的每 2 周一次剂量密集化疗方案较每 3 周一次的标准化疗方案能够显著改善患者的无病生存(82% 对比 75%)。依据以上循证医学证据,自 2005 年至今,NCCN 乳腺癌临床实践指南一直将含蒽环紫杉类的剂量密集化疗方案作为乳腺癌新辅助/辅助化疗方案的优选推荐之一。
《NCCN 乳腺癌临床实践指南》的具体推荐为:AC 序贯 P 剂量密集方案,多柔比星 60 mg/m2+环磷酰胺 600 mg/m2 iv,d1,q14d,共 4 周期;紫杉醇 175 mg/m2 iv 3 h,d1,q14d,共 4 周期。注:所有周期均需应用粒细胞集落刺激因子支持。
2017 年 12 月的圣安东尼奥乳腺癌大会上,公布了 EBCTCG 关于剂量密集方案荟萃分析的最新数据,其中涉及含蒽环紫杉类化疗的相同剂量密集(2 周)对比标准(3 周)方案的七项临床试验的 10004 例患者。结果显示剂量密集(2 周)方案能够降低患者的任意复发率(24% 对比 28.3%),10 年获益率为 4.3%;并降低患者乳腺癌死亡率(16.8 对比 19.6%),10 年获益率为 2.8%,如下图所示。因此,强烈支持含蒽环紫杉类剂量密集(2 周)方案的临床获益。
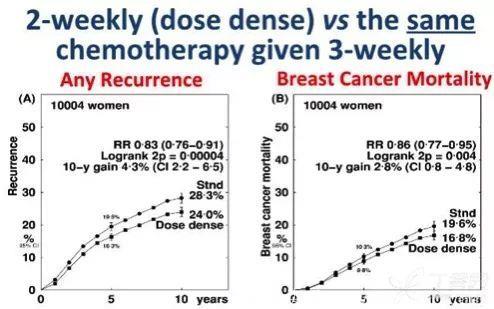
既然含蒽环紫杉类剂量密集方案具有显著的生存获益,那么考虑到中国的国情,是否也要优选推荐患者选择含蒽环紫杉类的剂量密集(2 周)方案呢?
2
中国指南推荐
实际上,中国版乳腺癌诊疗指南并没有将剂量密集 AC-P 方案作为优选方案进行推荐。
《中国抗癌协会乳腺癌诊疗指南与规范》(2017 版)中辅助化疗方案包括剂量密集 AC-P 方案,但也只是将含紫杉和蒽环类的剂量密集方案作为三阴性乳腺癌的优选化疗方案。
同样,《中国临床肿瘤学会乳腺癌诊疗指南》(2017 版)也指出,基于 CALGB9741 临床试验的结果,剂量密集 AC-P 方案可用于部分可耐受的三阴性乳腺癌患者。
此处「可用于部分可耐受」的严谨描述能够反映出,大部分中国患者使用该方案时将会出现较严重的不良反应。即使是将剂量密集方案作为优选推荐的 NCCN 指南,也强调要同时应用粒细胞集落刺激因子的支持治疗,这也足以反映出剂量密集方案不良反应的严重性和常见性。
3
不良反应
目前,我们难以设计相关的临床试验再去探索剂量密集化疗方案的不良反应,通过回顾既往关于剂量密集化疗方案的研究结果发现,含蒽环紫杉类剂量密集化疗方案出现 3 度及 3 度以上骨髓抑制的比例较高,出现非血液学毒性的发生率更高,最常见的为乏力、骨骼肌疼痛和感染。只有通过较强的辅助支持治疗,包括升白、保肝、止吐和抗过敏等,才有可能帮助患者顺利完成剂量密集化疗方案。
在临床实践中,选择使用含蒽环紫杉类剂量密集化疗方案的患者,通常在第 1 周期剂量密集 AC 方案化疗结束后的 3~4 天,会出现严重的中性粒细胞减少等骨髓抑制。通过及时应用粒细胞集落刺激因子的支持治疗,有小部分患者能够在下周期治疗前恢复至正常水平而不延误下周期化疗,但大部分患者会因此延期化疗。虽然,其中的一小部分患者能够顺利进行下一周期化疗,但是化疗结束又会出现严重的骨髓抑制反应。
目前,长效粒细胞集落刺激因子的应用对这一问题有很好的改善,第 1 周期化疗结束后 24 小时后应用长效粒细胞集落刺激因子就能够保证不影响第 2 周期化疗。然而,长效升白辅助用药虽然疗效非常好,但由于目前医疗资源分布不均(部分县市无供药)和医保政策限制(限制预防性使用),对剂量密集化疗患者常规应用长效粒细胞集落刺激因子的推荐也是不现实的。
同样,在预防剂量密集化疗方案所致血小板减少、肝功能损伤和严重胃肠道反应等方面,辅助用药支持治疗时也会遇到相似的障碍。
总之,作为临床医生要有选择的向患者推荐剂量密集化疗方案,对三阴性或高危的一般情况较好的患者可以首选推荐,但仍要密切监测化疗不良反应并通过支持治疗改善患者的症状。
如果患者在治疗期间出现非常严重的骨髓抑制和胃肠道反应,也可以转为标准三周化疗方案。
同时,期待更多临床试验能够探索出毒性低、耐受好、疗效佳的剂量密集化疗方案造福每位乳腺癌患者。
本文作者:山东省肿瘤医院乳腺病中心 丛斌斌 曹晓珊
编辑:汪小鱼 | 题图来源:Shutterstock
作者简介:
丛斌斌,博士,肿瘤学专业,导师于金明院士和王永胜教授,研究方向为乳腺癌外科和放射治疗,以第一作者发表 SCI 6 篇(累计影响因子 30.719),中文论文 6 篇,主持校级基金 1 项,参与国家级基金两项、省级基金 3 项。
曹晓珊,硕士,肿瘤学专业,导师王永胜教授,研究方向为乳腺癌综合治疗,以第一作者发表 SCI 4 篇(累计影响因子 13.516),中文论文 4 篇,主持省级基金 1 项。
参考文献:
1. Norton L. A Gompertzian model of human breast cancer growth. Cancer Res. 1988;48(24 Pt 1):7067-71.
2. Norton L. Evolving concepts in the systemic drug therapy of breast cancer. Semin Oncol. 1997;24(4 Suppl 10):S10-3-S10-10.
3. Foukakis T, et al. Effect of Tailored Dose-Dense Chemotherapy vs Standard 3-Weekly Adjuvant Chemotherapy on Recurrence-Free Survival Among Women With High-Risk Early Breast Cancer: A Randomized Clinical Trial. JAMA. 2016;316(18):1888-96.
4. Citron ML, et al. Randomized trial of dose-dense versus conventionally scheduled and sequential versus concurrent combination chemotherapy as postoperative adjuvant treatment of node-positive primary breast cancer: first report of Intergroup Trial C9741/Cancer and Leukemia Group B Trial 9741. J Clin Oncol. 2003;21(8):1431-9.
5. Moebus V, et al. Intense dose-dense sequential chemotherapy with epirubicin, paclitaxel, and cyclophosphamide compared with conventionally scheduled chemotherapy in high-risk primary breast cancer: mature results of an AGO phase III study. J Clin Oncol. 2010;28(17):2874-80.
6. Morris PG, et al. Dose-dense chemotherapy for breast cancer: what does the future hold? Future Oncol. 2010;6(6):951-65.
7. Petrelli F, et al. Adjuvant dose-dense chemotherapy in breast cancer: a systematic review and meta-analysis of randomized trials. Breast Cancer Res Treat. 2015;151(2):251-9.
8. Schmidt M. Dose-Dense Chemotherapy in Metastatic Breast Cancer: Shortening the Time Interval for a Better Therapeutic Index. Breast Care (Basel). 2016;11(1):22-6.
9. Bonilla L, et al. Dose-dense chemotherapy in nonmetastatic breast cancer: a systematic review and meta-analysis of randomized controlled trials. J Natl Cancer Inst. 2010;102(24):1845-54.
10. Reinisch M, et al. Neoadjuvant Dose-Dense and Dose-Intensified Chemotherapy in Breast Cancer - Review of the Literature. Breast Care (Basel). 2016;11(1):13-20.
11. Petrelli F, et al. Neoadjuvant dose-dense chemotherapy for locally advanced breast cancer: a meta-analysis of published studies. Anticancer Drugs. 2016;27(7):702-8.
12. 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范 (2017 年版). 中国癌症杂志. 2017; 27(9):695-760.