检测探寻转移性乳腺癌的潜在治疗靶点
整理:肿瘤资讯编辑部
来源:肿瘤资讯
目前乳腺癌的治疗主要是基于病理指导下的分子分型来进行。三阴性乳腺癌(TNBC)和转移性乳腺癌是目前乳腺癌治疗中的难点,尤其是TNBC,缺乏有效的治疗靶点,亟需基因组学的研究,探寻潜在的新兴治疗靶点。相比于全基因组测序,靶向测序Panel聚焦于肿瘤相关的基因,可以更高效地探寻患者潜在的可治疗靶点,更适合临床常规应用。张剑教授现汇总并点评了2018 ASCO年会上采用Foundation Medicine(以下简称FMI)开发的CGP检测探寻转移性乳腺癌在治疗靶点的研究进展。

张剑副主任医师、硕导
复旦大学附属肿瘤医院肿瘤内科行政副主任
上海市肿瘤化疗质控中心秘书
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国研究型医院协会乳腺专业委员会青委会副主任委员
中国研究型医院协会乳腺专业委员会常务委员
CSCO肿瘤支持与康复治疗专家委员会常务委员
CSCO青年专家委员会 委员
上海市抗癌协会癌症康复与姑息治疗专业委员会常务委员
上海市抗癌协会青年理事
国家食品药品监督管理总局CDE首批化药临床兼职审评员
JCO中文版(泌尿男生殖系统肿瘤专刊)编委
《中华乳腺病杂志》中青年编委
《Precision Cancer Medicine》青年编委
《中国癌症杂志》青年编委
Abs 1008 随机双盲II期LOTUS研究:接受一线ipatasertib(IPAT)联合紫杉醇治疗的局部晚期或转移性TNBC患者的OS数据更新
背景
对于TNBC患者,目前临床可靶向的通路包括:PIK/AKT/mTOR通路,DNA修复损伤通路,RAS/MAPK通路,细胞周期相关基因和生长因子受体(GFRs),见下图1。其中PI3K/AKT通路是乳腺癌最常见的活化通路之一,参与癌细胞的存活和生长。多种形式的基因变异可以导致AKT的活化:1. 负性调节因子的失活,如PTEN、INPP4B、PHLPP和PP2A;2. 正性调节因子的过度活化:如PI3K、AKT、受体酪氨酸激酶(HER2);3. 化疗或内分泌治疗等诱导的生存反应,见下图2。多西他赛诱导后可以增加MT-3细胞(PI3K H1047R)AKT的磷酸化,而联合使用IPAT+多西他赛则可以增加Cal-51细胞(PTEN缺失、PI3K突变的TNBC)死亡,见下图3。TNBC是一类异质性很大的肿瘤,其中PI3K/AKT是最常见的活化通路,不限于表达雄激素受体的TNBC亚型。
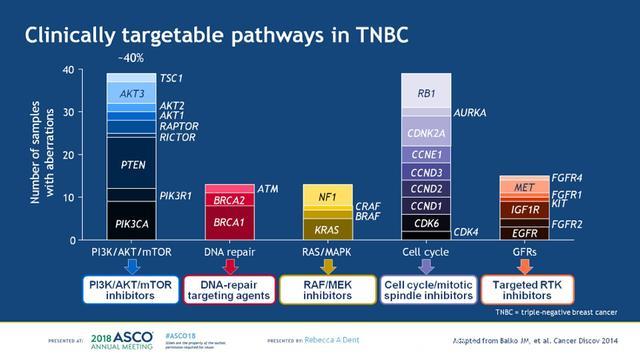
图1. TNBC可靶向的通路
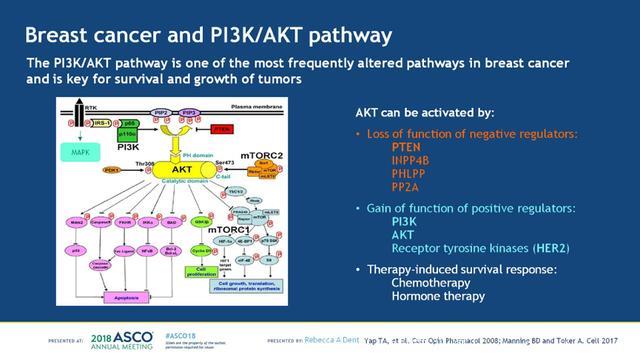
图2. 乳腺癌中的PI3K/AKT通路活化
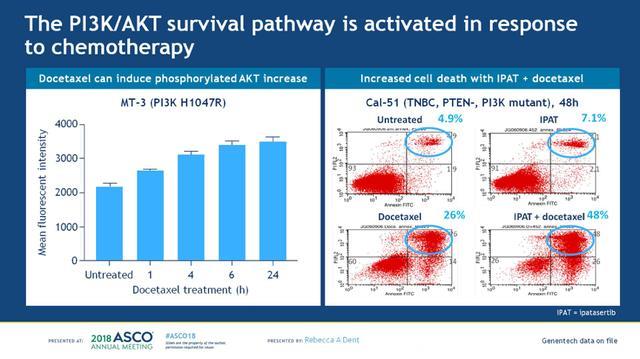
图3. 化疗后可以诱导PI3K/AKT通路活化
方法
IPAT是选择性的AKT抑制剂,随机II期LOTUS研究入组了124例局部晚期或转移性TNBC,患者不适合接受根治性手术切除,既往未接受过系统性治疗,无化疗间期>=6个月,ECOG PS评分0-1分,有足够的肿瘤组织可进行PTEN检测(中心实验室IHC检测)。患者1:1随机分配接受紫杉醇+IPAT或紫杉醇+安慰剂治疗。分层因素包括:既往是否接受过辅助或新辅助化疗、无化疗间期、PTEN状态。联合主要研究终点为意向性人群(ITT人群)和PETN低表达患者的PFS,次要研究终点为ORR、DoR、OS 、ITT人群、 PETN低表达人群和PI3K/AKT活化的人群(采用FoundationOne®检测),安全性。
结果
紫杉醇+IPAT或紫杉醇+安慰剂治疗组各62例患者,两组的基线特征均衡,结果显示,在ITT人群中,IPAT联合紫杉醇可以显著改善患者的PFS (分层HR 0.60;95%CI:0.37-0.98);进一步分析PIK3CA/AKT1/PTEN变异的患者 (n=42),IPAT联合紫杉醇治疗的PFS获益更显著(未分层HR 0.44;95%CI:0.20-0.99),见下图4。分别在ITT人群、PETN低表达患者和PIK3CA/AKT1/PTEN变异患者中,分析其他疗效终点指标ORR,DoR和CBR,两组的疗效对比总结见下图5。在PIK3CA/AKT1/PTEN变异患者中,紫杉醇+安慰剂组和紫杉醇+IPAT组的mDoR分别为6.1和11.2个月。
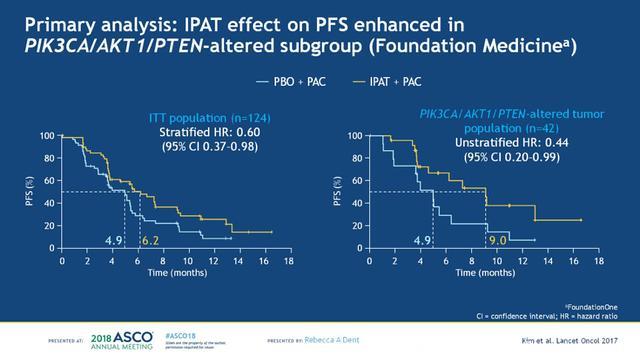
图4. 分别对比ITT人群和PIK3CA/AKT1/PTEN变异患者中,两组的PFS
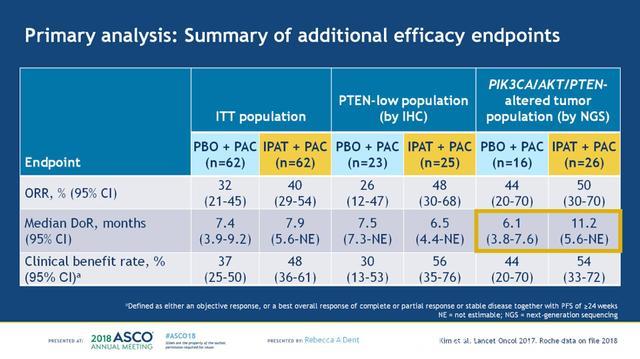
图5. 分别对比ITT人群、PTEN低表达患者和PIK3CA/AKT1/PTEN变异患者中,两组的ORR,DoR和CBR
OS数据分析的截止日期为2017-7-26,紫杉醇+安慰剂组和紫杉醇+IPAT组的中位随访时间分别为16.1和18.1个月,两组达到死亡终点事件的患者分别有35例(56%)和33例(53%)。两个治疗组在进展后接受的后续系统性抗肿瘤治疗方案相似,分别有89%和76%的患者接受了系统性抗肿瘤治疗,抗肿瘤治疗方案见下图6。在ITT人群中,两组的mOS分别为18.4 vs 23.1个月,分层HR 0.62 (95%CI:0.37-1.05),一年OS率分别为70%和83%,见下图7。根据PTEN表达状态进行分析,在PTEN表达正常和PTEN低表达的患者中,两组的OS均观察到了获益趋势,见下图8。进一步根据PIK3CA/AKT1/PTEN变异状态进行分析,在未变异和变异的患者中,两组的OS亦观察到获益趋势,两组样本量都很小,见下图9。
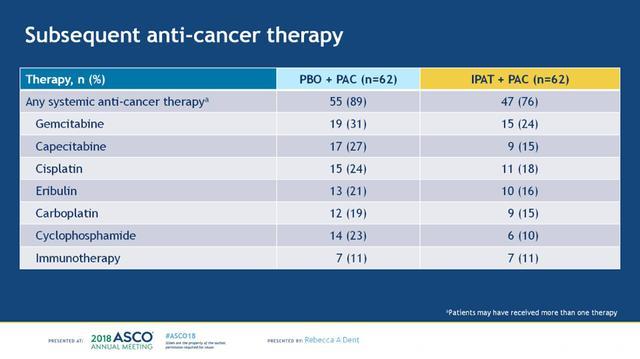
图6. 两个治疗组患者后续系统性抗肿瘤治疗方案的对比
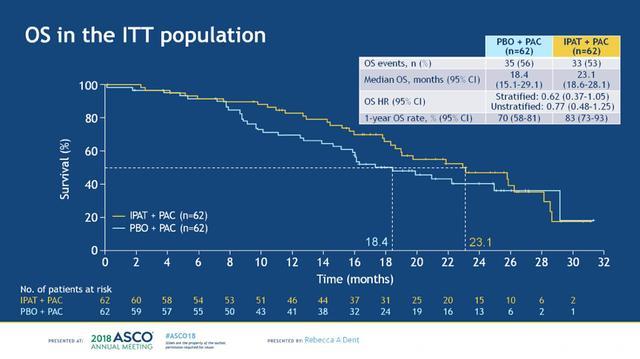
图7. ITT人群中两组的OS对比
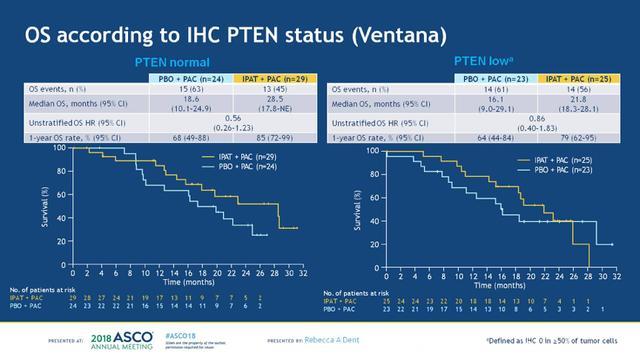
图8. PTEN表达正常和低表达患者,两组的OS对比
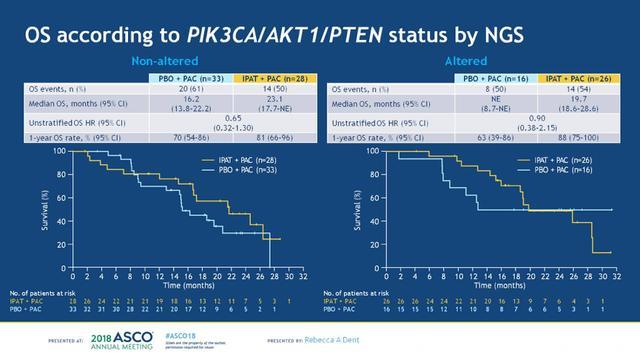
图9. PIK3CA/AKT1/PTEN未变异和变异患者中,两组的OS对比
小结
在安慰剂对照的LOTUS研究中,既往观察到紫杉醇联合IPAT治疗可以显著改善PFS,最新随访数据观察到OS获益的趋势(ITT人群中,两个治疗组患者的mOS相差5个月),预计在2019年可以公布最终的OS结果。基于这一研究结果,支持后续在更大样本量的转移性TNBC患者中评估一线IPAT+紫杉醇治疗。
专家点评
张剑教授认为:乳腺癌目前也逐步进入精准医疗的时代,虽然在三阴性乳腺癌中的进步还不尽如人意。本次LOTUS的更新数据,进一步证实了紫杉醇联合AKT抑制剂IPAT能显著改善PFS,特别是PIK3CA/AKT1/PTEN通路具有缺陷(FoundationOne®测定)的亚组。其实,国内三阴性乳腺癌的PIK3CA/AKT通路异常的情况在复旦大学附属肿瘤医院的相关研究中有了部分体现,25例三阴性乳腺癌,通路突变率达到40%,和国外数据一致,提示在中国人群中也值得开展相应的研究。LOTUS研究中OS数据两组仅有数值差异,但无统计学意义,这与II期研究样本量少,不足以分析密切相关,期待后续III期临床的结果以及国内选择合适NGS检测工具后中国人群研究结果。当然,本类药物的副反应也不容忽视,需要做好安全性管理。
Abs TPS1117 III期随机对照研究评估IPAT联合紫杉醇治疗PIK3CA/AKT1/PTEN变异的晚期TNBC或HR+/HER2–乳腺癌
研究设计
IPATunity130研究是一项在多个国家进行的安慰剂对照的随机III期临床研究,入组了PIK3CA/AKT1/PTEN变异的晚期TNBC或HR+/HER2-的乳腺癌,研究设计(见下图1),在随机前确认患者的PIK3CA/AKT1/PTEN变异状态。研究分为两个队列:1. 队列A(n≈249):既往未接受过系统性抗肿瘤治疗的晚期TNBC;2. 队列B(n≈201):HR+/HER2-,不适合接受内分泌治疗的乳腺癌患者,允许患者接受除化疗和AKT抑制剂之外的系统性治疗治疗。根据入组患者激素受体的表达状态,分配至各个队列。独立分析两个队列的安全性,疗效和药代动力学。独立数据监测委员会将会定期评估IPAT或安慰剂联合紫杉醇治疗的疗效。
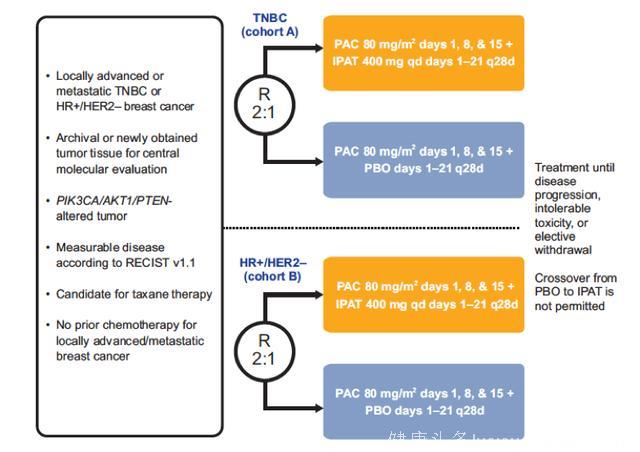
图1. IPATunity130研究设计
入组条件
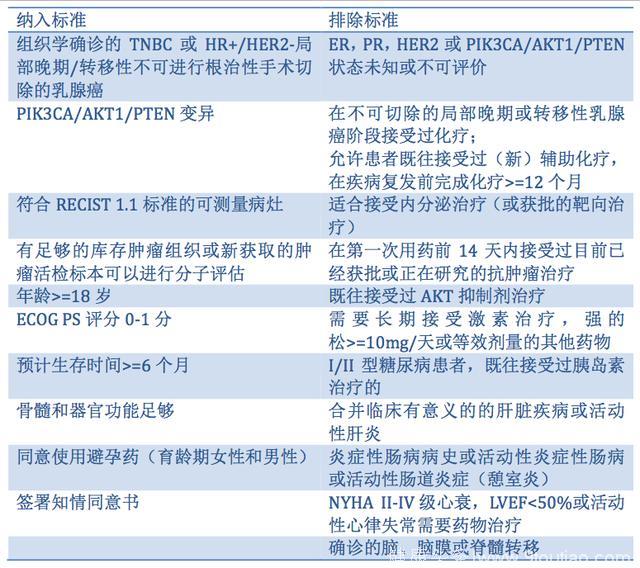
患者的主要纳入和排除标准总结见下表1。
表1. IPATunity130研究的纳入和排除标准
终点指标和患者招募
主要终点指标为研究者评估的PFS,根据RECIST 1.1标准评价;次要研究终点包括OS(主要次要终点指标)、疗效持续时间(DoR)、CBR、生活质量、基本相关的疼痛(仅在队列B评估)、安全性和药代动力学。目前研究正在全球27个国家的148个研究中心招募患者。
专家点评
张剑教授认为:LOTUS II期研究的数据已经提示PIK3CA/AKT1/PTEN通路具有缺陷(FoundationOne®测定)的亚组从AKT抑制剂的联合治疗中有获益。IPATunity130研究随之开展变得非常必要,特别是做了biomarker富集的设计,对最终删选出获益人群非常有帮助。比较特别的是,正在进行中的该研究分成了两个队列,除了晚期一线TNBC外,还有HR+/HER2–乳腺癌。我们已知PI3K的突变在HR+/HER2–乳腺癌中比例也较高,接近35%(复旦肿瘤的数据也支持这一点),导致PI3K抑制剂在HR+/HER2–乳腺癌中研究的如火如荼,本次ASCO口头报告的SANDPIPER研究提示了此类抑制剂联合内分泌药物改善PFS的明确疗效(复旦肿瘤也参与了本研究);但AKT抑制剂在这类人群中的研究,特别是联合化疗,尚无结果披露,值得进一步期待。
Abs 12065 来自乳腺癌个体化癌症基因组项目的报道:转移性乳腺癌的全基因组测序结果
背景
精准医学的理念驱动了我们对乳腺癌基因突变谱的进一步研究,以期探寻潜在的治疗靶点。目前对全外显子测序(WGS)和RNA测序对比靶向二代测序(NGS)的临床意义,尚未明确。需要进行更多的研究明确哪一类患者最可能从分子检测中获益。
方法
本研究回顾了2012-2017期间进行WGS检测的转移性乳腺癌的有意义和可干预的基因突变数据。将这些数据和目前商业化的靶向测序panel(FoundationOne,MSKCC-IMPACT)的数据进行比对。此外还分析不同亚型的患者之间,携带主要驱动基因突变患者和仅仅携带非驱动基因的突变患者之间在单核苷酸变异(SNVs)和肿瘤突变负荷(TMB)上的差异。
结果
共139例转移性乳腺癌患者进行了WGS检测,患者的基线特征总结见下表1,其中常见的SNVs(发生率>1%)及其变异率总结见下图1。
表1. 患者的基线特征
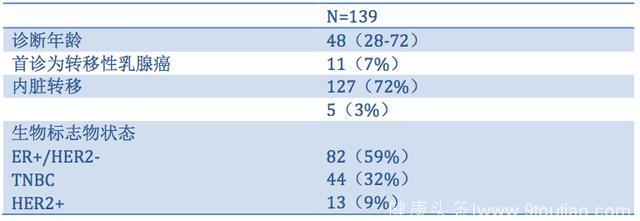
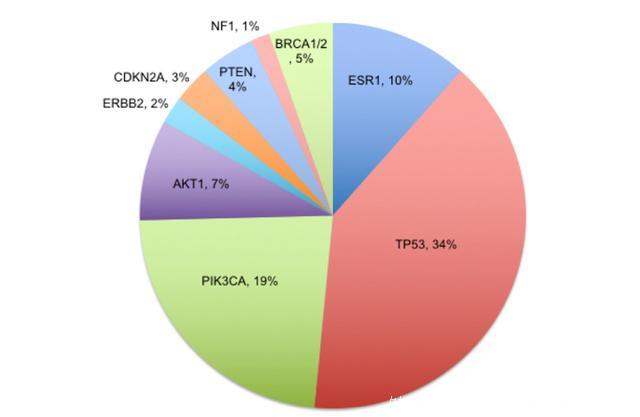
图1. 常见的SNVs(发生率>1%)及其变异率
大多数的突变(7616/7998,95%)仅在WGS检测中发现,而在靶向测序Panel中未检测到,这就意味着大部分的SNV不是驱动突变。在FoundationOne Panel(339/7998,4%)或MSKCC-IMPACT Panel(201/7998,3%)中检测到的突变可能为驱动突变 (见下图2),HRD相关的基因变异在TNBC或基底样乳腺癌中最常见。
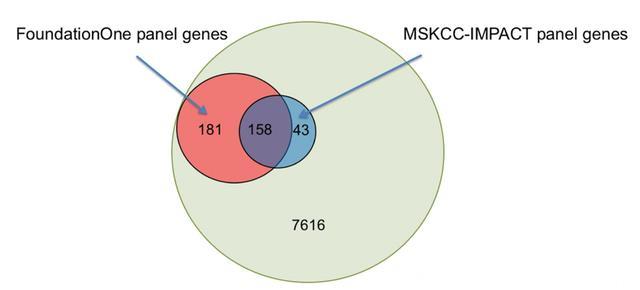
图2. 采用WGS检测乳腺癌中的SNVs
采用DNA/RNA heatmap显示WGS检测中有意义和可靶向的治疗靶点,在携带多个基因变异和携带一个主要驱动突变的患者中最常观察到基因表达。
对于不同亚型的乳腺癌患者,TMB没有显著差异。携带有驱动突变基因的患者比携带非驱动基因突变的患者TMB更高(见下图3)。
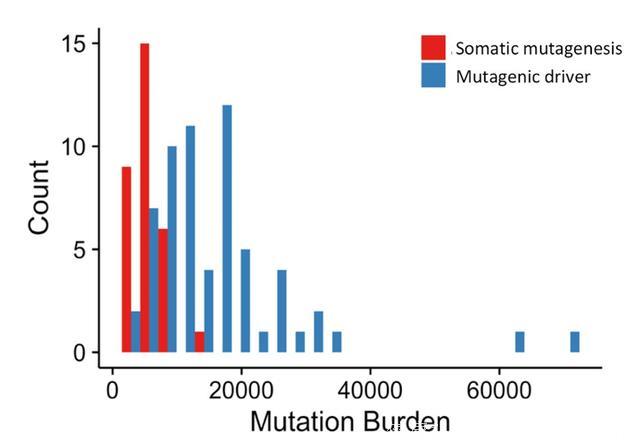
图3. 携带一个主要驱动基因突变患者和非驱动基因突变患者的TMB对比
小结
大部分的可干预突变可以通过靶向测序Panel检出。不同亚型的乳腺癌患者TMB无显著差异,但不同亚型患者的基因突变特征仍然是研究的重点。本研究尚存在一定的缺陷:缺乏患者后续的临床治疗数据,队列的异质性以及患者未接受有效的靶向治疗。
专家点评
张剑教授认为:本研究在转移性乳腺癌患者中对比了WGS和两种靶向测序Panel(FoundationOne Panel和MSKCC-IMPACT Panel)检测潜在可靶向基因的效能,结果显示大部分的可靶向突变(多为驱动突变)可以通过靶向测序Panel检测,且相比于WGS测出大量非驱动SNV的情况,靶向测序Panel成本更低,可操作性强,适合临床常规使用。特别对于biomarker富集的I-III期临床试验,是提高效率的一种重要方式。
总结
随着基因组学的研究进展,很多癌症的分子生物学特征谱逐渐清晰,如NSCLC、黑色素瘤等。根据病理检测后的分子分型为原则进行转移性乳腺癌的治疗虽然是目前的主流,但也受到了极大的挑战,特别是转移性TNBC这个目前乳腺癌治疗中的难点和热点,亟需新的研究方式获得突破。上述三项研究通过探寻TNBC或转移性乳腺癌中潜在的治疗靶点,为乳腺癌的靶向治疗提供了重要的数据。PI3K/AKT/mTOR通路是TNBC和HR阳性乳腺癌最常见的活化通路之一,发生率较高,这几项研究采用FMI开发的FoundationOne®全面基因组测序(CGP)分析服务检测了患者PIK/AKT/mTOR等通路的变异状态和潜在的驱动基因,为研究的顺利开展提供了保障。
FundationOne®目前已经进入中国市场,针对所有实体肿瘤(除肉瘤以外)使用组织样本,应用“独特探针的杂交捕获”的NGS(二代测序)技术,在一次检测中平行提供了315个基因的4种基因变异及TMB和MSI两种基因标签的全面分子信息,更加精准地指导个体化靶向及免疫治疗方案。FoundationOne®的检测结果是经过严谨分析验证的,同平台下的FoundationOne CDxTM是FDA批准的首个经过临床验证的NGS伴随诊断(CDx),并被美国医疗保险和医疗补助服务中心(CMS)覆盖。
版权声明
版权属肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。