默沙东PD-1、HER2、化疗三联疗法获批一线治疗胃癌
5月5日,默沙东(MSD)公司宣布,美国食品药品监督管理局(FDA)批准了其抗PD-1疗法Keytruda、曲妥珠单抗(trastuzumab)、含氟嘧啶以及铂类化疗联用,用于一线治疗局部晚期不可切除或转移性HER2阳性胃癌或胃食管连接部(GEJ)腺癌患者。
MSD研究实验室高级副总裁兼全球临床开发主管,首席医学官Roy Baynes博士说:“这是首次FDA批准PD-1疗法与曲妥珠单抗和化疗联用,作为这类患者的一线治疗。我们很高兴KEYTRUDA带来的新的一线联合治疗方案,HER2阳性胃癌和GEJ癌症患者的标准治疗相比,Keytruda组合疗法在ORR方面表现出有意义的改善。”
Keytruda的组合疗法
KEYTRUDA是一种人源化抗PD-1单克隆抗体,可阻断PD-1及其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞,从而增强人体免疫系统帮助检测和对抗肿瘤细胞。
KEYTRUDA与曲妥珠单抗(trastuzumab)和含氟嘧啶和铂类化疗联用的批准基于KEYNOTE-811的数据,这是一项多中心、随机、双盲、安慰剂对照试验。通过PD-L1表达(联合阳性评分[CPS]≥1或CPS <1),化疗方案(5-氟尿嘧啶[5-FU]加顺铂[FP方案]或卡培他滨加奥沙利铂[CAPOX方案]),进行随机分组。
中期的试验结果分析,对264名随机分组的患者进行了ORR和DOR评估。在最初随机入组的患者中,Keytruda组合疗法组的总缓解率(ORR)达到74%,显著优于安慰剂和曲妥珠单抗与化疗构成的对照组(52%)。
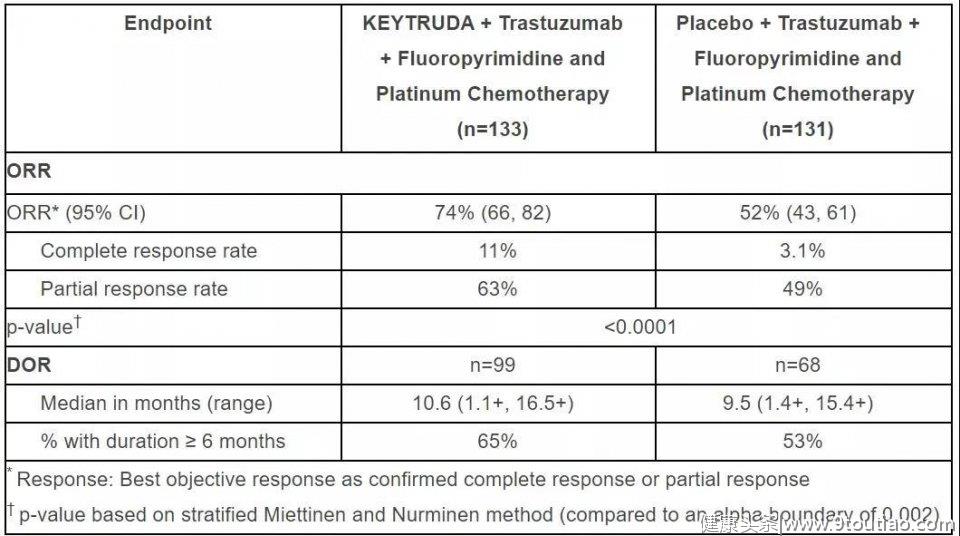 ▲ KEYNOTE-811的中期分析时获得的疗效数据
▲ KEYNOTE-811的中期分析时获得的疗效数据在安全性分析中,217例HER2阳性胃癌患者,他们每三周接受KEYTRUDA 200mg,曲妥珠单抗和CAPOX(n=187)或FP(n=29)治疗,而216例患者每三周接受安慰剂、曲妥珠单抗和CAPOX(n=187)或FP(n=29)治疗。每组有6%的患者因不良反应而停用KEYTRUDA和安慰剂。58%的患者发生了KEYTRUDA中断导致的不良反应。导致KEYTRUDA(≥2%)中断的最常见不良反应或实验室异常是中性粒细胞减少症(18%)、血小板减少症(12%)、腹泻(6%)、贫血(3.7%)。
在KEYTRUDA组合安慰剂组之间,接受Keytruda治疗的患者与接受标准治疗的患者之间腹泻(53%VS44%)、恶心(49%VS44%)、ALT升高(34%VS29%)和肌酐升高(20%VS10%)的发生率差异≥5%。两组之间的3-4级毒性反应的发生率在临床上不存在具有临床意义的差异。
结语
PD-1/PD-L1市场庞大,据保守估计,除已上市的PD-1以外,还有近30家药企在PD-1市场发力。但是庞大的市场还在前面,努力加入第一梯队或是分享市场前景的关键。销售额与商业化运作有着密不可分的关系,也与销售团队的能力呈正相关关系。
根据Research and Markets的预测,随着适应症的不断获批和新药上市的持续加速,未来全球PD-1/PD-L1销量将保持23.4%的年复合增长率,至2025年有望达500亿美元。从营收增速看,PD-1/PD-L1产品有着极大的放量空间。围绕最大化临床价值和患者获益,开发联合治疗策略,实现适应症差异化等主题,期待这种变革性药物在中国走出成功的商业化道路,造福更多患者。
参考资料:
1.https://www.biospace.com/article/releases/fda-approves-merck-s-keytruda-pembrolizumab-combined-with-trastuzumab-and-chemotherapy-as-first-line-treatment-in-locally-advanced-unresectable-or-metastatic-her2-positive-gastric-or-gastroesophageal-junction-adenocarcinoma/
2.药明康德《一线胃癌治疗再传喜讯,Keytruda组合疗法获FDA加速批准》