晚期或转移性RET融合阳性非小细胞肺癌患者招募

试验简介
比较LOXO-292与培美曲塞+铂类化疗联合或不联合帕博利珠单抗的3期试验(LIBRETTO-431)。
本试验适应症
晚期或转移性RET融合阳性非小细胞肺癌。
试验目的
主要目的:在晚期或转移性RET融合阳性NSCLC患者中比较selpercatinib与培美曲塞+铂类(卡铂或顺铂)化疗联合或不联合帕博利珠单抗治疗的PFS。
次要目的:比较评估selpercatinib与培美曲塞+铂类化疗联合或不联合帕博利珠单抗治疗的有效性、安全性、耐受性;与单个中心实验室检查相比,评估/评价RET当地实验室检查的性能。
试验设计
试验分类
安全性和有效性
试验分期
III期
设计类型
平行分组
随机化
随机化
盲法
开放
试验范围
国际多中心试验
入选标准
1 患有经组织学确诊的IIIB-IIIC或IV期NSCLC且不适于进行根治性手术或放疗的患者。
2 肿瘤组织(使用PCR或NGS)中必须携带RET基因融合。血液标本(使用NGS)结果也可接受。RET基因融合结果应当来自获得认证的实验室,并应明确表明存在RET变异。
3 根据研究者的评估,患者必须存在可测量的病灶。
4 患者的美国东部肿瘤协作组(ECOG)体能状态评分必须为0-2分。
5 具备足够的血液,肝,肾功能。
6 伴侣具有生育可能的男性患者或具有生育可能的女性患者必须同意在研究药物治疗期间以及研究药物末次给药后6个月内使用高效的避孕方法。
7 能够吞服胶囊。
8 受试者或其法定代理人必须能够按照附录1所述证明已理解参与研究的性质、意义和对于受试者的影响并签署知情同意书,其中包括依从知情同意书(ICF)和本方案中列出的要求和限制。
排除标准
1 如果已知NSCLC中存在其他经证实的致癌驱动基因。
2 用于治疗转移性疾病的既往系统性治疗(化疗、免疫治疗或生物疗法)。如果接受辅助或新辅助治疗的患者在随机化前至少6个月完成了最后一次系统性治疗,则患者符合研究资格。
3 在计划开始研究治疗前3周内接受过大手术(不包括血管通路置入)。
4 在研究药物首次给药前1周内接受过姑息性放疗或在研究药物首次给药前6个月内接受过超过30 Gy放射量的任何肺部放疗。
5 存在有症状的中枢神经系统(CNS)转移灶、脑膜转移或未经治疗的脊髓压迫。
6 在计划开始研究治疗前6个月内存在具有临床意义的活动性心血管疾病或心肌梗塞病史,或者筛选期内多次ECG中使用Fridericia公式经心率校正的QT间期(QTcF)出现延长,即QTcF>470 msec。
7 存在活动性、未控制、全身性细菌、病毒或真菌感染且需要治疗或尽管采用最佳治疗方法但持续存在未控制的并发疾病(例如:高血压、糖尿病、临床活动性憩室炎、腹腔脓肿、胃肠道阻塞、或腹膜转移癌)。
8 存在具有临床意义的活动期吸收不良综合征或可能会影响研究药物胃肠道吸收作用的其他病症。
9 患有其他恶性肿瘤,但非黑色素瘤皮肤癌、宫颈原位癌或2年前诊断出但目前并未发现的恶性肿瘤除外。正在接受乳腺癌或前列腺癌激素辅助治疗但无疾病迹象的患者符合研究资格。
10 存在控制不佳、疾病相关的心包积液或胸腔积液。在计划开始研究治疗前6个月内存在具有临床意义的活动性心血管疾病或心肌梗塞病史,或者筛选期内多次ECG中使用Fridericia公式经心率校正的QT间期(QTcF)出现延长,即QTcF大于470 msec。
11 怀孕或哺乳期。
12 患有其他恶性肿瘤,但非黑色素瘤皮肤癌、宫颈原位癌或其他原位癌或≥2年前诊断出但目前并未出现复发的恶性肿瘤除外。正在接受乳腺癌或前列腺癌激素辅助治疗但无疾病迹象的患者符合研究资格。
13 存在控制不佳、疾病相关的心包积液或胸腔积液。
14 需要长期使用类固醇药物治疗。
15 针对接受帕博利珠单抗治疗的参与者的排除标准,存在间质性肺病或间质性肺炎病史,包括具有临床意义的放射性肺炎。
16 针对接受帕博利珠单抗治疗的参与者的排除标准, 存在活动性自身免疫性疾病或过去2年内任何可能损害免疫系统的疾病或治疗。
参加机构信息
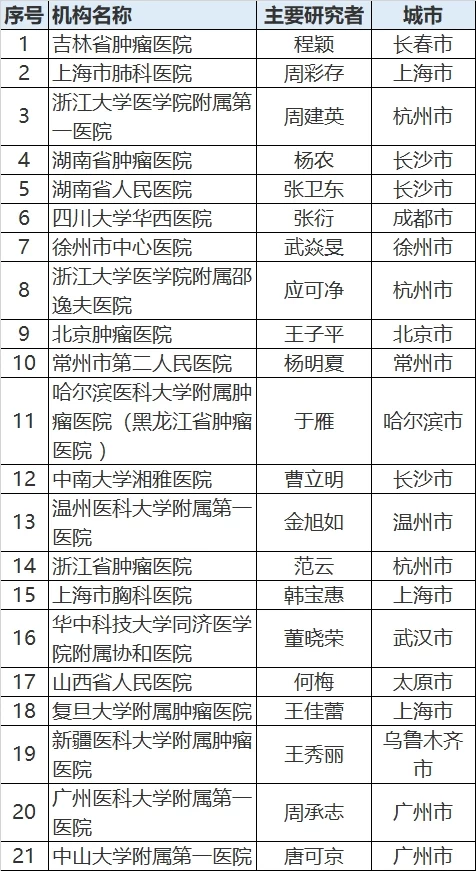
有意向参与本试验患者,可联系美中嘉和就医顾问:010-5957 5778
本试验信息来自“药物临床试验登记与信息公示平台”
推荐阅读
上海美中嘉和肿瘤门诊部为上海市医保定点医疗机构
点击图片了解详情
