靶向治疗别走弯路!肺癌用抗血管药需要查靶点吗?
之前收到一个病友的问题:安罗替尼治疗RET融合效果怎么样?
看到的时候有点懵,怎么回事?作为强效抗血管靶向药,其实是没有驱动基因靶点需要考虑的,很显然问题本身出了点错,但是这个误会从哪里来的呢?
仔细看看聊天记录,忽然想起来,在RET的专用靶向药上市之前,现在RET融合的患者能拿到的多靶点药物几乎都是包含抗血管的,而抗血管药物又在近十年发展迅速,种类繁多,于是大家就会经常把药物搞混。
当然,由此我们就衍生出一个比较难以理解的问题,抗血管药该什么情况下用?查什么靶点?
这里,我们需要从基础讲起,把基因检测报告能提供给我们的信息说一下。

关于这三类基因,肺腾助手之前曾有文章做过详细的解释。
回顾→为啥肿瘤长得快?因为有这些驱动基因“老司机”在作怪
我们来看一下上表中的五类用药情况:
1.有靶向药可用,这个问题在之前的靶向治疗总结里都详细说过。
回顾:
2.有驱动基因变异却暂无靶向药,这个要分成几类来说。
(1)正在研发之中的,例如EGFR20插入、KRAS G12C等等;
(2)在其他癌种可以用药的驱动基因,但是在肺癌中还没有或者刚刚开始相关研究,例如乳腺癌常见的HER-2、PIK3CA突变,间质瘤的KIT突变等等;
(3)当前研究发现并且确认的恶性肿瘤的驱动基因已达568个,而肺癌局限于9大驱动基因,扩大一下其他癌种的驱动基因用药也不过几十个基因,相比于驱动基因的总数,当前可以用药的类别仅仅是冰山浮出水面的一角,后续还需要更多的发现。
3.发现驱动基因变异,但是变异类型是非驱动变异,这个最尴尬,拿到基因检测报告兴奋一下,然后被泼冷水,最典型的就是ALK、ROS1、RET的原发错义突变,明明看着突变,有些检测报告还添乱,解释融合的用药。关于这类,正是上一期肺腾讲堂的内容。
回顾→基因突变了,就一定找得到靶向药可用吗?靶向治疗误用解读

4.以TP53、TUSC2为代表的控制细胞凋亡的抑癌基因,当前是不能通过靶向药物解决问题的,靶向药物都是“抑制剂”,“刹车”坏了,应该修复,不能进一步去破坏。基因治疗修复失活的抑癌基因是主要的研究方向。
回顾:
EGFR靶向耐药或被解决,新药正式被FDA“保送”
Oncoprex大起底,这个基因治疗药物神在哪里?
以BRCA为代表的抑癌基因,主要是帮助DNA修复的,当肿瘤细胞出现BRCA基因突变的时候,缺少修复能力,这种情况下,BRCA基因失活突变既是肿瘤的发生原因,又是肿瘤本身的缺陷,由此,如果通过药物限制细胞的其他修复机制,肿瘤细胞就会在抗肿瘤的药物作用,尤其是铂类化疗药的作用之下,无法产生自我修复的抗药性,这里面就是在乳腺癌、妇科恶性肿瘤中经常用的PARP抑制剂的作用原理,细胞有最主要的两个修理工,你的一个修理工常年空缺,我把你另一个修理工也挖走。
关于铂类化疗药怎么损伤DNA的,看这里。
回顾→如何搭建一个合理的化疗方案 | 肺腾讲堂 化疗药(五)化疗药总结
5.关于非驱动基因、也非抑癌基因的变异,这里有个计数总称,肿瘤突变负荷(TMB),与靶向治疗暂时不能确定有什么关系,但是与免疫治疗却关系密切。
回顾→肺癌如何确定最佳基因检测时机及标本?检测报告又该怎么解读?
复习过后,我们在有基础知识的情况下来看看大家对抗血管药的误解带来了哪些治疗中的困惑。
1.使用抗血管药难道不需要查针对性基因(VEGFR/PDGFR)吗?
现阶段不考虑。
最初抗血管靶向药出现的时候,大家还刻意查一下,但是后来发现一个现象,抗血管药的有效性与基因检测、免疫组化的VEGFR/PDGFR结果似乎关联性不大,贝伐珠单抗具有普遍的提升化疗PFS副作用作用,强效小分子抗血管药普遍短时间都有较高的有效率,索性就不依靠基因检测、免疫组化结果判定了。
如果要讲原理,可以说肿瘤增长需要依靠新生血管供给营养和氧气,这个是固定的,造成新生血管的“指令”信号VEGF并不是基因变异了,而是增多了,信号的“接收器”VEGFR、PDGFR也没有变异,是固定的结构,所以,抗血管靶向药看起来似乎在基因层面一视同仁,或许有一些基因相关性我们还没找到。
2.所有的靶向药(驱动基因针对的)联合抗血管药都可以延长药物的有效时间吗?
盲目联合不一定更好。
当前仅有EGFR一代药完成了联合大分子抗血管药物贝伐珠单抗、雷莫卢单抗的临床试验,证明可以延长PFS,而EGFR三代药的临床试验正在火热的进行中,初步公布的结果并不乐观,很可能最终结论是并没有延长的效果,其他的,例如ALK融合、ROS1融合、MET-14跳跃、MET扩增的药物,都没有见到类似的临床试验设计,所以,除非是医生对患者的具体情况作出个体化的指导,就不要广泛的联合使用了。
3.选择强效抗血管靶向药(最常见安罗替尼、阿帕替尼)是不是就是最后的办法了?
不是,也不建议放到最后才选择。
前面说了,不需依赖基因检测结果,短时间内有效率很高,这类特性决定了强效抗血管靶向药在关键节点可能是一个非常好的过渡药物,怎样的关键节点呢?进展较快又没有有把握的其他药物的时候,最典型的就是有驱动基因针对性靶向药耐药、又没有固定的下一代药的时候,还有一些比较特殊的,例如患者不愿接受静脉化疗时,医生和家属妥协的选择。
另有两种更早的选择:小细胞肺癌虽然批准了三线使用强效抗血管靶向药,但是如果患者不选二线化疗,医生也可能同意将抗血管靶向药提前到二线;联合免疫治疗,让免疫治疗还未发挥作用的阶段,肿瘤不至于进展而致命,毕竟免疫治疗如果有效,普遍在用药3-6次才能在影像上反应出效果,之前或许还存在假性进展的问题,短期而迅速起效的小分子抗血管靶向药正好在这个阶段发挥作用。
4.小分子抗血管靶向药的副作用那么可怕,用了会不会死得更快?
做好评估,排除禁忌,关键时候不要认错敌人。
尽管小分子抗血管靶向药可能出现没有检查结果可以供针对性治疗的副作用,例如没有骨转移的全身或局部疼痛、肿瘤明显好转而患者却明显消瘦,还有典型的高发的高血压、血栓、出血、黏膜损伤等等,但是任何药物的副作用都是有概率的可能性,而晚期恶性肿瘤在缺乏有效治疗的情况下,进展带来的死亡威胁几乎是必然的,所以,不要认错敌人,小分子抗血管靶向药只是灭敌的武器,不能敬而远之,要考虑的是怎么合理使用。
5.回到最初的问题,有驱动基因靶点变异的患者,什么时候选择小分子抗血管靶向药?
联合用药要合理,多靶点药需要分辨清楚。
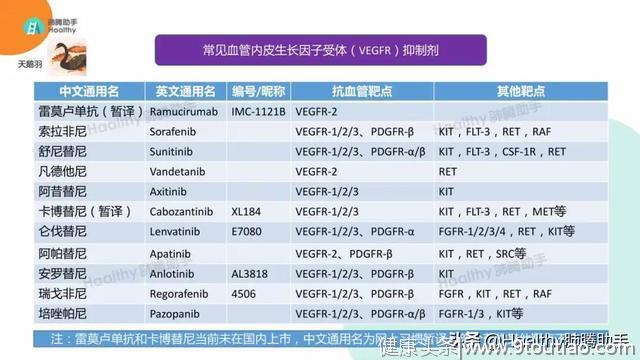
以EGFR三代继发耐药为例。如果耐药之后的基因检测有诸如MET扩增、ALK融合之类的旁路激活,那么选择联合治疗的时候,一般不考虑小分子抗血管靶向药,即使是有包括此类新检出靶点的抗血管药物,也不作为优先考虑。精准的联合,不带有多余的作用靶点,也就尽可能减少副作用。如果耐药之后没有查明耐药原因或者基因检测结果仍不能显示耐药原因,这时候联合小分子抗血管靶向药有两个思路,优先选择高变异率的,或者选择纯抗血管的,避开低频的基因,从而减少药物副作用。
以RET融合、MET扩增的初治为例,选择药物的时候,卡博替尼的有效率远低于专用药物,那么纯粹的强效抗血管药呢?在没有大规模临床试验数据的情况下,我们可以根据药物机理,也可以根据真实世界观察做一个假设,靶点覆盖面越低的,有效率越难以保证,所以选择的时候不优先考虑纯抗血管药物,而应该考虑尽可能接近准确针对检出驱动靶点的。
关于抗血管药的是是非非就先说到这里,如果有什么经验分享或者讨论,欢迎加入肺腾病友群。
深知抗癌不易,如果您是肺癌患者或者患者家属,欢迎加入肺腾病友群,与有相同经验的患者交流抗癌经验,互相鼓励!留言“入群”,申请加入肺腾病友群,或咨询临床入组相关信息。