刷新认知!中国科学家首次发现,术后短期高脂膳食或可预防结肠癌细胞腹腔转移丨科学大发现
一直被奇点糕诟病的高脂饮食,终于迎来了一个翻身的机会。
近日,陆军军医大学(原第三军医大学)基础医学院缪洪明团队发现, 高脂饮食(HFD)可以刺激脂肪组织巨噬细胞向抗癌表型M1转化,增强脂肪组织巨噬细胞的吞噬能力;同时促进T细胞的招募和活化。
此外, 将高脂饮食与传统的化疗药物联合使用,可以进一步改善小鼠的生存时间。
研究人员认为,他们的研究结果表明, 结直肠癌的腹膜转移可以在早期通过短期的高脂饮食治疗来抑制,这一发现为肠癌患者的临床管理提供了一个新的思路,也在一定程度上改变了我们对高脂饮食的认知。
这项研究成果发表在由Nature-Springer出版社和四川大学华西医院生物治疗国家重点实验室合作出版的、开源英文期刊 Signal Transduction and Targeted Therapy 上(IF:13.493),祥蔚和时荣臣为该论文的共同第一作者。

▲论文首页截图
肠癌的凶险,我想大家都知道了。更让人担心的是,近年来肠癌年轻化的趋势越来越明显。
和其他癌症一样,肠癌相关的死亡主要是转移导致的。不过, 除了常见的血源和淋巴途径转移外,结直肠癌还经常发生腹腔种植转移(PC)。
据统计,大约7%的肠癌患者在初次手术时会发现腹腔转移,而高达19%的肠癌患者在治愈性手术后随访期间会遭遇腹腔转移,在 继发性肠癌患者群体中,腹腔转移的比例更是高达80%。
在当前的条件下,肠癌的腹腔转移被认为是癌症的终末期,只开展姑息性手术和化疗等支持性治疗。然而,根据以往的报道, 在发生腹腔转移的群体中,单药或联合用药,只能让患者获得不超过12.6个月的中位生存时间。
在缪洪明教授看来,寻找新的肠癌腹腔转移的防治策略迫在眉睫。
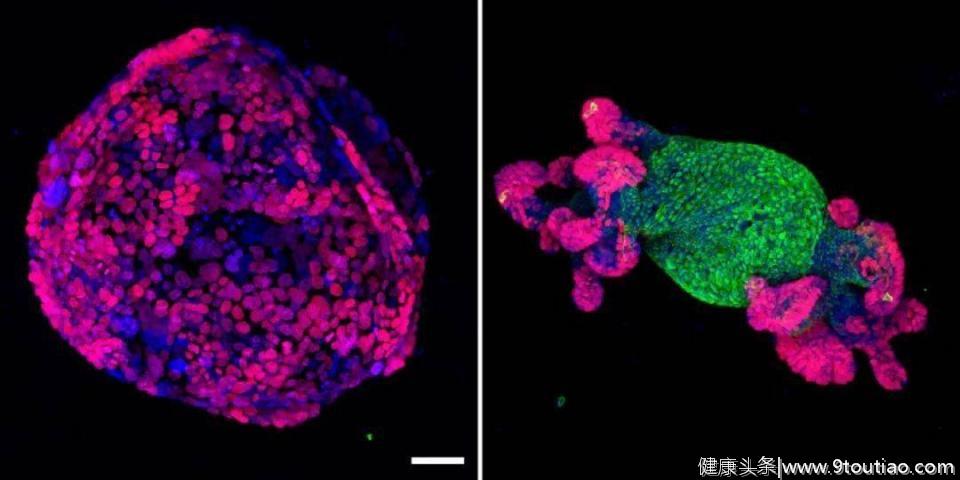
作为代谢与肿瘤微环境领域的研究专家,缪洪明教授团队自然就将研究重点放在了腹腔转移灶的微环境上了。
根据以往的数据, 肠癌细胞腹腔转移的主要据点是网膜,几乎80%的腹腔转移发生于此处。网膜实际上就是一个从胃延伸出来的大脂肪垫,覆盖着肠道。癌细胞之所以选择这个地方,主要还是因为 网膜中的脂肪细胞可以为转移过来的癌细胞提供能量。
实际上,关于癌细胞的腹腔转移,缪洪明教授团队之前也做过一些研究,之前的研究成果表明, 癌细胞想在此处扎根似乎也没那么容易,还是会受内脏脂肪的微环境调控。
其实脂肪组织中存在包括巨噬细胞在内的多种免疫细胞,而 巨噬细胞在调节局部和全身炎症及免疫状态中起着核心作用。
之前已经有研究发现 高脂饮食可以使脂肪组织巨噬细胞由M2样表型转变为M1样表型,诱发脂肪组织和其他器官的慢性炎症。鉴于此,缪洪明教授团队推测: 高脂饮食可能是结直肠癌腹腔转移的潜在防治策略。
为了验证他们的猜想,研究人员先构建了模拟结直肠癌腹腔转移的小鼠模型。
在模型中,研究人员发现 肠癌细胞确实是优先并迅速迁移到内脏脂肪中,而且厉害的是,在接种癌细胞的20天左右,几乎所有的内脏脂肪都被耗尽。看来这也是癌症患者会迅速变瘦的原因之一。
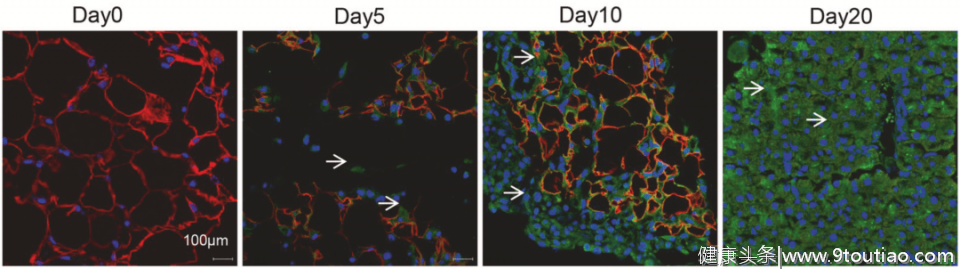
▲脂肪被耗尽
出乎研究人员意料的是, 吃高脂食物的小鼠,表皮脂肪、肠系膜、网膜和肾周脂肪的肿瘤形成显著被抑制。而且,虽然吃进去的食物总量不变,但是高脂饮食组小鼠体重明显增加。
更重要的是, 通过高脂饮食的治疗,腹膜转移的小鼠生存率明显提高。换成另一种癌细胞系之后,研究人员得到了同样的结论。
还有值得一提的 一点是, 与全程高脂饮食相比,尽早开始7天的高脂饮食治疗,就足以提高腹膜转移小鼠的生存率。而推迟高脂饮食的治疗时间,对小鼠的生存率没有好处。
这也意味着 高脂饮食只能在癌细胞腹腔转移的早期阶段发挥作用。
如此看来缪洪明团队的推测是合理的。
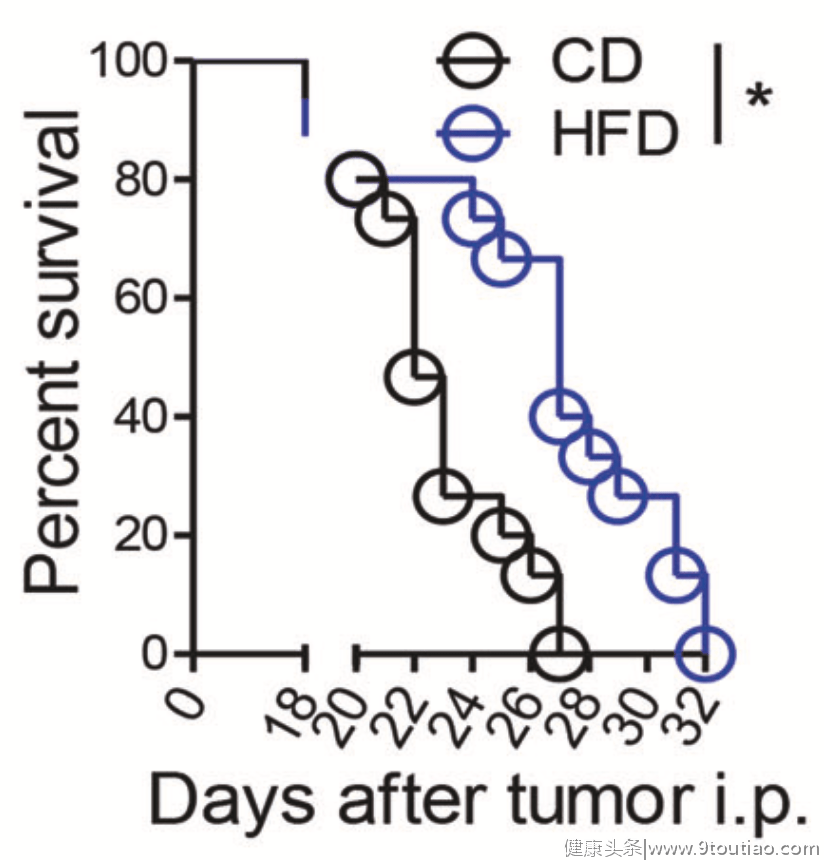
▲高脂饮食对小鼠生存率的影响
那高脂饮食究竟是如何发挥抑制肠癌腹腔转移的呢?
从现象上看, 高脂饮食明显增加了肠癌细胞靶向的脂肪组织中总T细胞、CD4+T、CD8+T细胞的比例,降低了小鼠血液中T细胞的比例,但是小鼠脾脏中上述细胞的比例没变。
这表明, 高脂饮食可能引发T细胞从小鼠的血液迁移到内脏脂肪中,改变了脂肪组织的微环境,让脂肪组织变得不再适合癌细胞的定殖。
从分子机制上看, 高脂饮食小鼠脂肪组织中巨噬细胞的Cxcl10水平明显高于T细胞、B细胞、中性粒细胞和脂肪细胞,而Cxcl10是能诱导T细胞迁移的重要趋化因子。这就是T细胞从血液中迁移到内脏脂肪的原因。
随后的实验发现, 高脂食物中的饱和游离脂肪酸通过Toll样受体4(TLR4)刺激巨噬细胞,促使脂肪组织中的巨噬细胞转化成抗肿瘤的M1型,与此同时,TLR4下游的Cxcl10水平增加。
也就是说,高脂饮食激活了脂肪组织中的巨噬细胞,巨噬细胞产生的趋化因子又招募T细胞进入脂肪组织,导致脂肪组织的免疫环境不利于肠癌细胞的定殖,最终实现抑制肠癌的腹腔转移。
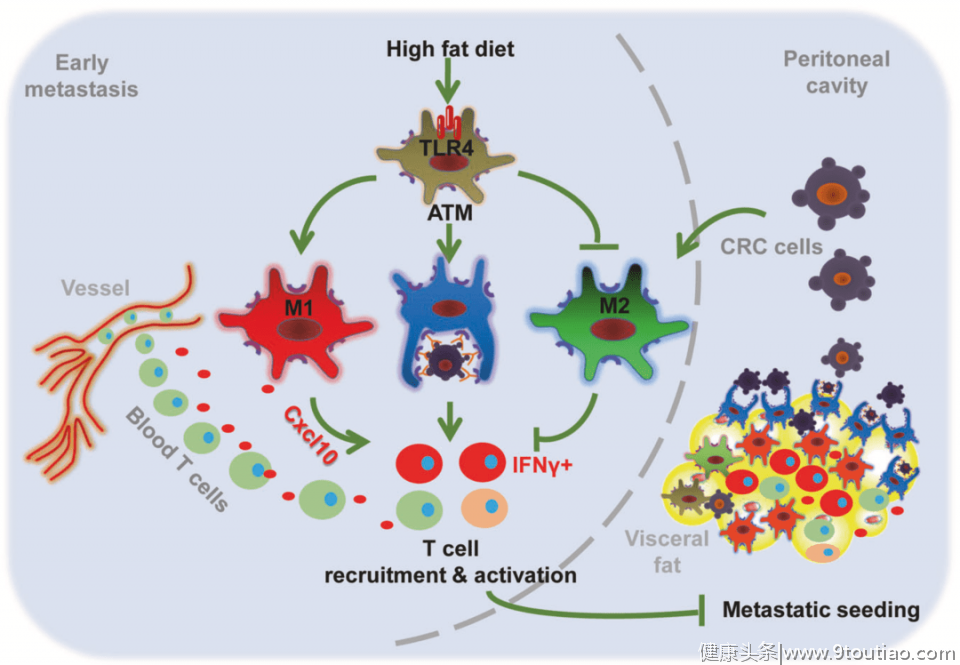
▲高脂饮食抑制腹腔转移的分子机制
在研究的最后,缪洪明教授团队还探索了高脂饮食联合化疗药物对腹膜转移的防治效果。总的来看,在整个化疗过程中都引入高脂饮食治疗的话,小鼠的生存率确实大幅提升。更值得一提的是,他们还发现, 如果在早期阶段就引入高脂饮食的话,只需7天,就能取得类似的治疗效果。
研究人员认为,这些研究结果表明,高脂食物可作为常规化疗的辅助手段,用于治疗肠癌的腹腔转移播种。
此外,作者还在文章末尾讨论部分提到, 高脂饮食的抗肿瘤作用依赖于先天性和适应性免疫,如果患者的先天性和适应性免疫不足,高脂饮食可能会通过向癌细胞提供能量而促进肿瘤进展。
基于此,研究人员表示,如果在临床上使用,高脂干预应该在早期或中期肠癌患者术后尽快实施,一是因为这些患者有足够的基础免疫力,二是实施的越早效果可能越好。
巧的是, 肠癌患者术后经常使用脂肪乳剂来提供能量。不过,术后提供的脂肪乳剂是否能预防患者的腹腔转移,还需要大型临床试验来证实。
最后需要提醒的一点是,本研究还处于探索阶段,患者不能擅自在术后摄入高脂食物,术后的饮食和营养方案需咨询主治医师。
编辑神叨叨
参考文献:
.Xiang W, Shi R, Zhang D, et al. Dietary fats suppress the peritoneal seeding of colorectal cancer cells through the TLR4/Cxcl10 axis in adipose tissue macrophages. Signal Transduction and Targeted Therapy, 2020, 5(1): 1-13.
.Koppe M J, Boerman O C, Oyen W J G, et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Annals of surgery, 2006, 243(2): 212.
.Quere P, Facy O, Manfredi S, et al. Epidemiology, management, and survival of peritoneal carcinomatosis from colorectal cancer: a population-based study. Diseases of the Colon & Rectum, 2015, 58(8): 743-752.
.Jayne D G, Fook S, Loi C, et al. Peritoneal carcinomatosis from colorectal cancer. British journal of surgery, 2002, 89(12): 1545-1550.
.Masi G, Loupakis F, Pollina L, et al. Long-term outcome of initially unresectable metastatic colorectal cancer patients treated with 5-fluorouracil/leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) followed by radical surgery of metastases. Annals of surgery, 2009, 249(3): 420-425.
.Nieman K M, Kenny H A, Penicka C V, et al. Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth. Nature medicine, 2011, 17(11): 1498.
.Shi R, Xiang W, Kang X, et al. Alteration of adaptive immunity in a colorectal peritoneal carcinomatosis model. Journal of Cancer, 2019, 10(2): 367.
.Zhang D, Shi R, Xiang W, et al. The Agpat4/LPA axis in colorectal cancer cells regulates antitumor responses via p38/p65 signaling in macrophages. Signal transduction and targeted therapy, 2020, 5(1): 1-13.
.Miao H, Ou J, Ma Y, et al. Macrophage CGI-58 deficiency activates ROS-inflammasome pathway to promote insulin resistance in mice. Cell reports, 2014, 7(1): 223-235.
本文作者 | BioTalker
期待早日开展临床研究