人红是非多?液体活检陷入公关危机,ASCO和CAP联合发文质疑

我就静静地看着你们撕。
作者丨鲸鱼
来源丨医学界肿瘤频道
带大家走进一篇曾经名噪一时的旧文,Science权威发布:癌症早诊特异度高达99%,液体活检强势来袭!有没有想起点什么?想不起来就对了,因为今天这个话题,说起来有点脸疼……
没错,前段时间,一个名叫CancerSEEK的液体活检(liquid biopsy)技术在Science上大火了一把!这项由约翰·霍普金斯大学肿瘤学家Nickolas Papadopoulos领衔的研究指出,运用CancerSEEK的液体活检技术检测包括卵巢癌、肝癌在内的8种常见肿瘤检测的中位敏感性达到了70%(P < 10-96),特异度高达99%!
逆天了!只要抽点血就能早期诊断肿瘤,还能在预后判断和疗效监测等多个方面大显神威!血液中的循环肿瘤细胞(CTCs)、循环肿瘤DNA(ctDNA)、循环RNA(ctRNA)和外泌体(exosome)等均可作为检测目标。看来,组织活检要被扫进历史的垃圾堆了!
说大话的好处就是莫名地觉得希望无限,说着说着自己都信了,坏处就是打脸的时候也异常地疼。

一
大佬质疑,液体活检遭遇尴尬
的确,液体活检比起组织活检,创伤更小,速度更快,能够反复进行,还能反应肿瘤的整体情况,克服组织活检的许多局限性。然而,作为一项新兴技术,由于投入应用的时间不长,液体活检积累的数据远没有组织活检来得丰富,相应地,应用于临床的循证证据也尚显不足。
针对这种情况,美国临床肿瘤学会(ASCO)和美国病理学家协会(CAP)可坐不住了——你小子还不知道可不可靠呢!我们可要擦亮眼睛好好评估一番!——两大协会的大佬们齐聚一堂、讨论一番,决定启动一项联合分析,看看ctDNA在临床上到底有没有用?到底实用不实用?

图1 发表在JCO上的ASCO & CAP联合评估
大佬们通过检索2007年至2017年发表的关于实体瘤ctDNA检测的文献,共发现了1338篇相关文献,从中选择了390篇加上专家委员会提供的31篇文献,在阅读全文后,最终纳入了77篇文献作为此次汇总分析的参考文献。经过一番激烈的讨论之后,这项联合评估在Journal of Clinical Oncology以及Archives of Pathology & Laboratory Medicine两本期刊上同时发布。
联合评估的结论认为,虽然有一些证据证明了ctDNA检测在某些晚期肿瘤中的临床有效性和实用性,但目前ctDNA用于大多数晚期肿瘤以及肿瘤的早期诊断、疗效监测、残留病变检测等方面的有效性和实用性证据依然不足,没有证据表明ctDNA检测能够用于临床试验之外的肿瘤筛查。
二
直戳死穴,问题确实不少
所谓的ctDNA(circulating tumor DNA)就是循环肿瘤DNA,指的是源自肿瘤细胞的无细胞DNA片段(cell-free DNA)。在血浆或血清中常常存在来自多种细胞的的无细胞DNA片段,通过检测收集患者血液样本中的无细胞DNA片段并检测其中有无体细胞突变,以推断这些无细胞DNA片段中是否有ctDNA的存在。而相应的监测就称为ctDNA检测(ctDNA assey),或能用于肿瘤的普查筛查、早期诊断、疗法选择、疗效监测、预后判断等方方面面……
这次的联合评估从ctDNA样本的选择及样本的处理、检测方法的有效性、检测结果的解读和报告、临床的有效性和实用性四个方面对ctDNA在实体瘤中的应用进行了解读。
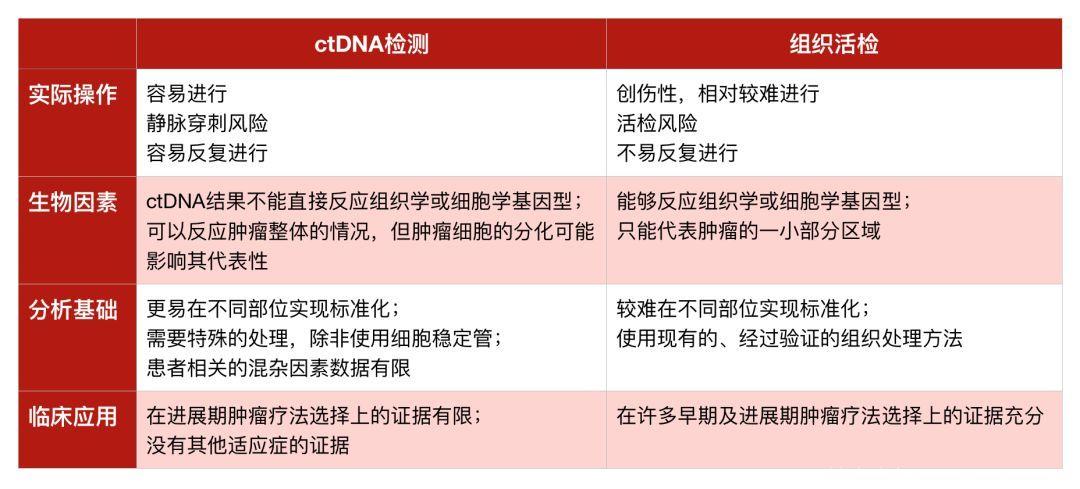
首先,联合评估比较了ctDNA检测与组织活检,认为其具有创伤小、易重复、可反应肿瘤整体情况的优点,但也指出了其准确性依然有待商榷,许多因素诸如标本收集、储存条件等均有可能影响检测结果。
表1 ctDNA检测与组织活检比较
在样本选择和处理方面的关键结论如下:
- 证据表明,血浆是ctDNA分析的最佳标本类型。
- 证据支持,样本收集应使用细胞稳定管或EDTA抗凝血管。
- 其他可能影响ctDNA检测的多种变量,如样本收集、样本处理、储存条件和时间以及与患者有关的生物因素等,仍需要进一步的研究。
其次,检测方法的有效性上,由于尚且缺乏统一的方法和标准,分析的有效性、可重复性以及结果的通用性依然存疑。在分析了大量文献后,专家提出了以下观点:
- 任何临床ctDNA检测需要以检测方法的有效性为前提,尤其要注意接近检测下限的结果;较为理想的情况是能够有标准化的样品作为比较。
- 尚不存在证据能够确定体细胞突变检测的最佳下限,目前最佳检测下限的确定依然取决于ctDNA检测的用途,但这一下限低于肿瘤基因分型检测的下限。
- 由于检测的具体细节不同,不同的ctDNA检测可能无法给出相同的结果。
- 检测之间的可比性、检测的稳健性、检测有效性的验证等,仍需要进一步研究。
再次,在检测结果的解读和报告方面,专家们指出:
- 证据表明,ctDNA检测的结果需要与临床情况以及其他肿瘤相关的信息结合在一起,才能做出更好的治疗选择。
- ctDNA在不同患者血浆中的含量差异很大;ctDNA在预后判断和疗效监测中的作用仍需要进一步研究。
- 发现潜力未定的克隆性造血基因中的ctDNA变异时应当十分注意,如何解读这些变异仍需要进一步研究。
- ctDNA检测的结果应该能够和肿瘤组织活检的相比较,以便能发现两者之间的不一致。
由此看来,虽然液体活检、ctDNA检测的风头正旺,得到了许多商业资本以及普通民众的关注,但实际上问题也还是不少——除了能够确定血液是较好的检测样本之外,ctDNA的样本处理、分析标准、解读报告的过程中还是有很多问题处于“同志仍需努力”的阶段。
不过,依然有一些ctDNA检测已经获得了批准应用于临床,比如美国FDA和欧洲药品管理局就批准了COBAS,用于检测非小细胞肺癌中的EGFR突变和结直肠癌中的KRAS突变。中国CFDA也与2018年批准了Super-ARMS用于肺癌EGFR突变的检测。那么,ctDNA检测在临床上的到底有没有用呢?
三
进入临床,道阻且长
针对ctDNA检测在临床上应用的有效性和实用性,专家组分疗法选择、疗效判断、复发监测和肿瘤筛查四个方面进行了分别阐述。
对于进展期肿瘤的疗法选择,ctDNA是否有用呢?要回答这一问题,最好的方法自然是开展前瞻性临床研究,可惜目前并没有这样的研究结果可以供我们参考。于是,退而求其次,专家们根据一些回顾性研究的结果提出,ctDNA检测的阳性结果或许能够为非小细胞肺癌或结直肠癌的疗法选择提供一些参考。然而,对于ctDNA检测结果为阴性的患者,仍然需要进一步以肿瘤组织活检作为验证手段。
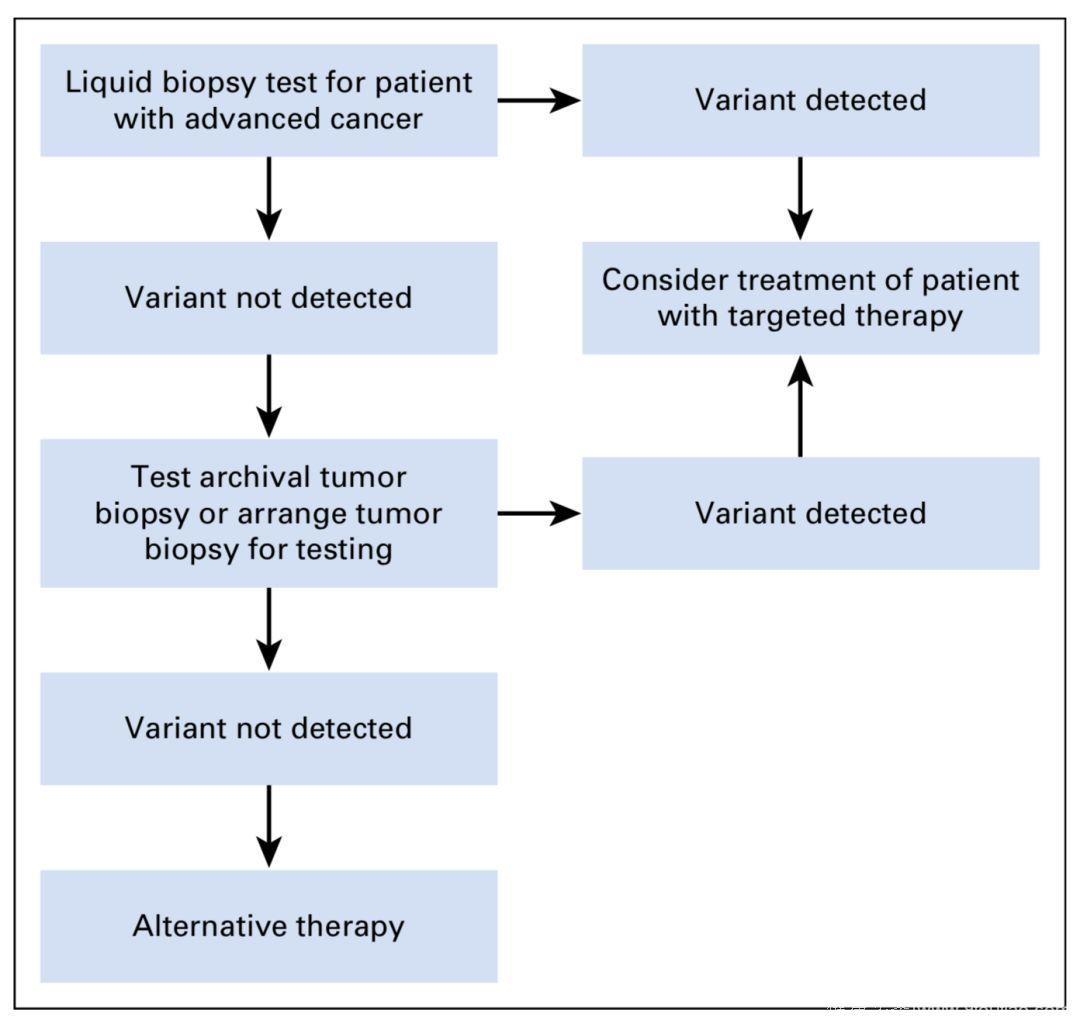
图3 ctDNA检测阴性患者仍需要以组织活检验证
虽然对于绝大部分患者,其血液ctDNA检测结果和组织活检结果一致,但仍然有相当一部分患者ctDNA会出现假阴性或假阳性的结果。出现假阴性的患者相对较多,ctDNA不能检测出其肿瘤的突变,但组织活检却能发现相应的突变,如果这群患者没有进行组织活检的验证,则可能错过靶向疗法;而出现假阳性结果的患者相对较少,这群患者对于靶向疗法的反应估计也较差。
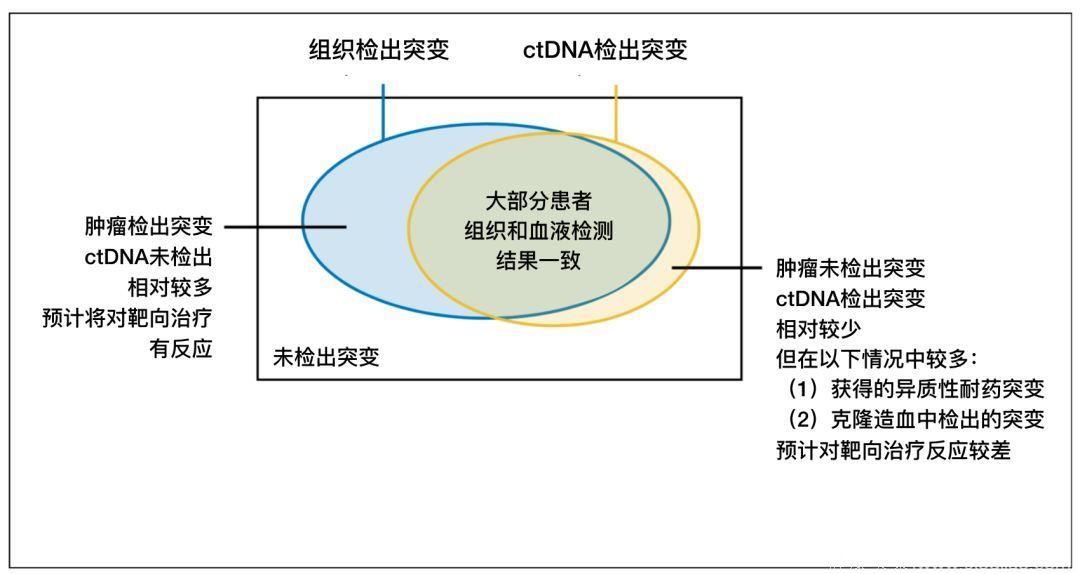
图4 组织活检与ctDNA检测结果和治疗策略
而在定量检测ctDNA以监测疗效,通过ctDNA监测微小残留病变复发以及ctDNA用于无症状人群的肿瘤筛查方面,均没有足够的证据支持。
ctDNA在临床应用中的关键结论如下:
- 除了已获批准的检测外,大多数检测方法的临床有效性和实用性缺乏相应的证据,尚需进一步研究。
- ctDNA检测与肿瘤组织活检的结果可能不一致,需要行组织活检以确认ctDNA检测的阴性结果。
- 对于晚期癌症,在肿瘤进展、开始初识治疗前行ctDNA检测,结果更可靠。
- 在组织活检中经过验证的基因变异,如果在ctDNA检测中取得阳性结果,可以支持选择靶向治疗。
- 目前还没有临床证据表明ctDNA检测在临床试验之外能够用于肿瘤疗效监测、早期诊断或筛查。
四
满怀信心,理性期待
虽然“液体活检”的概念被大家炒得火热,但这一联合评估还是告诉我们,需要理性期待这一技术的应用。
至少到目前为止,这项技术鲜有走出临床试验,真正被临床广为应用的——被批准的几项检测技术也仅仅局限在非小细胞肺癌EGFR突变和结直肠癌KRAS突变的检测。想要看到它被推广,技术瓶颈的解决和大量的前瞻性临床试验必不可少。不过,这不妨碍我们对这项技术满怀期待,毕竟,从筛查到复发,在肿瘤治疗的每一个环节,都可能用得上它,令人充满无限遐想。
ASCO和CAP虽然声色俱厉,以严父严母的姿态对液体活检一阵批斗,不过最后还是满脸慈爱的鼓励道:新的证据正在不断地涌现——随着液体活检技术的不断更新,也许下一个版本推出时,我们就能看到它在临床上活跃的身影了!
界哥嘚啵嘚
所以,液体活检最终是要征服世界的人。
想要文献原文的亲们文末留言,或直接发邮件至投稿邮箱哦!
参考文献
[1] Cohen JD, Li L, …& Papadopoulos N. (2018).Detection and localization of surgically resectable cancers with amulti-analyte blood test. Science, published online January 18, 2018, eaar3247. doi: 10.1126/science.aar3247.
[2] Shiyu Jia, Rui Zhang, Ziyang Li, & Jinming Li. (2017). Clinical andbiological signi cance of circulating tumor cells, circulating tumor DNA, andexosomes as biomarkers in colorectal cancer. Oncotarget, 2017, Vol. 8, (No. 33), pp: 55632-55645. doi:10.18632/oncotarget.17184.
[3] Jason D. Merker, Geoffrey R. Oxnard, Carolyn Compton, Maximilian Diehn, Patricia Hurley, Alexander J. Lazar, Neal Lindeman, Christina M. Lockwood, Alex J. Rai, Richard L. Schilsky, Apostolia M. Tsimberidou, Patricia Vasalos, Brooke L. Billman, Thomas K. Oliver, Suanna S. Bruinooge, Daniel F. Hayes, and Nicholas C. Turner. (2018). Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review. Published at jco.orgon March 05, 2018. doi: 10.1200/JCO.2017.76.8671. Available at: http://ascopubs.org/doi/pdf/10.1200/JCO.2017.76.8671Last assessed on 2018-03-25.
[4] cobas EGFR Mutation Test v2. Available at:https://molecular.roche.com//assays/cobas-egfr-mutation-test-v2/Last assessed on 2018-03-25.
[5] cobasKRAS Mutation Test. Available at:https://molecular.roche.com/assays/cobas-kras-mutation-test/Last assessed on 2018-03-25.
[6] 艾德生物. Available at:http://www.amoydx.comLsat assessed on 2018-03-25.
