又一名人因脑瘤去世!速来get诊断技巧!
新媒体管家
关于脑瘤诊断,你掌握了多少呢?
作者|蛋壳
来源|医学界神经病学频道
据台湾媒体报道,著名作家李敖于3月18日上午10时59分在台北“荣总”医院去世,享年83岁。
据海外网梳理,83岁高龄的知名作家李敖,这两年健康频亮红灯。早在2017年,李敖曾透露自己因左脚行动不便而就医,不料发现罹患脑瘤,最终证实为良性,但他的经纪人表示,有两家医院皆表示没看过这样的病例,认为病例很罕见。
新闻一经报道,在悼念大师仙逝的同时,也有众多人开始关注脑瘤这一类疾病。今天就在此来和大家聊聊几种颅内肿瘤的影像诊断方法。
1
基本检查方法
CT平扫是怀疑颅内肿瘤的一线检查。CT是显示钙化、出血、脂肪的首选检查方法,在显示钙化的分布及邻近肿瘤的颅骨重构等方面优于磁共振。有时对鉴别肿瘤和非肿瘤病变有特殊价值。对怀疑颅内肿瘤的传统的MRI检查,最常用的序列包括T1、T2、FLAIR、T1增强等。这些常规序列能够显示出肿瘤周边的水肿和占位效应及囊肿、出血、坏死等变化。
2
特殊序列
2.1
DWI和DTI(Diffusion-WeightedImagingandDiffusionTensorImaging)
DWI基于独特的对比机制,反映了组织内水分子的弥散运动差异。表观弥散系数(ADC)反映了组织中细胞外间隙的水的流动性。ADC值受到细胞外间隙的空间大小影响,在肿瘤组织中,细胞增殖时常表现为ADC的显著降低。水分子扩散越自由,DWI信号丢失越多,DWI信号越低,ADC值越高,相反,水分子弥散受限,DWI信号丢失越少,DWI信号越高,ADC值越低。其在诊断颅内肿瘤中的应用包括:
1. 鉴别颅内脓肿病灶和肿瘤坏死:脓肿病灶中的细胞数量和高粘度限制了水分子的扩散运动。(如图1所示)
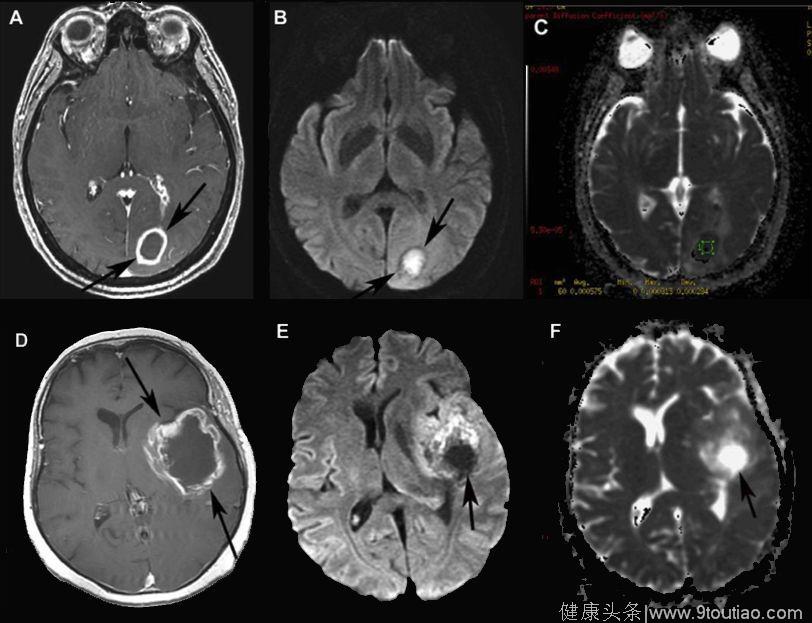
图1. 左侧枕叶的脓肿病灶在T1增强序列表现出环形增强信号(A),DWI表现为高信号(B),ADC表现为低信号(C);而在左侧岛叶的胶质母细胞瘤中,T1增强同样表现为不规则的环形增强(D),但是DWI表现为低信号(E),ADC表现为高信号(F)。
2. 评估肿瘤的分级:细胞外间隙的减少及细胞核/质比值增高都导致高级别的肿瘤水分子弥散受限。相应的,ADC值高低与肿瘤级别呈负相关(低级别肿瘤的ADC值更高,需要注意部分类型中有重叠)。
3. 更准确地描述胶质瘤的真实范围:因为弥散受限可能会扩展到增强部分以外的区域。(如图2所示)

图2.左侧颞叶的低级别的星型胶质细胞瘤在T1WI上表现为不均匀强化病灶(A),DWI上表现为低信号(B),ADC上表现为高信号(C);左侧岛叶的胶质母细胞瘤在T1WI上表现为不均匀强化病灶(D),而DWI上表现为更大范围的弥散受限区域,提示细胞数量的增高(E),ADC上表现为低信号(F)。
4. 鉴别血管源性水肿和肿瘤浸润性水肿:高级别的肿瘤浸润性水肿的ADC值比继发于代谢疾病的水肿的ADC值更低。
组织中分子因受到阻碍在不同方向上的运动差异称为“各向异性”,在高度组织化的结构,例如白质当中,因为受到髓鞘这一物理屏障的限制,出现分子运动的各向异性,假使这些分子不受到空间限制,理论上表现为各向同性弥散运动。因此,在DWI的基础上又了DTI成像,可用于连接纤维的重建。其在诊断颅内肿瘤中的应用包括:
① 确定肿瘤组织和白质纤维束之间的关系(造成纤维偏差、水肿、浸润、破坏等改变)。(如图3所示)
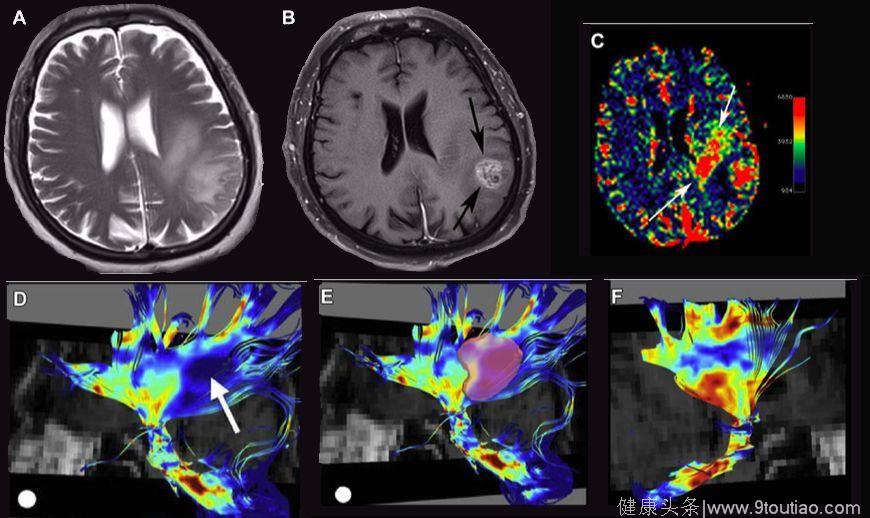
图3.T2WI和T1WI(A,B)上提示左侧顶叶的胶质母细胞瘤,伴有肿瘤周围水肿效应,灌注成像显示出了肿瘤的真实范围(C),放射冠的纤维重构和各向异性分数(D-F)中,红色表示各向异性分数越高,而蓝色反之。在箭头所指处的各向异性分数的减低提示肿瘤的浸润(D、E),这一改变可以对比对侧正常的纤维(F)。
② 可以提示在常规序列上不明显的改变,进而可以帮助确定肿瘤的边界。
2.2
灌注成像
肿瘤的增殖需要充足的血供,在高级别的肿瘤中,大量密集的新生血管为肿瘤组织提供了大量的血供。而这些新生血管主要是异常的毛细血管,同时导致了局部毛细血管的高通透性。对于这样的病理改变,则可以通过2种微血管成像方法来检测:
• 一是动态磁感对比(DSC)T2*加权灌注(DSC-MRI)技术,在造影剂第一次通过时可以,估计在新生血管性毛细血管床的体积;
• 另一种为动态对比增强(DCE)T1加权渗透性(DCE-MRI)技术,来估计血脑屏障的损伤。
■ DSC-MRI在诊断颅内肿瘤的应用包括:
1.肿瘤的分级:在高级别的肿瘤病灶中rCBV(相对大脑血流容积)显著高于低级别肿瘤。(如图4所示)
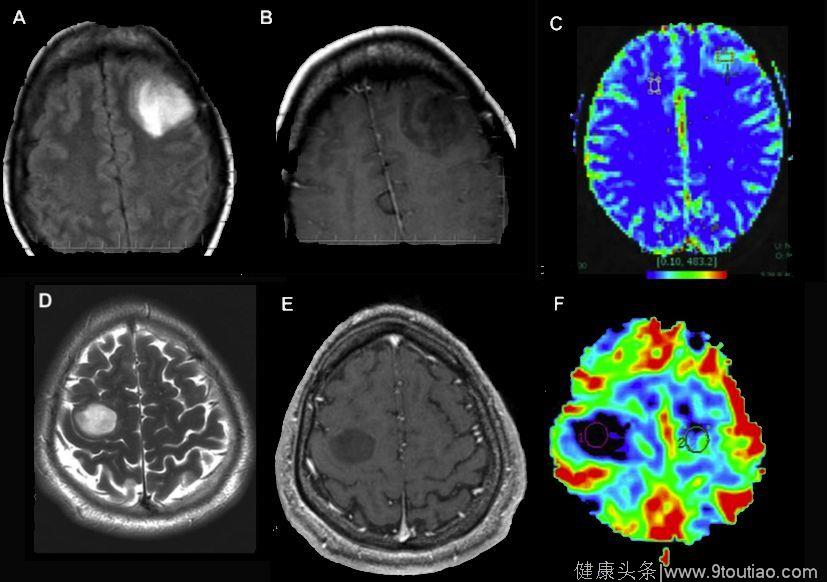
图4:基于DSC-MRI的肿瘤分级,分级为III级的间变性星形胶质细胞瘤患者的FLAIR序列(A)提示左侧额叶高信号病灶,在TIWI增强(B)上为低信号,因为血脑屏障的完整性,病灶并无增强,但在rCBV上左侧的CBV值比对侧额叶高出5.7倍,说明肿瘤组织内具有更高的毛细血管密度。再如,分级为II级的纤维性星形胶质细胞瘤的患者,T2WI上可见右侧额叶的高信号病灶(D),同样病灶未见明显增强(E),未见明显局灶rCBV的升高。
2.rCBV图可用以选择活检部位。
3.更敏感地确定胶质瘤的真实范围:rCBV增高可能比在增强部分以外的区域出现,提示更准确的肿瘤范围。
4.区分肿瘤复发和放射性坏死:放射性坏死不同于肿瘤复发,其rCBV表现为减低。
2.3
MRS波普
MRS是一种无创性的研究组织分子代谢的手段,不同的分子以某个特定的频率共振(分子的化学指纹)。因分子的大小形态不同,引起的局部磁场的轻微变化,从而导致共振频率的变化,即化学位移效应。在波谱上,x轴上质子的共振频率以标准参考物质的百万分之一为单位,y轴表示的是信号强度相对于最高峰的比例。
1.N-乙酰天冬氨酸(NAA)是神经数量和功能活动的标记,任何累及神经细胞的损伤都可能降低NAA水平;
2.肌酐(Cr)是能量代谢的标记,产生坏死的过程会释放出脂质成分并造成Cr水平降低;
3.胆碱(Cho)是质膜合成和降解(质膜翻转)的标记,累及胶质细胞或刺激其分裂的损害会造成Cho水平的降低。
■ MRS在诊断颅内肿瘤时发挥重要的作用
1.肿瘤的分级:定性和定量的检测高Cho/NAA峰值比在诸多研究中被认为能够预测高级别的肿瘤。(如图5所示)
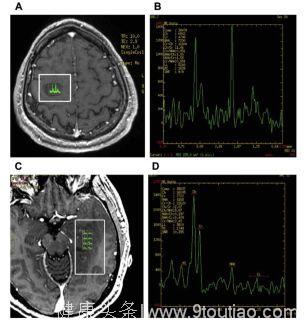
图5:基于MRS的肿瘤分级,无增强的右侧额叶纤维星形胶质细胞瘤,分级为II级,显示出胆碱峰的中度增高(Cho/Cr比值1.46,Cho/NAA比值0.95);而在高级别的III级无增强的胶质瘤中,Cho升高,NAA降低(Cho/Cr比值2.07,Cho/NAA比值5.07)。
2.鉴别无明显增强的肿瘤和水质,能够更好地确定胶质瘤的形态和真实范围。
3.通过定位高Cho/NAA比值的区域以提高活检的准确性,从而降低假阴性率。
4.鉴别孤立性脑转移瘤和高级别的脑胶质瘤:Cho水平增高的病灶,伴有周围组织的增强可能提示高级别胶质瘤的浸润。
3
以神经胶质瘤的影像诊断流程
以中枢神经系统最为常见的原发性颅内肿瘤神经胶质瘤为例,WHO中枢神经系统肿瘤分类将胶质瘤分为WHOI~IV级,I、II级为低级别胶质瘤,III、IV级为高级别胶质瘤。按照《2015年中国中枢神经系统胶质瘤诊断与治疗指南》,对于怀疑胶质瘤诊断的影像学检查:
1.MRI序列及断层基本要求:平扫应该包括T1、T2和FLAIR序列,增强后行T1扫描。平扫及增强至少包括2个断层方向。强烈推荐增强前、后扫描矢状面和横断面T1、平扫横断面T2和FLAIR。可根据临床需要增加特殊序列和断面(如重T2和冠状面等)。DWI对鉴别胶质瘤与超急性脑梗死、脑脓肿和淋巴瘤等有价值。
2.DWI高信号区提示肿瘤细胞密度高,可用于指导活检和判断肿瘤残留或复发。
3.MRS指1H的波谱。建议首选多体素核磁共振波谱成像MRS,有条件时可多体素+单体素MRS。应注意波谱成像中胆碱(Cho)峰增高并非仅见于肿瘤,也可见于炎症及急性脑梗死等病变。建议应全面评价各主波(如NAA,Cr,LIP等)和对照对侧正常脑组织的波谱图。Cho最异常区域可能是活检最佳靶点。MRS可能对鉴别肿瘤与非肿瘤、肿瘤与放射性坏死、肿瘤分级及评价治疗反应有帮助。
4.PWI包括灌注和渗透性成像两法,分别测量肿瘤的血容量情况和血管渗透性情况。扫描操作及处理过程复杂,影响结果因素多,解读不一致性高。相对脑血容量(rCBV)对鉴别胶质瘤与淋巴瘤有价值。
5.DTI可用于胶质瘤重要皮质纤维束显示。
6.BOLD可用于胶质瘤重要皮质功能区显示。
7.PET-CT或PET-MR可能对鉴别肿瘤和放射性坏死、肿瘤分级有帮助,或提示活检最佳靶点。示踪剂有FDG、MET和FET,前者是含糖,后两者是氨基酸,建议有条件者选用后两者。
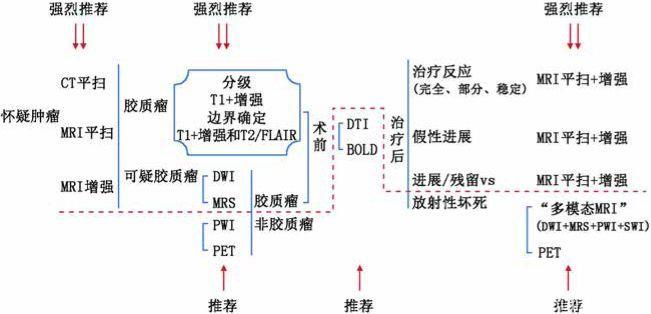
图7. 胶质瘤影像学检查流程图
参考文献
[1] Chourmouzi D,Papadopoulou E,Marias K,et al.Imaging of brain tumors[J].Surgical Oncology Clinics,2014,23(4):629-684.
[2] Purohit B,Kamli A A,Kollias S S.Imaging of adult brainstem gliomas[J].European journal of radiology,2015,84(4):709-720.
[3]《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J].中华医学杂志,2016(7):485-509.