[病理研究]罕见的鞍区和鞍上脑室外神经细胞瘤如何与垂体腺瘤等区分鉴别 | 张丽 刘雪咏 张声 陈余朋 王行富
版权信息
鞍区和鞍上脑室外神经细胞瘤
作者:张丽 刘雪咏 张声 陈余朋 王行富;发表在中国现代神经疾病杂志 2017年12月第17卷第12期;基金项目:福建省自然科学基金资助项目(项目编号:2014J01413);作者单位:福建医科大学附属第一医院病理科;通讯作者:王行富
摘要
目的 探讨发生于鞍区和鞍上的脑室外神经细胞瘤的临床病理学特征。
方法 对1例鞍区和鞍上脑室外神经细胞瘤患者的临床表现、影像学特征、组织学形态、免疫表型和分子遗传学特征进行回顾分析并复习相关文献。
结果 女性患者,27 岁,临床表现为反复头痛伴双眼视物模糊5 个月。头部MRI显示鞍区和鞍上占位性病变,T1WI呈等或低信号,T2WI呈高或低混杂信号,扩散加权成像呈稍高信号,界限清晰,正常垂体结构显示不清。临床诊断为垂体腺瘤,行经鼻蝶入路垂体腺瘤切除术+ 脑脊液鼻漏修补术+ 视神经减压术,手术全切除肿瘤。组织学形态可见肿瘤细胞呈弥漫浸润性生长,部分区域可见神经毡背景;肿瘤细胞大小和形态相对一致,胞核圆形或卵圆形,染色质细腻深染,未见核分裂象。免疫组织化学染色可见肿瘤细胞胞核表达神经元核抗原和甲状腺转录因子⁃1,胞核和胞质表达钙视网膜蛋白,胞质表达突触素、嗜铬素A、上皮钙黏素和基质金属蛋白酶⁃9;胞核局灶性表达S⁃100 蛋白,胞质局灶性表达神经微丝蛋白、细胞角蛋白8 和波形蛋白;Ki⁃67 抗原标记指数约为3%。网织纤维染色呈阴性。基因检测可见肿瘤细胞无异柠檬酸脱氢酶基因突变,无1p/19q⁃共缺失。最终病理诊断为脑室外神经细胞瘤(WHOⅡ级)。
结论 鞍区和鞍上脑室外神经细胞瘤临床极为罕见,组织学形态与发生于脑室的中枢神经细胞瘤相似,表现为肿瘤弥漫浸润性生长,肿瘤细胞形态较一致,胞核圆形,可见神经毡背景和“树枝”状薄壁毛细血管。 应注意与垂体腺瘤、少突胶质细胞瘤和透明细胞型室管膜瘤等相鉴别。
关键词
神经细胞瘤; 蝶鞍; 病理学; 免疫组织化学
病历摘要
中枢神经细胞瘤(CN)是一种发生于中枢神经系统的相对罕见肿瘤,占全部中枢神经系统肿瘤的0.3% ~ 0.6%[1],好发于脑室系统,亦见于脑室系统以外,即脑室外神经细胞瘤(EVN)[2]。发生于鞍区和鞍上的脑室外神经细胞瘤极为罕见,目前仅见数例报道[1⁃7]。本文回顾分析1例鞍区和鞍上脑室外神经细胞瘤患者的诊断与治疗过程,并复习相关文献,探讨其临床表现、影像学特征、组织学形态和免疫表型、基因检测以及诊断与鉴别诊断要点。
患者女性,27 岁,主因反复头痛伴双眼视物模糊5 个月,于2016 年2 月23 日入院。患者5 个月前无明显诱因出现头顶部闷痛,中等程度,偶伴头晕,每日均有发作,可自行缓解,伴双眼视物模糊、视力下降、复视,症状反复发作,同时伴性功能减退。门诊行头部MRI 检查显示,鞍内和鞍上占位性病变,增强扫描病灶呈不均匀强化,考虑垂体肿瘤,遂以“ 垂体肿瘤”收入院。患者自发病以来,精神、饮食佳,睡眠尚可,大小便正常,体重无明显变化。
既往史、个人史及家族史均无特殊。
体格检查 患者体温36.8 ℃,心率86 次/min,呼吸20 次/min,血压128/84 mm Hg(1 mm Hg =0.133 kPa)。神志清楚,语言尚流利,矫正视力右眼0.8、左眼0.4,双侧瞳孔等大、等圆,直径约3mm,对光反射灵敏,眼球各向活动充分,无眼震、双睑下垂;四肢肌力5 级,肌张力正常,腱反射对称活跃,深浅感觉大致正常,共济运动正常,病理反射未引出,颈部柔软,双侧Kernig征阴性。
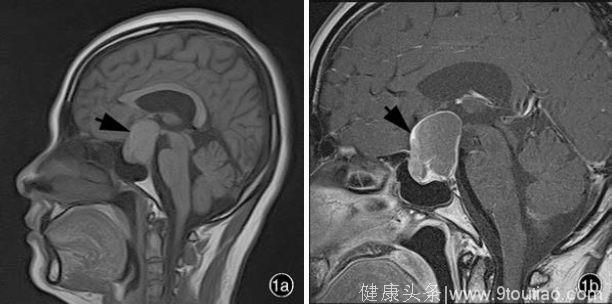
(图1 头部MRI 检查所见1a 矢状位T1WI 显示,鞍内和鞍上团块状混杂信号影,边界清晰(箭头所示) 1b 矢状位T1WI 增强扫描显示,病灶边缘不规则环状强化(箭头所示),病灶中央未见明显强化)
辅助检查实验室检查:血尿便常规、血液化学、下丘脑⁃垂体激素均于正常值范围。影像学检查:头部MRI 显示,鞍内和鞍上团块状混杂信号影,T1WI 呈等或低信号(图1a)、T2WI 呈高或低混杂信号、扩散加权成像(DWI)呈稍高信号,病灶内可见多发液液平面,界限清晰,大小约3.80 cm × 2.50 cm ×3.40 cm,蝶鞍扩大,正常垂体结构不清,视交叉受压上移,鞍上池明显受压变窄,双侧颞叶呈弧形受压改变;增强扫描显示,鞍内和鞍上团块状病灶边缘不规则环状强化,病灶中央未见明显强化(图1b)。
诊断与治疗经过临床诊断为垂体腺瘤。遂于入院后第4 天(2016 年2 月26 日)于全身麻醉下行经鼻蝶入路垂体腺瘤切除术+ 脑脊液鼻漏修补术+视神经减压术,术中于鞍底可见黄色肿瘤,大小约3.80 cm × 3.50 cm × 3.00 cm,质地坚韧,血运丰富,其内充满大量陈旧性出血,垂体受压向左后方移位,部分肿瘤组织质地较软,与鞍膈粘连紧密。手术全切除肿瘤,切除标本行组织病理学检查。
(1)大体标本观察:手术切除标本呈灰褐色破碎组织一堆,大小约2.00 cm × 1.00 cm × 0.30 cm,质地柔软,无明显包膜。经体积分数为10%中性甲醛溶液固定,常规脱水、透明、石蜡包埋,制备3 μm 层厚脑组织切片,行HE 染色、免疫组织化学染色和特殊染色。

(图2 光学显微镜观察所见HE 染色2a 肿瘤组织呈弥漫浸润性生长,由较一致的呈片状排列的中等大小肿瘤细胞组成×200 2b 肿瘤细胞胞核呈规则圆形,染色质呈“椒盐“样,可见典型神经毡× 400)
(2)HE染色:肿瘤组织呈弥漫浸润性生长,由较一致的呈片状排列的中等大小肿瘤细胞组成(图2a),具有圆形胞核和“ 椒盐”样染色质,伴少量胞质,局灶细胞增生活跃,部分区域可见神经毡背景(图2b),薄壁毛细血管呈“树枝”状。
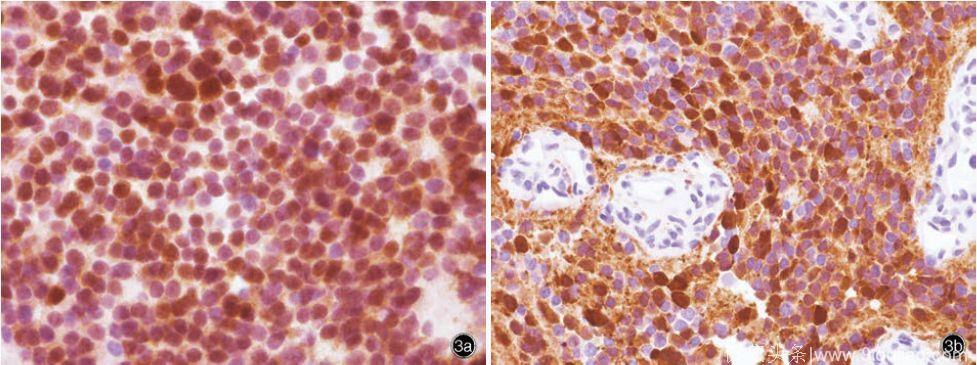

(图3 光学显微镜观察所见免疫组织化学染色(EnVision 二步法) × 400 3a 肿瘤细胞胞核NeuN 呈弥漫性强阳性3b 肿瘤细胞胞核和胞质CR 呈强阳性3c 肿瘤细胞胞核TTF⁃1呈中等至强阳性3d 肿瘤细胞胞质Syn呈阳性)
(3)免疫组织化学染色:采用EnVision 二步法,检测用试剂盒购自丹麦Dako 公司,检测用抗体主要包括神经元核抗原(NeuN)、钙视网膜蛋白(CR)、突触素(Syn)、甲状腺转录因子⁃1(TTF⁃1,克隆号:SPT24)、嗜铬素A(CgA)、上皮钙黏素(E⁃cadherin)、基质金属蛋白酶⁃9(MMP⁃9)、神经微丝蛋白(NF)、细胞角蛋白8(CK8)、波形蛋白(Vim)、S⁃100 蛋白(S⁃100)、上皮膜抗原(EMA)、少突胶质细胞转录因子2(Olig⁃2)、胶质纤维酸性蛋白(GFAP)、下丘脑⁃垂体激素和Ki⁃67 抗原,均购自丹麦Dako 公司。结果显示,肿瘤细胞胞核表达NeuN(图3a)、CR(图3b)和TTF⁃1(图3c),胞质表达CR(图3b)、Syn(图3d)、CgA、E⁃cadherin 和MMP⁃9,胞核局灶性表达S⁃100,胞质局灶性表达NF、CK8 和Vim;不表达EMA、Olig⁃2、GFAP 和下丘脑⁃垂体激素;Ki⁃67 抗原标记指数约为3%。
(4)特殊染色:采用福建医科大学附属第一医院病理科自行制备的Gomori 银氨溶液进行网织纤维染色,肿瘤细胞间网织纤维染色呈阴性。
(5)基因检测:采用Sanger 测序检测异柠檬酸脱氢酶(IDH)基因,上下游引物和检测用试剂盒为福建医科大学附属第一医院分子病理实验室自行制备,采用荧光原位杂交(FISH)检测1 号染色体短臂和19 号染色体长臂(1p/19q)状态,检测用试剂盒购自美国Abbott 公司。结果显示,肿瘤细胞无IDH 基因突变,无1p/19q⁃缺失。结合免疫组织化学染色、特殊染色和基因检测结果,最终病理诊断为脑室外神经细胞瘤(WHOⅡ级)。患者共住院8 d,术后予醋酸去氨加压素片(0.05 mg/8 h)和尼莫地平(20 mg/次、3 次/d)口服,连续7 d。出院时未诉头痛、头晕,自觉视力提高。术后随访14 个月,肿瘤无复发。
讨论
神经细胞瘤源于具有双重分化潜能的神经胶质祖细胞,向神经元和星形胶质细胞分化[1]。中枢神经细胞瘤由Hassoun 于1982 年命名[1],占所有中枢神经系统肿瘤的0.1% ~ 0.5%[2,4],并被1993 年世界卫生组织(WHO)中枢神经系统肿瘤分类第2版收录[1]。中枢神经细胞瘤可发生于任何年龄段,好发生于30 余岁青壮年[2],也可发生于儿童[8];主要发生于脑室系统,尤其是透明隔、第三脑室和侧脑室[2],也可发生于脑室系统以外[2]。脑室外神经细胞瘤已作为一种新的独立疾病于2007 年纳入WHO中枢神经系统肿瘤分类第4 版,属WHOⅡ 级[9],预后较好[4]。脑室外神经细胞瘤好发于儿童和青壮年,中位发病年龄为34 岁[2],无明显性别差异[10],亦有文献报道男性稍多发[9],还可发生于大脑半球、丘脑、小脑、脑桥、杏仁核、松果体、下丘脑[11]、视网膜和脊髓等部位[2],发生于鞍区和鞍上者极为少见。

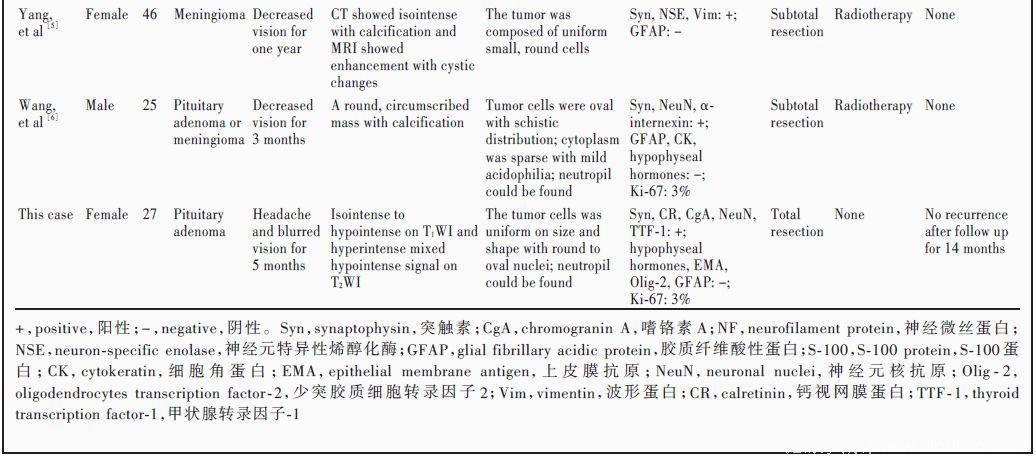
结合文献,分析并总结所报道的6 例鞍区和鞍上脑室外神经细胞瘤患者的临床特点(表1),其中视力下降是其共同特点[1⁃6],本文患者即表现为视力下降。其中1 例还出现间歇性头痛[3],与本文患者相似。除以上临床症状外,发生于鞍区和鞍上的脑室外神经细胞瘤无其他阳性体征,内分泌功能测定除个别患者催乳素(PRL)轻度升高、雌激素轻度下降外,余下丘脑⁃垂体激素均于正常值范围[1⁃6]。本文患者黄体生成素LH)、卵泡刺激素(FSH)、生长激素(GH)、促肾上腺皮质激素(ACTH)等均于正常值范围。
脑室外神经细胞瘤在MRI 上表现为界限清晰、囊性或不均匀的实性肿物,累及大脑半球白质或灰质[5],伴或不伴钙化,可见瘤周水肿,偶可见瘤内出血[2,12],T1WI 呈等或稍低信号,T2WI 呈等信号,增强扫描病灶呈或不呈强化征象[1⁃2]。Yi等[13]对10 例存在IDH1 基因突变的脑室外神经细胞瘤患者进行MRI研究,肿瘤组织可见囊性变和钙化,但几乎未见瘤周水肿和瘤内出血。
结合文献,对包括本文患者在内的7 例鞍区和鞍上脑室外神经细胞瘤患者的影像学资料进行分析和总结,头部CT 可见鞍区和鞍上呈等或稍高密度影,伴或不伴钙化;MRI 表现为T1WI呈低或等信号,T2WI呈低、等或高信号,增强扫描病灶可见强化征象。
鞍区和鞍上脑室外神经细胞瘤的组织学形态特征与中枢神经细胞瘤相似,表现为形态一致的圆形细胞[9],胞质少至中等,胞核形态规则,呈圆形或卵圆形,染色质呈“椒盐”样[2,14],核分裂象罕见或未见[9],背景中可见纤细的神经毡样物质[6,14],薄壁毛细血管呈“树枝”状[2]。非典型脑室外神经细胞瘤的组织学形态特征为Ki⁃67 抗原标记指数> 2%或>3%[15⁃16],伴或不伴非典型组织学形态特征,如灶性坏死、血管增生和分裂活性增加,具有较强的侵袭性,预后较差,复发率较高[9,14]。但非典型脑室外神经细胞瘤未被2016 版WHO 中枢神经系统肿瘤分类收录[9]。免疫组织化学染色对脑室外神经细胞瘤的诊断与鉴别诊断极为重要。有50% ~ 60%的脑室外神经细胞瘤患者可有神经节细胞或胶质细胞分化,与中枢神经细胞瘤有所不同[14]。神经元标志物Syn、CgA、神经元特异性烯醇化酶(NSE)、CD56、NeuN 和NF 呈阳性,而GFAP、Olig⁃2、S⁃100、巢蛋白(Nes)、EMA 和下丘脑⁃垂体激素呈阴性[1⁃6],P53 亦呈阴性。脑室外神经细胞瘤的分子遗传学特征为无1p/19q⁃共缺失,O6⁃甲基鸟嘌呤⁃DNA 甲基转移酶(MGMT)启动子甲基化和表皮生长因子受体(EGFR)基因扩增频率低[2]。亦有研究显示,部分脑室外神经细胞瘤存在1p/19q⁃共缺失[17]。本文患者免疫组织化学染色结果与文献报道相似,但胞核弥漫性强阳性表达TTF⁃1,尚未见诸报道。Kristensen等[18]对中枢神经系统肿瘤TTF⁃1 免疫组织化学染色进行研究,发现仅少部分肿瘤中呈阳性表达,3 例中枢神经细胞瘤患者中1 例弥漫性中度表达TTF⁃1。
神经系统发育过程中,TTF⁃1 表达局限于端脑和间脑区域细胞,包括下丘脑神经元、第三脑室室管膜细胞、伸长细胞和垂体后叶胶质细胞[18],但不表达于不成熟的大脑皮质或侧脑室[19]。脑组织中TTF⁃1分子靶点作用是上调中间丝巢蛋白、少突胶质细胞瘤特化、中间神经元迁移、GH 和PRL 转录、脉络丛水通道蛋白1(AQP1)合成的基因表达[18],但中枢神经细胞瘤表达TTF⁃1的机制尚待进一步阐述。
鞍区和鞍上脑室外神经细胞瘤应注意与以下肿瘤相鉴别。(1)垂体腺瘤:鞍区和鞍上脑室外神经细胞瘤在影像学上常误诊为垂体腺瘤,但免疫组织化学染色LH、FSH、GH、PRL、ACTH 和TSH 呈阴性可以排除诊断。(2)少突胶质细胞瘤:脑室外神经细胞瘤与少突胶质细胞瘤均具有圆形一致的胞核和透亮胞质,但神经节细胞分化提示脑室外神经细胞瘤[14],且少突胶质细胞瘤更具侵袭性,常呈浸润性生长,Syn 呈阴性[20],虽有时可呈阳性,但程度低于脑室外神经细胞瘤[14]。IDH 基因突变和1p/19q⁃共缺失最具鉴别诊断价值。(3)透明细胞型室管膜瘤:组织学形态可见血管周围假“菊形团”样结构,GFAP和EMA 呈阳性[21]。其他鉴别诊断还包括胚胎发育不良性神经上皮肿瘤(DNT)和松果体瘤等[1]。
手术全切除肿瘤是脑室外神经细胞瘤的首选治疗方法[22],预后较好[10]。由于发生于鞍区和鞍上的脑室外神经细胞瘤多侵犯蝶窦和海绵窦,并常压迫视神经、紧邻或包裹颈内动脉,故全切除较为困难,常采用次全切除[1,3⁃6]。对于次全切除的鞍区和鞍上脑室外神经细胞瘤,术后辅助放射治疗可以提高疾病控制率和患者生存率[2]。Peng等[2]对次全切除的脑室外神经细胞瘤患者术后辅以药物化疗并取得显著治疗效果。然而目前药物化疗在该肿瘤治疗中的经验仍不足,尚待更多临床实践和经验加以证实。本文患者手术全切除肿瘤,术后未辅以放射治疗和药物化疗,术后共随访14 个月,未见肿瘤复发。
综上所述,鞍区和鞍上脑室外神经细胞瘤是临床极罕见肿瘤,临床主要表现为视力减退和头痛,组织学形态特征为弥漫性生长且形态较一致的细胞,胞核圆形或卵圆形,染色质呈细颗粒状,常有特征性神经毡背景,肿瘤内血管为薄壁毛细血管,核分裂象罕见,与垂体腺瘤、少突胶质细胞瘤、透明细胞型室管膜瘤等有相似之处,应注意鉴别诊断。手术全切除肿瘤为首选治疗方法,预后较好,次全切除者可术后辅以放射治疗并长期随访。
参考文献
[1]Wang YY, Kearney T, du Plessis D, Gnanalingham KK.Extraventricular neurocytoma of the sellar region. Br J Neurosurg, 2012, 26:420⁃422.
[2]Peng P, Chen F, Zhou D, Liu H, Li J. Neurocytoma of the pituitary gland: a case report and literature review. Biomed Rep, 2015, 3:301⁃303.
[3]Wang Y, Tao R, Liu B. Response to: extraventricular neurocytoma of the sellar region. Br J Neurosurg, 2013, 27:551⁃552.
[4]Kawaji H, Saito O, Amano S, Kasahara M, Baba S, Namba H.Extraventricular neurocytoma of the sellar region with spinal dissemination. Brain Tumor Pathol, 2014, 31:51⁃56.
[5]Yang GF, Wu SY, Zhang LJ, Lu GM, Tian W, Shah K. Imaging findings of extraventricular neurocytoma: report of 3 cases and review of the literature. AJNR Am J Neuroradiol, 2009, 30:581⁃585.
[6]Wang J, Song DL, Deng L, Sun SY, Liu C, Gong DS, Wang Y, Xu QW. Extraventricular neurocytoma of the sellar region: case report and literature review. Springerplus, 2016, 5:987.
[7]Chen SY, Ji N, Wang JM, Wang B, Yu SQ, Wang JS. A case of extraventricular neurocytoma of the sellar region and literature review. Zhonghua Shen Jing Wai Ke Za Zhi, 2013, 29:1272 ⁃1274.[陈思源, 季楠, 王军梅, 王博, 于书卿, 王集生. 鞍区脑 室外中枢神经细胞瘤一例并文献复习. 中华神经外科杂志,2013, 29:1272⁃1274.]
[8]Baishya BK, Singh RK, Dutta D, Hussain Z. Pediatric central neurocytoma: case report and review of literature. J Pediatr Neurosci, 2016, 11:348⁃350.
[9]Xu L, Ouyang Z, Wang J, Liu Z, Fang J, Du J, He Y, Li G. A clinicopathologic study of extraventricular neurocytoma. J Neurooncol, 2017, 132:75⁃82.
[10]Ahmad Z, Din NU, Memon A, Tariq MU, Idrees R, Hasan S.Central, extraventricular and atypical neurocytomas: aclinicopathologic study of 35 cases from Pakistan plus adetailed review of the published literature. Asian Pac J CancerPrev, 2016, 17:1565⁃1570.
[11]Cho M, Joo JD, Kim BH, Choe G, Kim CY. Hypothalamic extraventricular neurocytoma (EVN) in a pediatric patient: acase of EVN treated with subtotal removal followed by adjuvant radiotherapy. Brain Tumor Res Treat, 2016, 4:35⁃39.
[12]Liu K, Wen G, Lv XF, Deng YJ, Deng YJ, Hou GQ, Zhang XL,Han LJ, Ding JL. MR imaging of cerebral extraventricular neurocytoma: a report of 9 cases. AJNR Am J Neuroradiol,2013, 34:541⁃546.
[13]Yi KS, Sohn CH, Yun TJ, Choi SH, Kim JH, Han MH, Park CK, Park SH, Chang KH. MR imaging findings of extraventricular neurocytoma: aseries of ten patients confirmed by immunohistochemistry of IDH1 gene mutation. Acta Neurochir (Wien), 2012, 154:1973⁃1979.
[14]Patil AS, Menon G, Easwer HV, Nair S. Extraventricular neurocytoma, a comprehensive review. Acta Neurochir (Wien),2014, 156:349⁃354.
[15]Mackenzie IR. Central neurocytoma: histologic atypia,proliferation potential, and clinical outcome. Cancer, 1999, 85:1606⁃1610.
[16]Söylemezoglu F, Scheithauer BW, Esteve J, Kleihues P.Atypical central neurocytoma. J Neuropathol Exp Neurol, 1997,56:551⁃556.
[17]Nabavizadeh SA, Chawla S, Baccon J, Zhang PJ, Poptani H,Melhem ER, Vossough A. Extraventricular neurocytoma and ganglioneurocytoma: advanced MR imaging, histopathological,and chromosomal findings. J Neuroimaging, 2014, 24:613⁃616.
[18]Kristensen MH, Nielsen S, Vyberg M. Thyroid tranion factor ⁃ 1 in primary CNS tumors. Appl Immunohistochem Mol Morphol, 2011,19:437⁃443.
[19]Ordóñez NG. Value of thyroid tranion factor ⁃ 1 immunostaining in tumor diagnosis: a review and update. Appl Immunohistochem Mol Morphol, 2012, 20:429⁃444.
[20]Feng R, Hu J, Wu J, Lang L, Wang B, Bi H, Gu X, Guo J, Pan L. Mesial temporal extraventricular neurocytoma: a rare cause of refractory complex partial seizure. Epileptic Disord, 2014, 16:125⁃131.
[21]Gokhan GA, Gurer IE, Akyuz M, Tuncer R. A case of extraventricular neurocytoma of the spinal cord.Neuropathology, 2008, 28:322⁃325.
[22]Sakurada K, Akasaka M, Kuchiki H, Saino M, Mori W, Sato S,Nakazato Y, Kayama T. A rare case of extraventricular neurocytoma. Brain Tumor Pathol, 2007, 24:19⁃23.
主要作者简介

王行富,福建医科大学附属第一医院病理科,副主任医师。现任中华医学会病理学分会脑神经病理学组委员,参与编写《2015年中国胶质瘤诊断与治疗指南》《肿瘤病理诊断规范-胶质瘤病理诊断规范》