艾伯维 risankizumab 治疗活动性银屑病关节炎 III 期研究成功
1月6日,艾伯维宣布,其白细胞介素-23 (IL-23)抑制剂 risankizumab (SKYRIZI)治疗成人活动性银屑病关节炎的2项III期临床研究获积极结果。
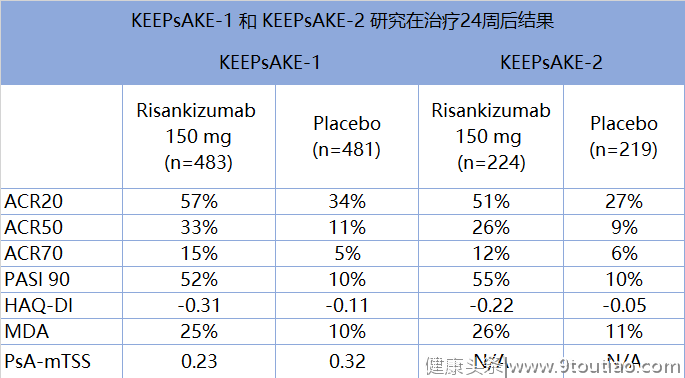
KEEPsAKE-1研究评估了 risankizumab单药治疗对至少一种DMARD(传统缓解病情抗风湿药)反应不充分或不耐受的患者活动性银屑病关节炎疗效。KEEPsAKE-2研究评估了 risankizumab单药治疗对生物制剂和/或DMARDs反应不充分或不耐受患者活动性银屑病关节炎疗效。受试者被随机分为 risankizumab(150mg)组和安慰剂组接受治疗24周。2项研究主要疗效终点均为第24周时达到ACR20(疾病严重程度较基线至少改善20%)受试者比例。次要终点包括HAQ-DI(健康评估问卷残疾指数)较基线变化值,第24周时PASI 90(银屑病面积和严重程度指数至少下降90%)受试者比例、MDA(最小疾病活动度)、PsA-mTSS(PsA患者的放射影像学进展)。
研究结果表明,risankizumab150mg治疗组第24周达到ACR20缓解患者比例显著高于安慰剂组。KEEPsAKE-1研究中,安慰剂组和 risankizumab组第24周达到ACR20缓解患者比例分别为57%和34%;而KEEPsAKE-2研究中这一比例分别为51%和27%(p<0.001)。此外, risankizumab组患者在皮肤症状(用PASI 90测量)、身体功能(使用HAQ-DI问卷调查)、最小疾病活动度(MDA)等多个次要研究终点方面较安慰剂组有显著改善。
Risankizumab安全性与之前银屑病研究的安全性结果基本一致。KEEPsAKE-1和KEEPsAKE-2研究中,risankizumab组严重不良事件发生率分别为2.5%和4.0%,而安慰剂组为3.7%和5.5%。两项研究中因risankizumab不良反应而导致停药患者比例分别为0.8%和0.9%,而安慰剂组为0.8%和2.3%。
Rrisankizumab最初由勃林格殷格翰研制,艾伯维于2016年2月支付一笔6亿美元的预付款获得了risankizumab的全球商业化权利。risankizumab最早于2019年3月首次在日本上市,用于治疗对常规疗法响应不足的成人寻常型银屑病、脓疱型银屑病、红皮型银屑病和关节病型银屑病,次月相继在美国和欧盟获批。
Risankizumab目前在国内处于III期临床研究阶段,由医药魔方数据库可知,艾伯维已在国内登记7项临床研究,分别用于治疗成人活动性银屑病关节炎,16岁及以上青少年和成人中重度溃疡性结肠炎、克罗恩病。
银屑病关节炎是一种异质性全身炎症性疾病,在机体包括关节和皮肤在内的多个部位都有明显的表现,免疫系统产生的炎症会导致患者关节疼痛,疲劳,僵硬,并引起红色鳞屑皮疹。