治疗支气管哮喘和慢阻肺(COPD)的新型抗嗜酸性粒细胞药物

简介《治疗哮喘和慢阻肺的新型抗嗜酸性粒细胞药物》
摘要:哮喘和慢性阻塞性气道疾病(COPD)是慢性炎性气道疾病,它们直接导致全球巨大的医疗卫生支出。这两种疾病都是复杂且异质性的,目前越来越多的学者认为这两种疾病存在重叠,而且可能存在类似的病理生理机制及治疗方案。靶向嗜酸性粒细胞的治疗是目前针对慢性气道炎症疾病最有影响力的治疗策略。过去几十年已经有单克隆抗体,小分子化合物等治疗被研制出,其中包括抗IL-5(或IL-5α受体)、IL-13、IL-4α受体、IgE、胸腺基质淋巴生成素(TSLP)单克隆抗体,以及小分子化合物如前列素D2阻滞剂。这些生物制剂在伴有嗜酸性粒细胞浸润的哮喘及COPD患者显示出较好的结果,但是并不是所有患者均能从中获益,尽管这些患者可能具有相似的临床及气道炎症特征。这种治疗反应的异质性可能与不同的分子机制、疾病内型导致的嗜酸性粒细胞气道炎症有关,包括由T辅助2型细胞(Th2)细胞介导的适应性免疫途径,以及先天性淋巴样介导的先天免疫途径。这些途径在哮喘和COPD中的相对贡献尚未得到澄清,目前还没有代表不同途径的可靠生物标志物。因此,迫切需要易于测量和可重复的生物标志物,其与潜在的病理生理学疾病机制相关联,并且可以预测和监测对新生物制剂的反应。
哮喘和慢性阻塞性气道疾病(COPD)是常见的慢性炎性气道疾病,造成全球巨大的疾病负担[1]。哮喘和COPD都是复杂和异质的,并且越来越多地被认为是可能呈现相似症状并且具有类似病理机制的重叠[2]。由于这种复杂的异质性,尽管存在有效的治疗,哮喘和COPD的治疗仍然在很大一部分患者中造成重大的健康问题。这就是为什么学者提出了针对个人特征的个体化治疗方案[3]。而不是使用目前的指南中所倡导的“一刀切”的方法,而是将目标关键机制看作更为合适,特别是对初始治疗反应不佳的患者[4]。
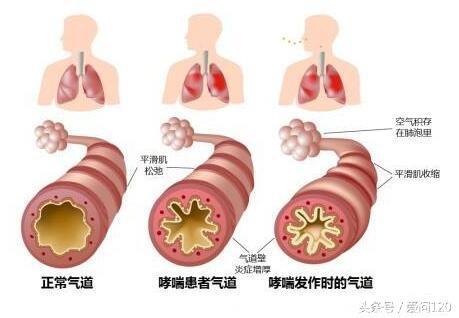
嗜酸性粒细胞浸润是慢性气道炎症最重要的特征之一。通过使用嗜酸性粒细胞气道炎症标志物对患者进行分层,可以鉴定患有不良结局和治疗风险的患者[5]。由嗜酸性粒细胞气道炎症标志物引导治疗可有更好的治疗效果[6]。然而,许多患者,特别是严重疾病的患者,具有持续的嗜酸性粒细胞性气道炎症[7]。这些患者经常加重,往往取决于长期使用口服皮质类固醇并引起严重的不良反应[8]。所以,靶向嗜酸性粒细胞型气道炎症一直是近期新药开发的基础。目前已有几种抗嗜酸性药物被批准用于哮喘,并且目前越来越多证据显示COPD患者也能从中获益[9]。在下文中,我们将讨论嗜酸性粒细胞在哮喘和COPD中的病理生物学作用,以及抗嗜酸性粒细胞药物在治疗有效及无效患者中的作用。
嗜酸性粒细胞起源于骨髓中常见的骨髓祖细胞。嗜酸性粒细胞祖细胞的成熟在很大程度上取决于细胞因子如白介素(IL)-3,IL-5和粒细胞巨噬细胞集落刺激因子(GM-CSF)。在这些细胞因子中,IL-5对于嗜酸性粒细胞增殖,分化和激活是最关键的[10]。一般情况下,嗜酸性粒细胞构成只占总白细胞池的1-2%。它们的生理作用是多方面的,尚未完全了解。传统上认为在抵御蠕虫寄生虫感染方面具有稳态作用,这些细胞现在已知会有助于天然和适应性免疫反应和组织修复过程的多个阶段。在嗜酸粒细胞肺疾病(包括哮喘)中,嗜酸性粒细胞在血液和组织中增加,嗜酸性粒细胞增多症通常与疾病严重程度相关[11]。嗜酸性粒细胞在痰液和血液中的百分比升高哮喘与频繁加重和气流受限有关,死于哮喘的患者常伴有严重的嗜酸粒细胞性气道浸润[12]。有研究证据表明,嗜酸性粒细胞在哮喘的发病机制和严重程度中发挥关键作用来自抗嗜酸性粒细胞药物的研究,哮喘急性发作的显著减少,以及减少慢性口服皮质类固醇在严重疾病患者亚群中的使用[13]。在COPD中,气道炎症主要表现为嗜中性粒细胞,但是在稳定期和急性加重期间,30-40%的COPD患者可观察到痰嗜酸性粒细胞百分比增加[14,15]。嗜酸性粒细胞在COPD中的致病作用不如哮喘明显,但已显示痰液或血液中嗜酸性粒细胞计数的增加预测了吸入和口服皮质类固醇的临床反应[14,16]。COPD中嗜酸粒细胞性气道炎症与加重的风险增加有关,近期证据显示,严重COPD急性加重患者的血液嗜酸性粒细胞升高与再入院率增加有关[17]。此外,旨在减少COPD患者嗜酸粒细胞性气道炎症的管理策略已显示将严重恶化减少62%[18]。关于嗜酸性粒细胞在COPD发病机制中的重要性的明确答案主要来自正在进行的抗嗜酸性粒细胞药物的大量干预研究。
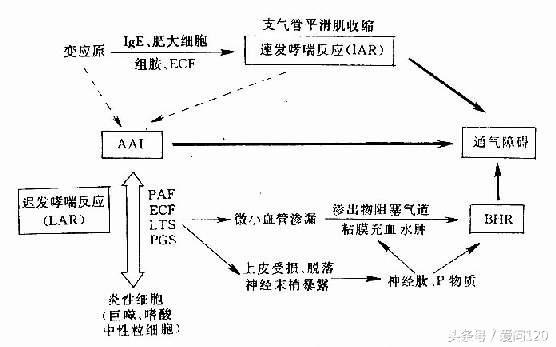
不同的分子机制可能导致慢性气道疾病患者的嗜酸细胞性气道炎症[19,20]。气道上皮细胞暴露于破坏性因素诸如过敏原,病毒,真菌和污染物等会释放“警报素”细胞因子(IL-33,IL-25和胸腺基质淋巴细胞(TSLP))。一方面,这些警报素可以通过树突状细胞启动适应性免疫应答,从而刺激幼稚T细胞分化成2型辅助T细胞(Th2)细胞。Th2细胞产生IL-5,IL-13和IL-4,后者驱动B细胞的免疫球蛋白E(IgE)合成。另一方面,警报素还可以通过刺激2型先天性淋巴样细胞(ILC2)来激活固有免疫系统,同时ILC2能够产生大量Th2型细胞因子如IL-5和IL-13,但ILC2不能分泌IL-4。已提出的Th2介导的途径是过敏性哮喘的典型,而先天性ILC2介导的途径可能是非特异性或“内在”哮喘中嗜酸性粒细胞气道炎症的关键机制,其中IgE似乎不起作用。适应性和先天免疫反应可能导致嗜酸粒细胞炎症的概念也可以解释为什么一些COPD患者痰液和血液中的嗜酸性粒细胞水平升高。然而,这些途径对不同组的气道疾病患者的相对贡献尚未完全清楚。
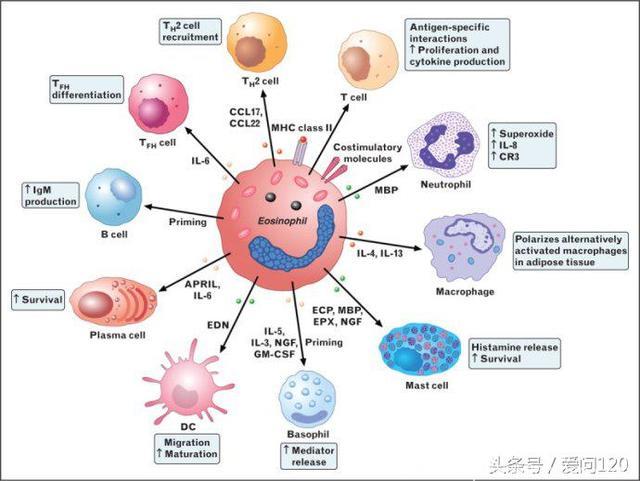
在过去十年中,已经开发出几种单克隆抗体和小分子化合物用于治疗嗜酸性或“2型”气道疾病,并且正在逐渐进入临床。在2015年和2016年,两种针对IL-5,美泊利单抗和雷替珠单抗的抗体被批准用于严重嗜酸性粒细胞性哮喘患者的附加治疗,并且在接下来的几年还会出现其他靶向药物[21,22]。在这里,我们将简要讨论已经开发的不同的抗嗜酸性药物及其对“2型”气道疾病患者的影响。
抗IL-5 /抗IL-5Rα靶向IL-5或IL-5α受体途径是选择性抑制嗜酸细胞性气道炎症的最明显的方法,因为IL-5被认为是负责嗜酸性粒细胞的募集,成熟,活化和脱颗粒的关键细胞因子。
美泊利单抗
美泊利单抗是针对循环IL-5的人源化单克隆抗体[23]。该抗体通过抑制IL-5与嗜酸性粒细胞上表达的IL-5受体(IL-5Rα)的α链的结合来中和IL-5。它显著地减少血液中的嗜酸性粒细胞,稍减少组织中的嗜酸性粒细胞。尽管美泊利单抗在哮喘首次试验令人失望[24],但随后在严重嗜酸粒细胞性哮喘患者中的两项研究均获得成功。一项研究表明,与安慰剂相比,年化加重率显着降低43%[25],而另外一项研究则表明美泊利单抗可以减少类固醇依赖性哮喘患者的激素用量[26]。这些有前景的结果在大型III期临床试验中得到重现,其方案为每4周皮下注射100mg美泊利单抗[27-29]。美泊利单抗的有益效果与血液嗜酸性粒细胞水平和以往急性加重次数有关[27],并在停药后6个月内丧失[30]。目前,美泊利单抗在患有嗜酸粒细胞性气道炎症的COPD患者的三期III期临床试验中进行研究。
瑞利珠单抗
瑞利珠单抗是另一种中和IL-5的人源化单克隆抗体,从而阻止与嗜酸性粒细胞的结合。与美泊利单抗相类似,瑞利珠单抗未能在未选择性哮喘患者的早期研究中显示疗效[31],但在随后的研究中证明,对于伴有血嗜酸性粒细胞升高的未控制哮喘患者瑞利珠单抗是有效的[32]。在两项相同的大III期试验中,与安慰剂相比,静脉内给予瑞替珠单抗3 mg / kg治疗哮喘急性加重,可以明显改善肺功能指标和生活质量评分[33]。瑞利珠单抗在COPD中目前暂无研究。
贝那珠单抗(Benralizuamb)
贝那珠单抗是一种与IL-5Rα结合并快速的人源化单克隆抗体通过抗体依赖性细胞介导的细胞毒性消耗嗜酸性粒细胞和嗜碱性粒细胞[34]。在重症哮喘和高嗜酸性粒细胞患者的IIb期研究中每8周皮下注射100mg贝那珠单抗降低41%的恶化率,并能改善肺功能和改善哮喘控制[35]。最近的两个关键三项研究证实了这些有益效果,并且还显示贝那珠单抗耐受性良好。在痰嗜酸性粒细胞增多合并频繁急性加重的COPD患者中使用贝那珠单抗的一项小型II期试验显示,贝那珠单抗可以改善肺功能,但不能降低急性加重频率。在血液嗜酸性粒细胞升高的患者中,急性加重频率和健康状况均有所改善。基于这些发现,COPD患者的两项III期临床试验正在进行中[36,37]。
奥马珠单抗
嗜酸粒细胞炎症也可以通过阻断IgE的作用而间接抑制。奥马珠单抗,针对IgE的单克隆抗体已经在2003年被批准用于过敏相关性哮喘。研究显示,奥马珠单抗可减少患有严重过敏性哮喘患者的血液嗜酸性粒细胞[39],而在荟萃分析中,血液嗜酸性粒细胞计数的减少与临床结果改善有关[40]。奥马珠单抗临床试验的Cochrane综述显示,它可减少急诊及住院就诊频率[41],目前的指南主张在严重哮喘中使用奥马珠单抗作为附加治疗。最近的证据表明奥马珠单抗也有改善患有哮喘COPD重叠患者的哮喘控制和生活质量[42]。
抗IL-13和抗-IL-4Rα
IL-4和IL-13被认为是2型炎症重要驱动因子的细胞因子。两种细胞因子均由Th2细胞产生,而仅IL13由ILC2产生。IL-4和IL-13活性之间存在着密切联系,因为这两者都激活了IL-4受体(IL-4Rα)的α亚基。然而,IL-4优先调节Th2细胞功能和IgE合成,而IL-13介导哮喘的主要生理特征,包括粘液分泌过多,上皮下纤维化和气道高反应性。IL-13诱导许多趋化因子,导致炎性气道组织中嗜酸性粒细胞的募集和浸润。
雷贝瑞珠单抗 和 Tralokinumab
雷贝瑞珠单抗是针对IL-13的单克隆抗体,在III期临床试验中,中度重度非控制性哮喘患者的肺功能改善程度有所改善,并且发生急性发作率下降。并且2型生物标志物升高的患者(血清骨膜素和呼出一氧化氮(FeNO)的比例)FEV1改善更大。然而,另一项相同的III期试验未能显著减轻哮喘急性发作[43],导致最终试验的终止。Tralokinumab,另一种针对IL-13的抗体,可降低β-激动剂的使用并能改善FEV1[44]。Tralokinumab治疗重度哮喘急性加重患者的大型IIb期试验显示,其与安慰剂相比,不能减少急性发作频率[45]。然而,同样在这项研究中,对于高骨膜素水平的患者,Tralokinumab显示可减少哮喘急性发作频率并能改善肺功能水平。Tralokinumab的III期试验目前正在进行。
Dupilumab是针对IL-4受体的α亚单位的人单克隆抗体,其阻断可IL-4和IL-13的信号传导。在Dupilumab IIb期的研究中,每2周皮下注射Dupilumab一次,可改善肺功能,减少未控制哮喘患者的急性发作,即使血嗜酸性粒细胞水平低的哮喘患者也可获益[46]。目前,临床III期试验中,Dupilumab作为对于使用中高剂量吸入性皮质类固醇联合控制性药物治疗成人和青少年持续哮喘的补充方案,使用人群还包括重度未控制和类固醇依赖性哮喘患者。有趣的是,抗IL-13和抗IL-4Rα可短暂增加血液嗜酸性粒细胞计数,对此目前尚无确切解释。
抗-CRTH2
在Th2细胞(CRTH2)上表达的趋化因子受体同源分子也在嗜酸性粒细胞上表达,并介导对前列腺素D2的趋化反应。多种CRTH2小分子拮抗剂已经在II期研究中。PGD2抑制剂可显著改善伴有嗜酸性粒细胞浸润的轻中度哮喘患者的症状。另一项CRTH2抑制剂的试验显示,抗-CRTH2治疗可减少哮喘患者诱导痰嗜酸性粒细胞数量并能改善哮喘症状[47]。CRTH2小分子拮抗剂的III期试验目前正在进行。
研究显示,中重度COPD患者使用CRTH2拮抗剂不能获益,但是该研究未选取伴有嗜酸性粒细胞增多的COPD患者[48]。
抗IL-33,抗IL-25和抗TSLP
IL-33,IL-25和TSLP是由气道上皮细胞受到各种有害的环境刺激释放的警报素因子,,其通过ILC2和Th2途径导致嗜酸性粒细胞浸润。阻断TSLP的单克隆抗体Tezepelumab已被证明可以防止过敏原的攻击,并减少哮喘患者的气道嗜酸性粒细胞增多[49]。其他针对报警细胞因子的II期临床试验正在进行中。伴有嗜酸性粒细胞炎症的COPD患者是否能从这类药物获益目前仍未有报道。
如何精确靶向2型/嗜酸性气道炎症?尽管上述生物制剂的试验在特定的嗜酸粒细胞性哮喘和COPD患者中显示出有前景的结果,但是不是所有患者对这些药物的反应同样良好。然而,对于临床医师,重要的是要知道哪个患者将从哪个生物学受益最多,以便作出正确的治疗决定。这就是为什么研究人员试图确定可以预测治疗反应的2型生物标志物,并帮助指导哮喘和COPD患者的治疗。在呼出气和血液中的许多潜在生物标志物研究中,迄今为止,只有少数已被证明是可用于临床实践的,其包括呼出一氧化氮(FeNO),血嗜酸性粒细胞计数和血清骨膜素。对于监测抗IgE的治疗反应,所有三种生物标志物,特别是FeNO显示出潜在的提示预后的作用[50]。对于抗IL-5治疗,血嗜酸性粒细胞计数似乎是对治疗反应的最佳预测因子,特别是成人哮喘患者及COPD患者。对于抗IL-13和抗IL-4Ra治疗,高水平的骨膜素或FeNO有助于筛选出可能获益的患者,尽管最近试验的结果在这方面是不一致的。总体而言,仍然有很大的不确定性,最终的结论来自慢性气道疾病患者异质性组的大量前瞻性研究。
引申除了嗜酸粒细胞性哮喘之外,已经研究了抗嗜酸性粒细胞药物用于治疗嗜酸性粒细胞增多症的许多其它嗜酸性粒细胞相关病症如特应性皮炎,慢性荨麻疹和鼻息肉病综合征。对于慢性荨麻疹的治疗,奥马珠单抗在2014年获得FDA批准,用于特应性皮炎IL-4Ra阻断剂dupilumab最近被FDA提交审查。但是,目前没有一种新的抗嗜酸性粒细胞药物尚未被批准用于治疗其他嗜酸粒细胞性疾病。
总结嗜酸细胞性气道炎症是慢性气道疾病(包括哮喘和COPD)患者的关键“可治疗性状”。对于激素不敏感哮喘患者,已开发出新的单克隆抗体或小分子疗法,其中已有一部分已经进入临床。这些药物已显示可以减少哮喘急性发作频率,并能减少部分患者口服皮质类固醇的量。不幸的是,对于临床医生来说,尚不清楚哪些患者会对哪些生物制剂作出反应。到目前为止,似乎抗IL-5在患有高血嗜酸粒细胞计数的患者中是最有效的,并且靶向IL-4Ra或IL-13的药物在具有高FeNO或骨膜素的患者中显示出良好的临床反应。在未来的几年中,我们的研究工作重点探索能可靠预测和监测治疗反应的生物标志物,并指导新型靶向治疗的发展。
参考文献
1. To T, Stanojevic S, Moores G, Gershon AS, Bateman ED, Cruz AA, Boulet LP. Global asthma prevalence in adults: findings from the cross-sectional world health survey. BMC Public Health. 2012 Mar 19;12:204.
2. Barnes PJ. Asthma-COPD Overlap. Chest. 2016 Jan;149(1):7-8.
3. Agusti A, Bel E, Thomas M, Vogelmeier C, Brusselle G, Holgate S, Humbert M,
Jones P, Gibson PG, Vestbo J, Beasley R, Pavord ID. Treatable traits: toward
precision medicine of chronic airway diseases. Eur Respir J. 2016 Feb;47(2):410-9.
4. Bush A, Kleinert S, Pavord ID. The asthmas in 2015 and beyond: a Lancet
Commission. Lancet. 2015 Apr 4;385(9975):1273-5.
5. Dweik RA, Sorkness RL, Wenzel S, Hammel J, Curran-Everett D, Comhair SA,
Bleecker E, Busse W, Calhoun WJ, Castro M, Chung KF, Israel E, Jarjour N, Moore
W, Peters S, Teague G, Gaston B, Erzurum SC; National Heart, Lung, and Blood
Institute Severe Asthma Research Program. Use of exhaled nitric oxide
measurement to identify a reactive, at-risk phenotype among patients with
asthma. Am J Respir Crit Care Med. 2010 May 15;181(10):1033-41.
6. Green RH, Brightling CE, McKenna S, Hargadon B, Parker D, Bradding P, Wardlaw AJ, Pavord ID. Asthma exacerbations and sputum eosinophil counts: a
randomizedcontrolledtrial.Lancet.2002Nov30;360(9347):1715-21.ACCEPTED 7. de Groot JC, Storm H, Amelink M, de Nijs SB, Eichhorn E, Reitsma BH, Bel EH, Ten Brinke A. Clinical profile of patients with adult-onset eosinophilic asthma. ERJ Open Res. 2016 May 26;2(2)
8. Sweeney J, Patterson CC, Menzies-Gow A, Niven RM, Mansur AH, Bucknall C,
Chaudhuri R, Price D, Brightling CE, Heaney LG; British Thoracic Society Difficult
Asthma Network. Comorbidity in severe asthma requiring systemic
corticosteroid therapy: cross-sectional data from the Optimum Patient
CareResearch Database and the British Thoracic Difficult Asthma Registry.
Thorax. 2016 Apr;71(4):339-46.
9. Nixon J, Newbold P, Mustelin T, Anderson GP, Kolbeck R. Monoclonal antibody
therapy for the treatment of asthma and chronic obstructive pulmonary disease
with eosinophilic inflammation. Pharmacol Ther. 2017 Jan;169:57-77.
10. Rosenberg HF, Dyer KD, Foster PS. Eosinophils: changing perspectives in health and disease. Nat Rev Immunol. 2013 Jan;13(1):9-22. Review.
11. Bochner BS, Gleich GJ. What targeting eosinophils has taught us about their role in diseases. J Allergy Clin Immunol. 2010 Jul;126(1):16-25;
12. de Magalhaes Simoes S, dos Santos MA, da Silva Oliveira M, Fontes ES, Fernezlian S, Garippo AL, Castro I, Castro FF, de Arruda Martins M, Saldiva PH, Mauad T, Dolhnikoff M. Inflammatory cell mapping of the respiratory tract in fatal asthma. Clin Exp Allergy. 2005 May;35(5):602-11.
13. Chung KF. Targeting the interleukin pathway in the treatment of asthma. Lancet. 2015 Sep 12;386(9998):1086-96. Review.
14. Leigh R, Pizzichini MM, Morris MM, Maltais F, Hargreave FE, Pizzichini E. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur Respir J. 2006 May;27(5):964-71.
15. Couillard S, Larivee P, Courteau J, Vanasse A. Eosinophils in COPD Exacerbations Are Associated With Increased Readmissions. Chest. 2017 Feb;151(2):366-373.
16. Brightling CE, Monteiro W, Ward R, Parker D, Morgan MD, Wardlaw AJ, Pavord ID. Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial. Lancet. 2000 Oct 28;356(9240):1480-5.
17. Bafadhel M, Greening NJ, Harvey-Dunstan TC, Williams JE, Morgan MD, Brightling CE, Hussain SF, Pavord ID, Singh SJ, Steiner MC. Blood Eosinophils and Outcomes in Severe Hospitalized Exacerbations of COPD. Chest. 2016 Aug;150(2):320-8.
18. Siva R, Green RH, Brightling CE, Shelley M, Hargadon B, McKenna S, Monteiro W, Berry M, Parker D, Wardlaw AJ, Pavord ID. Eosinophilic airway inflammation and exacerbations of COPD: a randomised controlled trial. Eur Respir J. 2007
May;29(5):906-13.
19. Brusselle GG, Maes T, Bracke KR. Eosinophils in the spotlight: Eosinophilic airway inflammation in nonallergic asthma. Nat Med. 2013 Aug;19(8):977-9.
20. Lambrecht BN, Hammad H. The immunology of asthma. Nat Immunol. 2015
Jan;16(1):45-56.
21. Keating GM. Mepolizumab: First Global Approval. Drugs. 2015 Dec;75(18):2163-9.
22.Markham A. Reslizumab: First Global Approval. Drugs. 2016 May;76(8):907-11.
23. Anonymous. Mepolizumab: 240563, anti-IL-5 monoclonal antibody -
GlaxoSmithKline, anti-interleukin-5 monoclonal antibody - GlaxoSmithKline, SB
240563. Drugs R D. 2008;9(2):125-30. Review.
24. Leckie MJ, ten Brinke A, Khan J, Diamant Z, O'Connor BJ, Walls CM, Mathur AK, Cowley HC, Chung KF, Djukanovic R, Hansel TT, Holgate ST, Sterk PJ, Barnes PJ.
Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway
hyper-responsiveness, and the late asthmatic response. Lancet. 2000 Dec 23-
30;356(9248):2144-8.
25. Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, Sousa A, Marshall RP, Bradding P, Green RH, Wardlaw AJ, Pavord ID. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009 Mar 5;360(10):973-84.
26. Nair P, Pizzichini MM, Kjarsgaard M, Inman MD, Efthimiadis A, Pizzichini E,
Hargreave FE, O'Byrne PM. Mepolizumab for prednisone-dependent asthma with
sputum eosinophilia. N Engl J Med. 2009 Mar 5;360(10):985-93.
27. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, Ortega H, Chanez P.Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, doubleblind, placebo-controlled trial. Lancet. 2012 Aug 18;380(9842):651-9.
28. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, Humbert M,Katz LE, Keene ON, Yancey SW, Chanez P; MENSA Investigators.. Mepolizumab
treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014 Sep
25;371(13):1198-207.
29. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, Ortega HG, Pavord ID; SIRIUS Investigators.. Oral glucocorticoid-sparing effect of
mepolizumab in eosinophilic asthma. N Engl J Med. 2014 Sep 25;371(13):1189-
97.
30. Haldar P, Brightling CE, Singapuri A, Hargadon B, Gupta S, Monteiro W, Bradding P, Green RH, Wardlaw AJ, Ortega H, Pavord ID. Outcomes after cessation of mepolizumab therapy in severe eosinophilic asthma: a 12-month follow-up analysis. J Allergy Clin Immunol. 2014 Mar;133(3):921-3.
31. Kips JC, O'Connor BJ, Langley SJ, Woodcock A, Kerstjens HA, Postma DS, Danzig M,Cuss F, Pauwels RA. Effect of SCH55700, a humanized anti-human interleukin-5 antibody, in severe persistent asthma: a pilot study. Am J Respir Crit Care Med. 2003 Jun 15;167(12):1655-9.
32. Castro M, Mathur S, Hargreave F, Boulet LP, Xie F, Young J, Wilkins HJ, Henkel T, Nair P; Res-5-0010 Study Group.. Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1125-32.
33. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, Murphy K, Maspero JF, O'Brien C, Korn S. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015 May;3(5):355-66.
34. Ghazi A, Trikha A, Calhoun WJ. Benralizumab--a humanized mAb to IL-5Rα with enhanced antibody-dependent cell-mediated cytotoxicity--a novel approach for the treatment of asthma. Expert Opin Biol Ther. 2012 Jan;12(1):113-8.
35. Castro M, Wenzel SE, Bleecker ER, Pizzichini E, Kuna P, Busse WW, Gossage DL, Ward CK, Wu Y, Wang B, Khatry DB, van der Merwe R, Kolbeck R, Molfino NA,
Raible DG. Benralizumab, an anti-interleukin 5 receptor α monoclonal antibody,
versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised
dose-ranging study. Lancet Respir Med. 2014 Nov;2(11):879-90.
36. Bleecker ER, FitzGerald JM, Chanez P, Papi A, Weinstein SF, Barker P, Sproule S, Gilmartin G, Aurivillius M, Werkstrom V, Goldman M; SIROCCO study
investigators.. Efficacy and safety of benralizumab for patients with severe
asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting
β(2)-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3
trial. Lancet. 2016 Oct 29;388(10056):2115-2127.
37. FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, Ferguson GT, Busse WW, Barker P, Sproule S, Gilmartin G, Werkstrom V, Aurivillius M,
Goldman M; CALIMA study investigators.. Benralizumab, an anti-interleukin-5
receptor α monoclonal antibody, as add-on treatment for patients with severe,
uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind,
placebo-controlled phase 3 trial. Lancet. 2016 Oct 29;388(10056):2128-2141.
38. Brightling CE, Bleecker ER, Panettieri RA Jr, Bafadhel M, She D, Ward CK, Xu X, Birrell C, van der Merwe R. Benralizumab for chronic obstructive pulmonary
disease and sputum eosinophilia: a randomised, double-blind, placebocontrolled,
phase 2a study. Lancet Respir Med. 2014 Nov;2(11):891-901.
39. Djukanović R, Wilson SJ, Kraft M, Jarjour NN, Steel M, Chung KF, Bao W, Fowler-Taylor A, Matthews J, Busse WW, Holgate ST, Fahy JV. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma. Am J Respir Crit Care Med. 2004 Sep 15;170(6):583-93.
40.Massanari M, Holgate ST, Busse WW, Jimenez P, Kianifard F, Zeldin R. Effect of
omalizumab on peripheral blood eosinophilia in allergic asthma. Respir Med.
2010 Feb;104(2):188-96.
41. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014 Jan 13;(1):CD003559.
42.Maltby S, Gibson PG, Powell H, McDonald VM. Omalizumab Treatment Response in a Population With Severe Allergic Asthma and Overlapping COPD. Chest. 2017 Jan;151(1):78-89.
43. Hanania NA, Noonan M, Corren J, Korenblat P, Zheng Y, Fischer SK, Cheu M,
Putnam WS, Murray E, Scheerens H, Holweg CT, Maciuca R, Gray S, Doyle R,
McClintock D, Olsson J, Matthews JG, Yen K. Lebrikizumab in moderate-to-severe
asthma: pooled data from two randomised placebo-controlled studies. Thorax.
2015 Aug;70(8):748-56.
44. Piper E, Brightling C, Niven R, Oh C, Faggioni R, Poon K, She D, Kell C, May RD,
Geba GP, Molfino NA. A phase II placebo-controlled study of tralokinumab in
moderate-to-severe asthma. Eur Respir J. 2013 Feb;41(2):330-8.
45. Brightling CE, Chanez P, Leigh R, O'Byrne PM, Korn S, She D, May RD, Streicher K, Ranade K, Piper E. Efficacy and safety of tralokinumab in patients with severe uncontrolled asthma: a randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respir Med. 2015 Sep;3(9):692-701.
46.Wenzel S, Castro M, Corren J, Maspero J, Wang L, Zhang B, Pirozzi G, Sutherland ER, Evans RR, Joish VN, Eckert L, Graham NM, Stahl N, Yancopoulos GD, Louis- Tisserand M, Teper A. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet. 2016 Jul 2;388(10039):31-44.
47. Gonem S, Berair R, Singapuri A, Hartley R, Laurencin MF, Bacher G, Holzhauer B, Bourne M, Mistry V, Pavord ID, Mansur AH, Wardlaw AJ, Siddiqui SH, Kay RA,
Brightling CE. Fevipiprant, a prostaglandin D2 receptor 2 antagonist, in patients
with persistent eosinophilic asthma: a single-centre, randomised, double-blind,
parallel-group, placebo-controlled trial. Lancet Respir Med. 2016 Sep;4(9):699-
707.
48. Snell N, Foster M, Vestbo J. Efficacy and safety of AZD1981, a CRTH2 receptor
antagonist, in patients with moderate to severe COPD. Respir Med. 2013
Nov;107(11):1722-30.
49. Gauvreau GM, O'Byrne PM, Boulet LP, Wang Y, Cockcroft D, Bigler J, FitzGeral JM, Boedigheimer M, Davis BE, Dias C, Gorski KS, Smith L, Bautista E, Comeau MR,
Leigh R, Parnes JR. Effects of an anti-TSLP antibody on allergen-induced
asthmatic responses. N Engl J Med. 2014 May 29;370(22):2102-10.
50. Hanania NA, Wenzel S, Rosen K, Hsieh HJ, Mosesova S, Choy DF, Lal P, Arron JR, Harris JM, Busse W. Exploring the effects of omalizumab in allergic asthma: an
analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013 Apr15;187(8):804-11.
(南京医科大学第一附属医院 张嘉祥 吉宁飞 黄茂)