「综述」中性粒细胞胞外陷阱是重症哮喘潜在的治疗靶标
文章来源:中华结核和呼吸杂志, 2020,43(11) : 958-962
DOI:10.3760/cma.j.cn112147-20200209-00067
作者:解立旭 葛林阳 陈子 周林福
单位:南京医科大学第一附属医院呼吸与危重症医学科
摘要
难治性哮喘(重症哮喘)仍是临床治疗的瓶颈。中性粒细胞募集和浸润参与重症哮喘和激素抵抗的发生发展。中性粒细胞胞外陷阱(NET)是中性粒细胞激活后释放到胞外的网状超微结构。现有证据表明,NET具有抗感染和促炎的双刃剑作用,与重症哮喘密切相关。靶向NET或NET组分有望成为治疗重症哮喘等中性粒细胞炎症性疾病的潜在靶标。
中性粒细胞胞外陷阱(neutrophil extracellular traps,NET)是中性粒细胞激活后释放到胞外的网状超微结构,在固有免疫和适应性免疫中起重要作用。NET最初被识别为一种新的抗菌机制。越来越多的研究发现,NET可介导自身组织超炎症病理改变[1]。目前,难治性哮喘(重症哮喘)仍是临床治疗的瓶颈。近来研究表明,重症哮喘患者体内高表达NET[2],而且NET与哮喘控制水平呈负相关[3]。对于糖皮质激素依赖或抵抗型重症哮喘患者,亟需深入探讨发病机制及其治疗策略。以NET或NET组分作为分子靶标,有望为治疗中性粒细胞炎症性疾病带来新的前景。本文将就NET生物学特性、NET在重症哮喘发病机制中的作用以及靶向NET治疗重症哮喘的价值做一综述。一、NET生物学特性
作为一种新型抗菌防御系统,NET可阻碍病原菌扩散[4]。不过,NET及组分对宿主细胞具有毒性作用,并能够激活自身免疫[1]。总的说来,NET是一把双刃剑,既可作为固有免疫的一道防线,也可体内蓄积并造成自身组织损伤。NET具有独特的超微结构,骨架由直径15~17 nm的染色质细丝组成,骨架上镶嵌直径约50 nm球状结构。染色质细丝由DNA和组蛋白组成。球状结构由中性粒细胞的初级和次级颗粒组成,例如中性粒细胞弹性蛋白酶(NE)、髓过氧化物酶(MPO)、组织蛋白酶G、蛋白酶3、α-防御素、乳铁蛋白。在三级颗粒中,NET包含基质金属蛋白酶9(MMP-9)和肽聚糖识别蛋白S。
NET形成是一个渐进式过程:(1)活性氧(reactive oxygen species,ROS)产生;(2)弹性蛋白酶和髓过氧化物酶转运至细胞核;(3)组蛋白修饰;(4)细胞质膜破裂和染色质释放。现认为,ROS在NET形成的信号通路中不可或缺[5]。慢性肉芽肿性疾病患者还原型辅酶Ⅱ(NADPH)过氧化酶亚基突变导致合成ROS障碍,患者中性粒细胞不能形成NET,于是出现反复感染[6]。在慢性肉芽肿性疾病患者的中性粒细胞中加入过氧化氢,即可恢复NET形成的能力。染色质修饰需要蛋白质精氨酸脱氨酶4(PAD4)驱动的组蛋白脱氨基或瓜氨酸化[7]NET形成意味着机体可能面临着某种问题(例如病原微生物入侵),此时NET发挥了积极作用。然而,NET及组分具有强烈的生物学效应。业已证实,NET参与呼吸系统多种疾病的发生发展,包括慢性阻塞性肺疾病(慢阻肺)、哮喘、急性肺损伤、肿瘤等[8]。稳定期慢阻肺患者NET与气流受限严重程度相关,急性加重期慢阻肺患者NET浓度与急性加重频率、FEV1[9]。NET能促进癌细胞附着血管壁,导致肿瘤迁移增强。NET还参与系统性红斑狼疮(SLE)、风湿性关节炎和血管炎等免疫性疾病的病理生理[10, 11, 12]二、重症哮喘发病机制及治疗现状
气道炎症、气道高反应性和气道重塑是哮喘显著的临床特征。采用吸入糖皮质激素(ICS)/长效β2受体激动剂(LABA)维持缓解策略,可使86.5%的哮喘患者实现临床控制[13]。约5%~10%哮喘患者即使长期应用ICS/LABA,仍出现不可逆性气流阻塞,需反复急诊就医和住院治疗。全球哮喘防治创议(GINA)将经过第4步治疗(缓解药物加2种或更多的控制药物)尚未达到可控制水平的哮喘,称为重症哮喘。重症哮喘急诊就医率和住院率分别为轻、中度哮喘的15倍和20倍。显然,亟需阐明重症哮喘的发病机制,并据此研发新的精准治疗方法。重症哮喘根据气道炎症病理表型,可分为嗜酸粒细胞型、中性粒细胞型和少炎症细胞型。其中,嗜酸粒细胞型主要缘于患者对糖皮质激素治疗不敏感,或胸腺基质淋巴细胞生成素(TSLP)诱导的Ⅱ型固有淋巴细胞(ILC2)激活对激素治疗产生抵抗性[14]。重症哮喘患者即使应用激素治疗,支气管肺泡灌洗液(BALF)仍高表达IL-33和TSLP[14],故TSLP可能是重症哮喘潜在的生物标志物[15]。中性粒细胞型表现为气道弥漫性中性粒细胞浸润,非Th2细胞因子(IL-17A、IFN-γ和IL-8)水平升高,伴气道高反应性和气道平滑肌增生[16, 17]。少炎症细胞型较少见,患者以气道平滑肌异常增生为特征,无显著气道炎症。
重症哮喘是一种异质性疾病,存在不同的表型和内型,尤其中性粒细胞型重症哮喘仍无特异性治疗药物。研发基于生物标记物的人源治疗性抗体已成为全球关注的热点。奥马珠单抗(Omalizumab)是一种人源化重组鼠抗人的抗IgE单抗,可改善重症哮喘患者症状,减少糖皮质激素用量和急性加重,提高患者生活质量[18]。全人源抗IL-5抗体(Mepolizumab和Reslizumab)和抗IL-5受体抗体(Benralizumab)已用于治疗高嗜酸粒细胞型重症哮喘[19]。全人源抗IL-4单抗(Dupilumab)及抗IL-13抗体(Tralokinumab和Lebrikizumab)已进入Ⅲ期临床试验。抗IL-17单抗(Brodalumab)处于Ⅱ期临床试验[20]。使用人源化TSLP IgG2泰泽培单抗(TZEP)治疗超过12个月,重症哮喘患者可显著临床获益,包括改善肺功能和减少急性加重频率[15, 21]。
三、中性粒细胞促进激素抵抗性哮喘
气道中性粒细胞大量募集浸润和活性增强是重症哮喘的“元凶”,但其潜在的发病机制未明,也无有效的药物控制。现有研究表明,IL-17、肿瘤坏死因子α(TNF-α)和IL-8等细胞因子可能与激素抵抗性哮喘密切相关。重症哮喘患者外周血IL-17A和BALF中TNF-α水平增高[16, 22]。将Th17细胞过继免疫缺陷小鼠,随后抗原诱导气道炎症,结果发现气道CXC趋化因子和中性粒细胞浸润增加,但不能被地塞米松逆转[23]。相反,Th2细胞过继可导致小鼠气道嗜酸粒细胞骤增,并且地塞米松显著抑制气道炎症。据此推测,Th17细胞产生的IL-17可介导中性粒细胞向肺内募集,引起激素抵抗性哮喘。采用卵蛋白(OVA)和佐剂诱导中性粒细胞性激素抵抗型哮喘表型,可见肺组织TNF-α表达上调[24]。而且,抗TNF-α抗体可恢复该模型的激素敏感性,说明TNF-α可能降低了中性粒细胞气道炎症对激素的治疗反应。联合尘螨、豚草和曲霉所建立的小鼠中性粒细胞气道炎症,与核因子NF-κB介导的角质形成细胞衍生趋化因子(人IL-8的一种功能同源物)有关。NF-κB抑制剂能够抑制IL-8水平,而地塞米松则不然,这表明IL-8在激素抵抗性哮喘气道中性粒细胞募集中起重要作用[25]四、NET在重症哮喘发病中的作用
NET不仅参与清除病原体,还会加重气道疾病。NET与慢性气道炎症性疾病(如哮喘和慢阻肺)关联[26],特别是重症哮喘(图1)。中性粒细胞自噬还能调节NET形成。新近研究证实,失去细胞核的中性粒细胞细胞质可能参与了激素抵抗性哮喘的病理生理过程。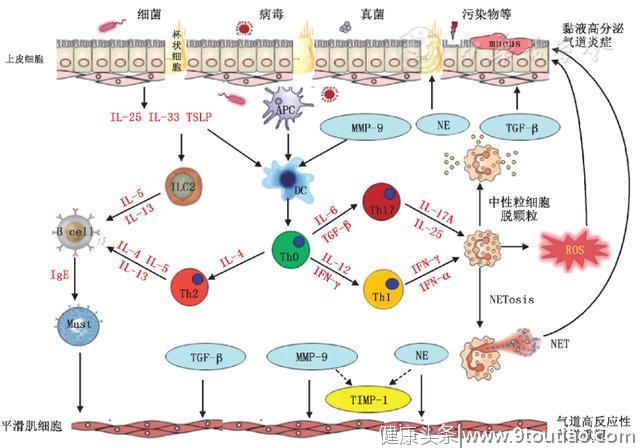
图1NET在重症哮喘中的作用。吸入变应原(病原微生物、污染物等)激活抗原递呈细胞。上皮细胞分泌胸腺基质淋巴细胞生成素(TSLP),激活树突状细胞(DC)并驱动Th0分化为Th2细胞,还通过Ⅱ型固有淋巴细胞(ILC2)激活肥大细胞,协同IL-25和IL-33,促进产生Th2细胞因子。IL-6和IL-12诱导Th0分化为Th1或Th17细胞,产生IL-17和IFN-γ等炎症因子,募集中性粒细胞至肺组织。中性粒细胞脱颗粒,产生基质金属蛋白酶9(MMP-9)、弹性蛋白酶(NE)和转化生长因子β(TGF-β),促进气道高反应性和气道重塑,并产生活性氧(ROS)。MMP-9诱导树突状细胞迁移和分化成熟,NE诱导杯状细胞分泌黏液,两者负调控基质金属蛋白酶组织抑制因子1(TIMP-1),加重肺组织损伤。中性粒细胞通过形成NET,释放dsDNA或NE等组分,导致气道上皮细胞损伤或死亡
1. NET促进气道中性粒细胞募集:与非中性粒细胞性哮喘患者比较,中性粒细胞性哮喘患者体内NET、胞外DNA(eDNA)和抗菌肽LL-37均显著增高[28]。而且,重症哮喘患者诱导痰eDNA水平显著高于轻中度哮喘患者。诱导痰eDNA水平与CXCL8和IL-1β呈正相关,与患者肺功能和哮喘控制水平呈负相关[28]。这表明患者NET、eDNA和抗菌蛋白LL-37气道积聚,与中性粒细胞募集、哮喘严重程度和肺功能恶化有关。2. NET诱导上皮源性细胞因子:哮喘气道嗜酸粒细胞激活涉及两种主要途径,即Th2和固有免疫-ILC2介导的免疫应答,其中固有免疫-ILC2免疫应答参与形成激素抵抗性哮喘[14]。NET诱导上皮细胞分泌内源性CXCL-8、IL-1β[28],促进气道上皮细胞产生IL-25、IL-33和TSLP等多种细胞因子,继而激活ILC2,产生Th2细胞因子,导致嗜酸粒细胞持续增多和激素抵抗。重症哮喘患者外周血嗜酸粒细胞胞外陷阱(eosinophil extracellular traps,EET)和ILC2数量显著升高,且两者呈正相关[29]。将EET注射到小鼠体内,上皮源性细胞因子(IL-1α、IL-1β、IL-33和TSLP)、BALF中嗜酸粒细胞以及肺组织ILC2数量显著增加[29]。这表明EET可通过激活气道上皮细胞和ILC2,增强重症哮喘气道Th2优势免疫。或许,NET也有EET样功能,共同促进重症哮喘的发生发展。
3. NET蕴含几十种颗粒酶:鼻病毒刺激宿主释放双链DNA(dsDNA)和弹性蛋白酶,并诱发哮喘急性加重。此时,哮喘急性加重患者dsDNA水平不仅与BALF弹性蛋白酶相关,而且与鼻腔灌洗液和BALF中Th2细胞因子及哮喘严重程度相关[30]。鼻病毒感染可促进哮喘小鼠NET形成并释放dsDNA,体内注射dsDNA则再现鼻病毒诱导哮喘急性加重的典型特征[30]。显然,肺组织NET大量积累是鼻病毒诱导哮喘急性加重的关键环节。在OVA致敏模型中,MMP-9基因敲除小鼠树突状细胞的迁移和分化成熟受抑,气道炎症和气道高反应性降低,Th2细胞因子和OVA特异性IgE减少[31]。长期暴露于中性粒细胞弹性蛋白酶,会出现杯状细胞化生和肺嗜酸粒细胞炎症。吸入弹性蛋白酶可引起Muc5ac蛋白高表达和杯状细胞化生,BALF角质形成细胞衍生趋化因子/IL-8和IL-5水平增多,肺组织炎症细胞浸润增多[32]。
4. 中性粒细胞自噬参与NET形成:自噬指在饥饿和细胞应激期间消除受损细胞器或蛋白质,藉以维持细胞存活。自噬相关基因5/7多态性与哮喘相关。与非重症哮喘患者相比,重症哮喘患者诱导痰和外周血细胞自噬水平增加[33]。在体外,IL-5刺激可提高重症哮喘患者外周血嗜酸粒细胞的自噬水平,而且不受地塞米松影响[33],说明自噬在重症哮喘中扮演重要角色。实际上,自噬参与NET形成和释放[34]。重症哮喘患者外周血NET与中性粒细胞自噬水平呈正相关[3]。与非重症哮喘患者相比,重症哮喘患者外周血NET和中性粒细胞自噬水平增高。IL-8非但增加重症哮喘患者自噬和NET水平,而且IL-8诱导的NET水平与FEV1/FVC呈负相关。换言之,中性粒细胞自噬与NET相关联,在炎症因子协同下,增强哮喘的严重程度[3]。加之,嗜酸粒细胞自噬诱导EET形成[35]。由此可见,调节中性粒细胞自噬和NET或嗜酸粒细胞自噬和EET,可能是治疗重症哮喘的新靶标。5. NET破坏气道上皮细胞和肺泡内皮细胞:体外研究显示,NET可直接杀死肺泡上皮细胞和内皮细胞,产生毒性作用,并呈剂量依赖性。其中,组蛋白是造成细胞毒性作用的重要因素[36]。重症哮喘患者分离的NET不仅诱导气道上皮细胞脱落、死亡,而且增加气道上皮细胞分泌炎症因子,例如IL-6和IL-8[2, 3]。急性肺损伤以中性粒细胞浸润为主,肺组织产生大量NET,诱导肺泡损伤和上皮细胞死亡。这揭示NET加重哮喘的严重程度,参与重症哮喘的发生发展。6. 失去细胞核的中性粒细胞细胞质诱导Th17介导的中性粒细胞炎症:空气过敏原和脂多糖致敏小鼠的NET形成增多,肺组织无细胞核的中性粒细胞细胞质也显著增多。PAD4基因敲除小鼠哮喘模型过敏性气道中性粒细胞炎症减少,NET、无细胞核的中性粒细胞细胞质和气道高反应性显著降低。然而,通过注入脱氧核糖核酸酶(DNase)降解NET,并不引起中性粒细胞减少。另外,中性粒细胞细胞质可体外激活肺树突状细胞,诱导Th0细胞产生抗原特异性IL-17。其实,中性粒细胞增高的重症哮喘患者NET和中性粒细胞细胞质均增高,两者与肺组织IL-17水平呈正相关[27]。因此,NET和中性粒细胞细胞质可能皆参与了IL-17介导的激素抵抗性哮喘。五、靶向NET治疗重症哮喘的策略
虽然吸入糖皮质激素抑制气道炎症是哮喘治疗的基石,但重症哮喘患者对激素治疗反应较差。随着糖生物学和纳米技术的突飞猛进,靶向治疗已成为国内外学者关注的热点。通过阻断NET形成,或者通过DNase酶降解NET,可用来治疗NET水平过高所致的相关疾病,例如急性肺损伤和病毒诱导的哮喘急性加重等。利用现代生物技术,制备针对NET或者NET组分的特异性配体,有助于治疗中性粒细胞炎症性疾病。
1. 靶向NET组分的特异性抗体:鼻病毒感染的哮喘小鼠体内注射弹性蛋白酶抑制剂,可减少NET形成,抑制Th2免疫、黏液高分泌和气道高反应性[30]。应用髓过氧化物酶抑制剂可减少NET对气道上皮细胞的毒性作用[36]。从重症哮喘患者分离的NET可刺激上皮细胞并引起细胞死亡,抗髓过氧化物酶抗体或抗弹性蛋白酶抗体预处理NET可减少细胞死亡,但地塞米松预处理NET反而加重NET的毒性作用[3]。毋庸置疑,对于NET增高为主的重症哮喘,针对NET组分的特异性抗体靶向治疗可能更加合适。
2. 阻断NET形成的条件:例如,ROS、自噬和PAD4已成为治疗NET相关疾病的靶标。体外研究显示,ROS阻断剂可减少哮喘患者产生EET,而地塞米松不能抑制EET[37]。自噬抑制剂可减少哮喘小鼠气道EET形成、杯状细胞增生、炎症因子释放和NF-κB表达[35]。应用基因沉默技术敲除PAD4基因,通过阻断NET形成,可抑制中性粒细胞募集和气道高反应性[27]。因此,自噬抑制剂、ROS阻断剂甚至PAD4基因沉默技术,乃是重症哮喘潜在的替代治疗方案。
3. 靶向唾液酸结合的免疫球蛋白样凝集素9(sialic acid-binding immunoglobulin-like lectin 9,Siglec-9):Siglec-9特异性表达于中性粒细胞表面,可诱导中性粒细胞发生程序性细胞死亡(凋亡或自噬),有助于促进中性粒细胞炎症消退[38]。A型链球菌表面高分子量透明质酸(HMW-HA)与中性粒细胞Siglec-9特异性结合,可抑制ROS和NET形成,从而逃逸中性粒细胞清除[39]。深入研究Th17细胞介导的中性粒细胞性激素抵抗机制,研发以Siglec-9为靶标的特异性配体、抗体或小分子化合物,有望为治疗中性粒细胞型重症哮喘带来新的前景[40]。
4. DNase降解已经形成的NET:体外研究证实,DNase可减轻NET对气道上皮细胞的损伤,这提示吸入Dnase有益于治疗NET介导的重症哮喘[2]。Dnase既能抑制气道NET,又能抑制EET[41]。DNase可显著抑制OVA致敏的急性哮喘小鼠EET形成,降低气道高反应性,抑制杯状细胞增生[41]。囊性纤维化患者应用黏液溶解剂DNase,可减轻气道炎症和黏液高分泌,改善近期肺功能,并延缓远期肺功能下降速度[42]六、总结与展望
中性粒细胞浸润与重症哮喘或激素抵抗型哮喘相关联。嗜酸粒细胞和中性粒细胞混合炎症可能是重症哮喘重要的病理特征及生物标志物。IL-17、TNF-α和IL-8等细胞因子可能与激素抵抗性哮喘的发病有关。NET具有抗感染和促炎的双重特性。NET及中性粒细胞胞质可能皆参与了IL-17介导的激素抵抗性哮喘的发生发展。抑制NET形成对鼻病毒诱导的哮喘急性加重有保护作用。DNase或NET组分抑制剂可减少NET形成或降解NET,改善重症哮喘症状、肺功能和急性加重。今后,深入剖析NET超微结构和功能、Siglec-9糖生物学以及Th17细胞和中性粒细胞之间的交互作用,研发以NET为靶点的小分子化合物或特异性配体,有望为治疗重症哮喘、慢性阻塞性肺疾病等中性粒细胞炎症性疾病带来新的愿景