间歇性低氧的心肌保护作用研究进展
REVIEW ARTICLES
缺血性心脏病(ischemic heart disease, IHDs)是临床最常见的心血管疾病,其发病率和病死率逐年上升,世界卫生组织预计到2020年急性心肌梗死将成为全球人口的主要致死疾病 。如何提高心肌细胞对缺血/缺氧的耐受力是诸多研究的焦点。间歇性低氧(intermittent hypoxia, IH)通过间歇性给予机体低氧刺激,增强机体对低氧的耐受力,避免机体产生不可逆损伤 。IH的心脏保护作用主要包括抗缺血性损伤、抗心律失常,改善心肌退行性变等。影响IH对机体作用效果的主要因素包括低氧程度、持续时间、低氧‑常氧交替方式等。短期、轻度、低频的IH使机体产生良性适应性反应,称为间歇性低氧适应(intermittent hypoxic conditioning, IHC);而慢性、中重度、高频IH对机体产生不利影响,甚至可导致多器官功能障碍 。近年来,大量实验表明间歇性低压低氧(intermittent hypobaric hypoxia, IHH)可显著改善缺血/再灌注(ischemia/reperfusion injury, I/R)后心脏舒缩功能,缩小心肌梗死面积,减少心律失常、心肌纤维化的发生,增加冠状动脉血流量。IHH实施方法简便,心肌保护时效长,具有重要的理论和实用价值。IH包括常压低氧和低压低氧两种,二者均可诱发心肌保护作用。大量研究表明IHH对机体的心肌保护作用较单纯IH更强,不良反应更少。关于氧水平如何影响细胞代谢和生理功能的研究越来越受到重视,相关研究获得了2019年诺贝尔生理学或医学奖,尤其是IH的心脏保护作用已成为医学研究热点,有望成为临床心肌保护治疗的新切入点。文章就近年来IH的心肌保护作用进行综述。
1 IH的心肌保护机制
1.1IH心肌保护作用的相关基因表达
反复低氧/复氧可激活两个重要的转录因子:低氧诱导因子‑1(hypoxia‑inducible factors 1, HIF‑1)和红系衍生的核因子2相关因子2(nuclear factor erythroid‑2 related factor 2, Nrf2),继而促进一系列细胞保护性蛋白的表达。HIF‑1触发糖原合成和糖酵解酶的表达,促进细胞对低氧的耐受性;血管内皮生长因子(vascular endothelial growth factor, VEGF)可促进血管生成和组织灌注;促红细胞生成素(erythropoietin, EPO)发挥抗梗死和抗凋亡作用。IHC可诱导心肌细胞合成VEGF和EPO。低氧通过抑制脯氨酰羟基化、降解HIF‑1α亚基来激活HIF‑1驱动的基因程序。IHC可减少细胞DNA损伤,增加心肌细胞中超氧化物歧化酶(superoxide dismutase, SOD)、VEGF和HIF‑1α的mRNA含量 。低氧诱导因子(hypoxia‑inducible factor,HIF)是机体低氧适应生理性应答反应中最主要的转录因子家族,HIF靶基因产物涉及红细胞的生成、血管的生成及细胞的增殖、代谢、凋亡等多个方面。人及其他哺乳动物体内共存在3种HIF家族成员即HIF‑1、HIF‑2、HIF‑3,3者均为由HIF‑α亚基和HIF‑1β亚基组成的异源二聚体,HIF‑α亚基(HIF‑1α、HIF‑2α、HIF‑3α)为功能性亚基,受氧气浓度调控,HIF‑1β为结构性亚基,对低氧不敏感。HIF‑1在人体各组织中广泛表达,磷酸化和羟基化是HIF‑1α的两种降解调节方式。HIF‑1和HIF‑2在颈动脉体对血氧急性变化的感知中扮演重要角色,HIF‑1也参与心肌缺血预适应保护作用,HIF‑1、HIF‑2的协调转录活性在慢性低氧的生理适应性中至关重要 。肾上腺素能活性和活性氧(reactive oxygen species, ROS)可通过磷酸化HIF‑1α来激活HIF‑1基因程序,从而抵抗蛋白酶体的降解 。
Nrf2可激活抗氧化酶相关基因 ,生成大量抗氧化酶,参与缺血预处理的心脏保护作用的形成 。常氧条件下,Nrf2与促进其泛素化及降解的蛋白质结合形成复合物,活性氧可氧化该复合物释放Nrf2,进而促进抗氧化酶的生成。Nrf2是近年新发现的机体抵抗内外界氧化和化学等刺激的防御性转导通路,以此为靶点的药物如巴多克沙龙、富马酸二甲酯,均通过Nrf2信号通路拮抗氧化应激及DNA损伤。缺氧通过诱导微RNA(microRNA, miRNA)‑34a衰减,维持葡萄糖代谢,发挥心肌保护作用,提示通过miRNA antagomir对miRNA‑34a进行靶向治疗可能是心脏缺血性损伤的有效治疗机制 。通过单次低氧10 min的处理,减少了培养的H9c2大鼠心肌母细胞在次日模拟的I/R中细胞死亡的发生,缺氧初期Nrf2易位至细胞核,24 h后缺氧触发Nrf2与抗氧化剂反应元件结合并促进一系列抗氧化酶的表达 ,当小干扰RNA(small interfering RNA, siRNA)阻断Nrf2介导的抗氧化剂蛋白或相关Nrf2稳定剂DJ‑1表达时,以上保护作用随之消失 。给予大鼠4 d低压低氧和4 d常压常氧交替4个周期后,发现左心室的Nrf2基因表达产物锰超氧化物歧化酶(manganese superoxide dismutase, MnSOD)、谷胱甘肽过氧化物酶和抗氧化酶含量增加,这些物质与左室收缩力的增强相关 。慢性IH减轻心肌I/R损伤的机制之一可能是通过上调磷酸化蛋白激酶B(phospho‑protein kinase B, p‑Akt)来上调活化转录因子6(activating transcription factor6, ATF6)实现,p‑Akt是心肌细胞存活的关键调节剂 。
1.2Ca2+与线粒体机制
I/R通过剥夺心肌细胞的ATP或产生ROS使心肌细胞的离子转运蛋白和离子通道失活,从而影响心脏的收缩功能。慢性间歇性低压低氧(chronic intermittent hypoxia, CIHH)作用于Na+/Ca2+交换体,可改善发育中大鼠I/R引起的心脏钙超载 。缺血后ROS通过抑制线粒体钙单向转运蛋白开放来激活信号转导与转录激活因子3,继而减轻线粒体钙超载,介导IHH发挥抗I/R的心脏保护作用 。CIHH可上调过氧化物酶体增殖物激活受体γ共激活因子1(peroxisome proliferator‑activated receptor γ coactivator‑1, PGC‑1)的表达并调节葡萄糖和脂质的能量代谢,从而减轻心肌细胞的钙超载和缺氧/复氧损伤,HIF‑1‑腺苷酸活化蛋白激酶(activated protein kinase, AMPK)信号通路可能参与此过程 。CIHH通过上调葡萄糖转运蛋白4、p‑AMPK和PGC‑1的表达改善心脏葡萄糖代谢,下调心肌细胞丙酮酸脱氢酶激酶同工酶4的表达来改善I/R损伤 。IH可能通过减少I/R诱导的心肌胞质Zn2+超载和细胞凋亡而发挥其心脏保护作用 。维持线粒体结构和功能的完整性,在IH心肌保护作用机制中具有重要作用。
1.3低氧预处理与心肌细胞凋亡
低氧预处理与缺血预处理一样,具有心肌保护作用。低氧适应会降低缺血预处理的效率,这两种处理产生的心脏保护作用不可叠加,提示慢性低氧和预处理的心肌保护机制可能具有相同的信号通路 。
IH可促进心肌胞膜表达B淋巴细胞瘤‑2基因(B‑cell lymphoma‑2, Bcl‑2),减少胞膜、胞质表达Bcl‑2相关X蛋白(Bcl‑2‑Associated X protein, Bax),通过增加Bcl‑2/Bax的比例(尤其是膜部分)减少I/R诱导的心肌细胞凋亡 。同时IH减少I/R后线粒体细胞色素C的释放。这些结果表明IH减轻I/R引起的心肌细胞凋亡和坏死,在IH心肌保护作用机制中具有重要意义。
1.4活性氧(reactive oxygen species, ROS)
大量证据表明,ROS在低浓度时表现心脏保护作用,高浓度时可导致心肌损伤。IH可刺激机体产生低浓度ROS,ROS通过信号转导通路参与细胞和机体对IH的一系列适应性反应,包括氧化还原敏感蛋白激酶和转录因子,它们会增加心肌对缺氧的耐受性。相反,在IHC期间补充抗氧化剂会中断这种低水平的信号转导,并可能削弱心脏保护作用 。最近研究证实红系衍生的核因子2相关因子2‑硫氧还蛋白1‑HIF‑1α信号途径及其主要下游分子即诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、VEGF和EPO在CIHH适应形成过程中被激活,并参与ROS依赖的CIHH适应性心脏保护机制。
1.5IH激活蛋白激酶信号通路与一氧化氮(nitric oxide, NO)
蛋白激酶 C(protein kinase C, PKC)是一组广泛分布且具有单一肽链结构的丝氨酸/苏氨酸蛋白激酶,是细胞磷脂酰肌醇信号转导系统的重要组成部分。一般认为,只有在发生了转位之后,PKC同工酶才起作用。蛋白激酶磷脂酰肌醇‑3‑激酶(phosphatidylinositol 3‑kinase, PI3K)和Akt与β肾上腺素能激动剂诱导的心脏保护相关 。最近发现,IH可引起内皮型一氧化氮合酶蛋白表达的下调,诱导型一氧化氮合酶蛋白表达升高,促进心肌细胞产生较多NO,NO具有心肌保护作用,在心肌I/R中可对机体产生一系列益处 。
1.6肾上腺能通路及阿片受体通路
阻断β肾上腺素受体有抗心律失常和改善缺血心肌重塑作用。β1肾上腺素能受体激活可抑制基质金属肽酶2活化,进而增强IHH的缺血后心肌保护作用 。CIHH通过降低受体密度、亲和力,减少与膜结合的G(s)α,抑制右心室乳头肌中的β肾上腺素受体而发挥作用,此机制可能参与心脏保护作用 。
大鼠实验中,在急性缺血前注射几种不同的μ和δ选择性拮抗剂可阻断低氧诱导的抗梗死性心脏保护作用 。IHC可介导副交感神经传导及局部副交感神经支配增加,阿片类药物的阻断作用可减弱上述副交感作用,提示阿片类药物介导的心脏保护作用可能涉及胆碱能机制 。
1.7其他机制
CIHH和Ω3脂肪酸均可通过抗氧化剂和抗炎机制独立诱导心肌细胞功能改善,产生心脏保护作用 。CIHH可以调节心脏自主神经活动,并抑制急性常压低氧引起的心率变异性(heart rate variability, HRV)变化 。IH可通过适应性反应增加心肌自噬,防止内质网应激和细胞凋亡 。CIHH预处理可减轻辐射引起的心脏功能损害和纤维化,这种保护作用与抑制氧化应激和内质网应激密切相关 。CIHH治疗经由PKC信号通路抑制内质网应激,对I/R损伤发挥心脏保护作用。
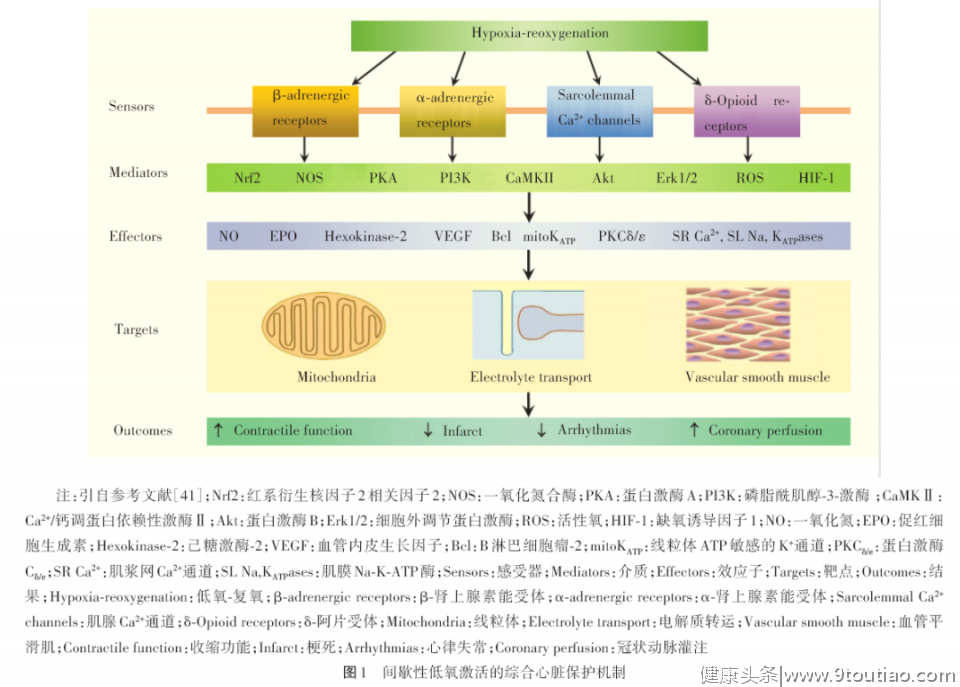
IH对机体的作用机制复杂,IH激活的综合心脏保护机制如图1所示。间歇性低氧/复氧作用于心肌细胞的肾上腺能受体、阿片受体、Ca2+通道,通过不同的介质动员不同的效应分子,进而保护线粒体和细胞膜Ca2+、Na+通道以及冠状动脉免受I/R引起的损伤,最终保护心肌收缩功能、冠状动脉的灌注功能,减少心律失常和不可逆的组织损伤的发生。
2 IH心肌保护作用的临床研究
大量的临床研究表明患者可从IHC中获益,IHC已应用于高血压、冠状动脉粥样硬化性心脏病(冠心病)、耐药性心律失常和肺部疾病的高危患者。研究显示,吸入10%~14%氧气3~5 min,每周3~5次,每两次治疗日之间间隔1 d,持续3周,可提高冠心病老年患者的运动耐力,提高生活质量 。Glazachev等 的研究也证明了上述结论,IH高氧训练可提高冠心病患者的运动耐量,减少危险因素,提高生活质量,与8周的康复训练效果相当。del Pilar Valle等 的研究表明间歇性低压低氧训练明显提高了6例冠状动脉旁路移植术后患者的心肌灌注水平。Shatilo等 研究发现间歇性常压低氧训练可缓解稳定型心绞痛患者的心绞痛症状,减少每日心肌缺血时间,促进脂代谢恢复正常,增加患者的运动耐量。一项随机单中心、前瞻性研究将120例缺血型心脏病并符合冠状动脉旁路移植术(coronary artery bypass grafting, CABG)手术指征的患者分为间歇性低氧‑高氧训练(intermittent hypoxic‑hyperoxic training, IHHT)组、远端缺血预处理(remote ischaemic preconditioning, RIP)组、对照组,并检测这些患者在CABG术前、术后2 h、术后24 h的血清心肌肌钙蛋白I和术后乳酸数值,结果发现术后IHHT组患者的血清心肌肌钙蛋白I、乳酸中位数数值明显低于RIP组和对照组,这是第一次研究IHHT对CABG患者的围手术期心肌保护作用,研究者建议此后的研究应更多关注于临床效果而非替代指标 。Saeed等 研究发现间歇性常压低氧训练可增加左室射血分数≤35%的心衰患者在治疗结束后1个月的6 min行走距离、骨骼肌力量,并提高了生活质量评分和左室射血分数。
不同个体对低氧反应的差异较大,因此IH的用氧量设定应针对不同个体单独滴定。就具体实施而言,目前的研究方法差异很大,不同研究在缺氧强度、低氧期和常氧期的持续时间、每天循环次数、总的训练时间的设定上各有不同。目前较为认可的IH处理模式为:暴露于10%~12% FiO2,每次5~7 min,每日3~4次,两次治疗日之间间隔1 d,总治疗时间为2~3周 。这种方式可使高血压、冠心病、慢性心衰等心血管病患者明显获益。但此种处理仍存在较多争议,为此,国际社会一直在寻求标准化治疗方案,但目前尚未形成统一的操作范式。
3 IH心肌保护的应用前景
缺血性心脏病是临床常见疾病,严重损害心功能,是威胁人类健康的十大疾病之一。目前临床相关治疗用药存在不同程度的副作用,开发非药物治疗手段是临床研究热点之一。IHC在缺血性心脏病的预防和治疗方面有较大优势。间歇性低压低氧可减少心肌不良重塑,改善心肌收缩力,治疗心肌梗死 。
目前,IH应用于临床还存在一定局限性。IHC的使用周期、使用时机、具体实施方案等问题尚未解决,其安全性和有效性有待进一步证实,IH诱发机体产生的各种内源性保护机制之间的关系如何,填补这些关键研究耗资较大。此外,还应对IH的不良反应予以关注。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])