前沿:多个临床案例证明干细胞治疗心脏病的可行性
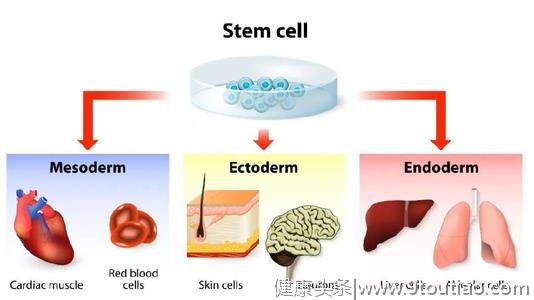
干细胞能自我更新,其在特定条件下能够产生至少一种终末分化细胞,有望修复或替换心肌病、心力衰竭和冠心病等心脏病发作时损害的心脏组织,能够改善患者心功能,提升生活质量。

心脏病包括心脏传导系统疾病、心肌缺血、心力衰竭和心律失常等,严重威胁国民经济与健康。在中国,心脏病的患病人数持续增加,2016-2020年急性心肌梗死 ( myocardial infarction, MI) 的死亡率总体仍呈上升态势"。
目前治疗心脏病的方法包括外科手术治疗、介入治疗和药物治疗等。其中药物治疗的效果有待增强,外科手术过程中产生的创面大,易引发多种并发症。相比之下,介入治疗为微创手术,但也伴随着不同程度并发症的发生,这些方法都无法对已经坏死的心肌产生治疗作用。
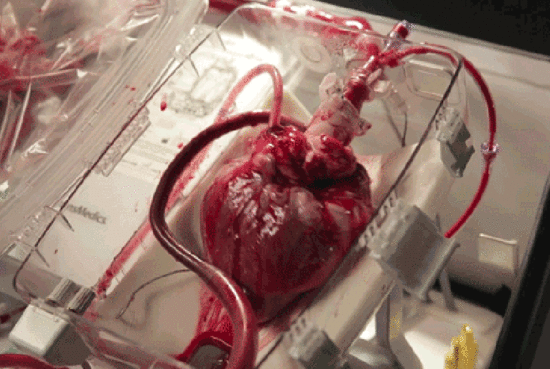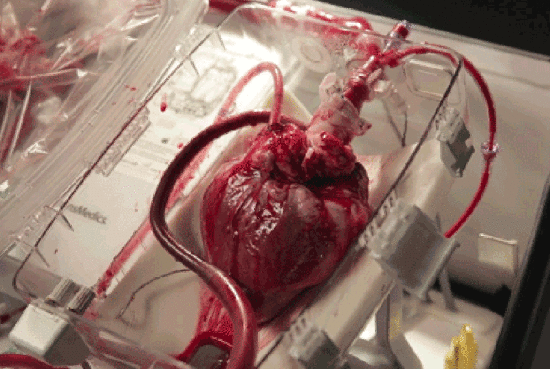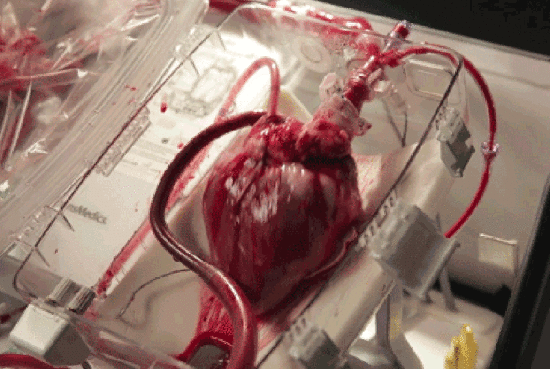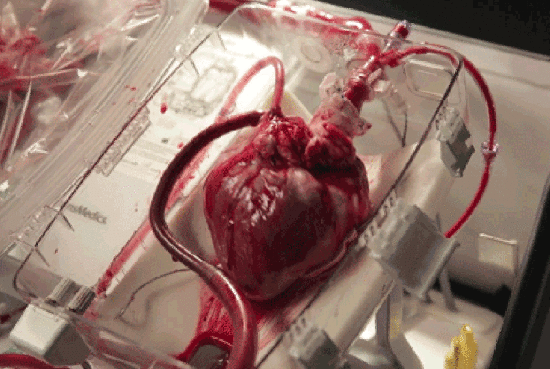
近年来,干细胞技术作为第三种医疗手段,为许多“顽疾”带去了治疗的希望,而其与心脏疾病对抗的表现也毫不逊色,展现了干细胞用于心脏疾病的巨大潜力。
1、分化为心肌细胞
干细胞具有多向分化潜能,在体外能分化为心肌细胞、内皮细胞和血管平滑肌细胞。但目前研究发现干细胞分化为心肌细胞与改善的心功能不完全符合,其他的机制也发挥了重要的作用。
2、分化成新生血管
研究发现干细胞可以分化成新生血管,这有助于提高缺血性心肌病患者的心功能。
3、旁分泌机制
移植的干细胞可通过释放细胞因子、化学趋化因子、生长因子或微粒进入周围组织而诱导心肌修复。这些物质能促进再生过程,包括内源性干细胞的激活、新血管形成、抑制凋亡,抑制肥大增生等,这些作用提高了心室功能,改善灌注,促进心肌修复。
研究证明移植干细胞的旁分泌机制发挥主要作用
大量实验表明干细胞在移植后的缺血缺氧环境中存活率低,少量的细胞不足以发挥治疗作用,但移植细胞可以分泌多种细胞因子和外泌体等生物活性物质。
基质细胞衍生因子-1 已被证明参与干细胞的动员、归巢、增殖和分化,在干细胞归巢到损伤心肌中具有重要作用;
外泌体内含多种物质,能参与细胞间信息交流, miR-24(来源于心肌球源性细胞的外泌体)通过靶向弗林蛋白酶调节心脏纤维化,减少了心肌瘢痕的形成;氧化应激为心脏 疾病发展过程中的关键步骤,心脏祖细胞( cardiac progenitor cells, CPCs)来源的外泌体中miR-21能下调程序性细胞死亡因子,保护CMs免受氧化应激引起的细胞凋亡。
Khan 等发现心肌内注射小鼠ESCs来源的外泌体后未在MI小鼠模型中观察到肿瘤的形成。Liu等川研究发现用能够缓慢释放细胞外囊泡的补片进行试验不会增加MI大鼠的心律失常负担,结果表明外泌体有望在MI后心脏修复中发挥治疗作用的同时克服干细胞治疗的一些缺点。
临床案例(一)研究方法
现有的临床研究通过冠状动脉内或心肌内注射等方法将细胞直接输送到心肌部位。Butler等[28]进行了一项II期临床随机试验,将骨髓间充质 干细胞( bone marrow mesenchymal stem cells, BMSCs)经静脉注射到慢性非缺血性心肌病患者体内。
研究结果
结果显示,自然杀伤细胞减少程度与左室射血分数的改善程度相关,静脉输注同种异体缺血耐受BMSCs的治疗作用与循环炎症细胞数量改变相关。表明静脉输注BMSCs确实发挥了全身作用,能调节炎症反应,这种全身效应可能是通过抗炎特性介导的非心血管系统效应。通过对细胞外泌体进行修饰可以增强其靶向性,基因修饰或者预处理可以增强干细胞的治疗作用。干细胞移植策略的比较见表1

研究理论与方法
MSCs外泌体还能刺激新生血管的生成,Teng等[29]使用人脐静脉内皮细胞进行血管生成实验,将其与外泌体孵育12h使管样结构形成。
研究结果
结果表明,MSC来源的外泌体可以被内皮细胞内化,可增强人脐静脉内皮细胞的成管能力,在去除外泌体的条件培养基和磷酸缓冲液对照组之间,血管生成和心功能改善没有差异。
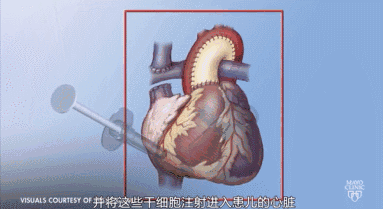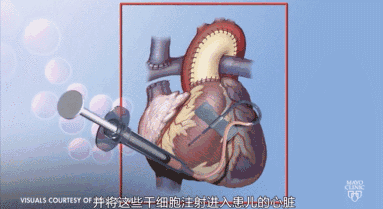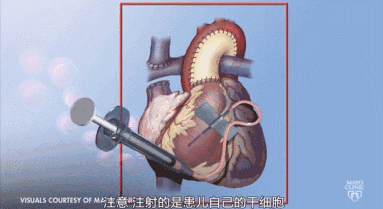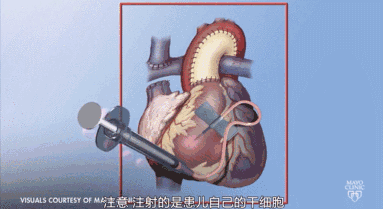
对心脏病患者而言,干细胞移植可以改善心功能,促进血管新生和心肌再生。其临床前研究与临床试验已取得进展,干细胞的再生能力使干细胞在治疗心脏病上占据优势,干细胞治疗是非常有前景的治疗心脏病的方法。人体内多种类型干细胞可以应用于疾病治疗中,应用干细胞的伦理和免疫排斥等问题正一步步得到解决。