最新指南解读:原发性醛固酮增多症(PA),值得学习收藏
*仅供医学专业人士阅读参考
一、PA简介
原发性醛固酮增多症(PA)是因为肾上腺皮质分泌过量醛固酮,导致体内潴钠、排钾、血容量增多、肾素-血管紧张素系统活性受抑等情况的疾病,临床主要表现为高血压伴低血钾,但近几年因为许多PA患者常常缺乏低血钾的表现,导致PA发病率被低估,此外,PA患病率与血压呈正相关,高血压1、2、3期患者PA患病率分别为3.9%,9.7%,11.8%。二、开门见山:PA诊断
■ 2.1 PA诊断指标
低血钾症是PA的传统标志,但现在发现仅有小部分(9%-37%)的PA患者有此症状,因此我们也应当关注到除低血钾以外的其他检测指标。PA的诊断指标包括低水平或低于检测限的肾素水平、血浆醛固酮(PAC)浓度过高。附上解读PAC水平时的4点Tips:1.如果PA患者PAC浓度正常,此时低肾素成为唯一的指征;2.若患者每日钠摄入量高于200mEq,此时接近临界值的PAC水平也能确诊PA;3.个体差异导致PAC的敏感性不同,比如美洲人种和非洲人种就具有较高的敏感性;4.PAC具有波动性,在已确诊的PA患者中,PAC水平也有可能波动至正常范围内,因此,再次说明高PAC水平并非PA的必要指标。当患者没有明显的PA临床表现,如呕吐,腹泻等,低血钾症可作为PA的有力指标。另一重要的指标是醛固酮-肾素比值(ARR),它被证实比PAC、血浆肾素活性(PRA)、直接肾素浓度(DRC)中任何一项单独指标都更具优势,ARR同时具备高敏感度,高准确性及高重现性。本指南强推ARR为高血压患者的首选诊断方法(推荐等级Ⅰ,证据水平B)。此外,DRC操作简便,低肾素水平下也能展现较高准确率,现今已能广泛替代PRA化验法,同时具有分析时间短、成本低等优势(推荐等级Ⅱ,证据水平B)。在无法进行ARR检测的时候,DRC可作为替代检测方法。表1 病例检测要点总结
■ 2.2诊断干扰因素
当我们得到一份诊断结果的时候,我们应当考虑取样的标准化和潜在的干扰因素(推荐等级Ⅱ,证据水平A),比如,肾素和醛固酮的分泌呈现出生理性规律,早上醒来时达到最高值,因此取样的时间点应该标准化并且在分析数据时将其考虑在内。此外,姿势也能影响结果,站姿升高肾素水平,从而影响PAC。因此指南推荐在60分钟的仰卧或坐位休息后,再进采取血样(推荐等级Ⅱ,证据水平B)。其他的注意事项包括:女性月经期可能导致ARR试验假阳性;采血时速度应当缓慢,以免溶血现象出现,导致人为的血钾正常;如果使用DRC试验法。应到注意样品运输时,保持室温;绝经前处于月经黄体期和绝经后接受激素替代疗法的妇女ARR结果可能会呈现假阳性,因为PAC的上升幅度远大于肾素。表2 影响PAC/肾素/ARR的影响因素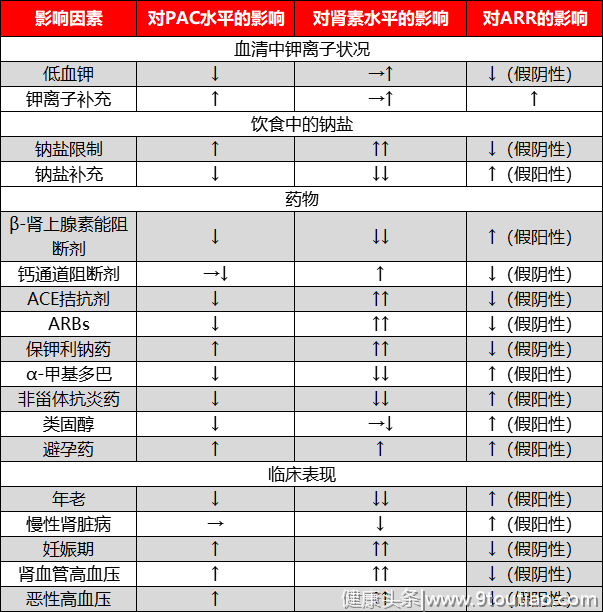
■ 2.3 肾素和醛固酮化验
血浆肾素可以通过检测血管紧张素Ⅰ(PRA,ng/ml/h)也可以通过直接检测活性肾素的方式获得(DRC,mIU/L or pg/mL)。一项对照研究对比了PRA和DRC,结果显示这两种方法都能较好地用于筛选肾素水平低的PA患者。但当肾素过低时,所有检测方法的准确度都将下降,因此需要设立最低检测限(PRA:0.2 ng/mL/h,DRC:2 mIU/L),排除假阳性结果。来自不同实验室的PAC检测值往往有所差别,可能是血浆提取过程或抗体的交叉免疫反应所导致。此时条件允许下,使用质谱能极大地提高PAC的准确度。表3 肾素和醛固酮化验要点总结
■ 2.4原发性醛固酮和妊娠
表4 妊娠期PA要点总结
 尽管高血压在妊娠期妇女中占比约6%-8%,但目前仅报导41例妊娠期PA患者案例,这也反映了妊娠期对PA的诊断难度。妊娠期机体处于高肾素,高醛固酮的状态,能极大程度地提高肾素和PAC的水平。因此已确诊醛固酮腺瘤(APA)的患者,应在妊娠期前进行手术。
尽管高血压在妊娠期妇女中占比约6%-8%,但目前仅报导41例妊娠期PA患者案例,这也反映了妊娠期对PA的诊断难度。妊娠期机体处于高肾素,高醛固酮的状态,能极大程度地提高肾素和PAC的水平。因此已确诊醛固酮腺瘤(APA)的患者,应在妊娠期前进行手术。三、诊疗方法大比拼:CT法 VS AVS法
对于PA患者一般推荐采用医学成像方式诊疗,如计算机化X线体层照相术(CT),不仅能筛选出肿瘤患者,也能明确肾上腺静脉位置,以便后续进行肾上腺静脉取样(AVS)操作。但CT法与AVS得到一致诊断结果的概率仅为50%,并且AVS法能诊断出约22%的CT阴性的单侧肾上腺增生患者,和约25%的双侧或对侧增生患者。表5 影像学诊断法要点总结 尽管这种取样方法昂贵,技术要求高且有0.7%肾上腺静脉破裂的风险,AVS仍然是确定患者是否能进行单侧肾上腺切除术的重要考察指标。表6 AVS取样方法要点总结
尽管这种取样方法昂贵,技术要求高且有0.7%肾上腺静脉破裂的风险,AVS仍然是确定患者是否能进行单侧肾上腺切除术的重要考察指标。表6 AVS取样方法要点总结
四、并发症
■ 4.1 阻塞性睡眠呼吸暂停(OSA)
根据一项多导睡眠检测研究,OSA在PA患者中普遍存在,具有高达79%的发病率,在中国患者和白人患者中这一数值为67%。并且OSA患者PA发病率高于没有OSA的患者2-3倍,动物实验显示间断性缺氧将引起血浆内皮素-1的升高,继而引起PAC分泌增加。■ 4.2 心房颤动(AF)
高血压是AF的主要风险因素,约有50%-90%的AF患者患有高血压,因此PA被认为会造成心脏结构变化,如炎症、纤维化、心肌肥大、心肌重塑,以及功能和电生理的改变,最终引起AF产生。■ 4.3 心肌病
PA对心血管的损伤甚至超过了高血压,PA患者中罹患左心室肥大(LVH)的概率显著性提高,有MRI证据显示左心室纤维化进展。■ 4.4 肾脏和代谢并发症
PA通过过度激活盐皮质激素受体能使肾脏疾病及代谢性紊乱的发病率大大升高。此外,对比原发性高血压,PA有更高的肾小球滤过率(eGFR)调节的尿白蛋白滤过率(UAE),也因此有更高的风险导致肾脏衰竭。■ 4.5 骨质代谢
实验及临床数据显示醛固酮增多能通过促进尿钙排除,引起低血钙症,进而诱发继发性甲状腺功能亢进加剧骨矿物质流失,骨密度下降。对比无功能性肾上腺肿瘤患者,PA患者更易发生骨质疏松,且具有更低的骨矿物质密度(BMD)和骨小梁质量,以及更高的椎骨骨折风险。表7 PA并发症要点总结 五、治疗方案有研究指出肾上腺切除手术能减少PA患者抗高血压药物的使用剂量;在肾上腺静脉取样国际研究-2(AVIS-2)试验中,发现肾上腺切除术能缓解甚至完全治愈难治性高血压;此外,手术还可改善多个生理指标。因此,肾上腺切除术也被推荐作为首选疗法,而药物治疗则推荐用于双侧肾上腺增生(BAH)或排除单侧肾上腺增生的患者(推荐等级Ⅱ,证据水平B)。对于单侧肾上腺增生者,更加推荐用AVS指示下的经腹腔和腹腔后的腹腔镜肾上腺切除术,能保证高达98%的成功率及40%-50%的治愈率。为了保留余下部分肾上腺的功能,轻度侵入性的手术方案和部分肾上腺切除手术成为患者的新选择,且必须用AVS作为指导,但目前仅在日本的几家临床中心有过实践案例(推荐等级Ⅱ,证据水平C)。在术前,必须先纠正患者的高血压和低血钾症,可以采用盐皮质激素受体阻抗剂(MRAs)和/或使用钾离子补充剂;在进行择期手术前,肥胖症也建议先进行纠正,因为肥胖患者具有更高风险需要进行重症特别护理,或可能出现无法完全移除肾上腺的情况(推荐等级Ⅱ,证据水平C)。单独使用MRAs或联合其他抗高血压药物,能用于稳定双侧肾上腺增生PA患者。同时,也可用于经AVS诊断,不适合肾上腺切除术的单侧增生PA患者的血压值和血钾浓度(推荐等级Ⅱ,证据水平A)。表8 PA治疗方法要点总结
五、治疗方案有研究指出肾上腺切除手术能减少PA患者抗高血压药物的使用剂量;在肾上腺静脉取样国际研究-2(AVIS-2)试验中,发现肾上腺切除术能缓解甚至完全治愈难治性高血压;此外,手术还可改善多个生理指标。因此,肾上腺切除术也被推荐作为首选疗法,而药物治疗则推荐用于双侧肾上腺增生(BAH)或排除单侧肾上腺增生的患者(推荐等级Ⅱ,证据水平B)。对于单侧肾上腺增生者,更加推荐用AVS指示下的经腹腔和腹腔后的腹腔镜肾上腺切除术,能保证高达98%的成功率及40%-50%的治愈率。为了保留余下部分肾上腺的功能,轻度侵入性的手术方案和部分肾上腺切除手术成为患者的新选择,且必须用AVS作为指导,但目前仅在日本的几家临床中心有过实践案例(推荐等级Ⅱ,证据水平C)。在术前,必须先纠正患者的高血压和低血钾症,可以采用盐皮质激素受体阻抗剂(MRAs)和/或使用钾离子补充剂;在进行择期手术前,肥胖症也建议先进行纠正,因为肥胖患者具有更高风险需要进行重症特别护理,或可能出现无法完全移除肾上腺的情况(推荐等级Ⅱ,证据水平C)。单独使用MRAs或联合其他抗高血压药物,能用于稳定双侧肾上腺增生PA患者。同时,也可用于经AVS诊断,不适合肾上腺切除术的单侧增生PA患者的血压值和血钾浓度(推荐等级Ⅱ,证据水平A)。表8 PA治疗方法要点总结
参考文献:
Rossi GP, Bisogni V, Bacca AV, Belfiore A, Cesari M, Concistrè A, Del Pinto R, Fabris B, Fallo F, Fava C, Ferri C, Giacchetti G, Grassi G, Letizia C, Maccario M, Mallamaci F, Maiolino G, Manfellotto D, Minuz P, Monticone S, Morganti A, Muiesan ML, Mulatero P, Negro A, Parati G, Pengo MF, Petramala L, Pizzolo F, Rizzoni D, Rossitto G, Veglio F, Seccia TM. The 2020 Italian Society of Arterial Hypertension (SIIA) practical guidelines for the management of primary aldosteronism. Int J Cardiol Hypertens. 2020 Apr 15;5:100029. doi: 10.1016/j.ijchy.2020.100029. PMID: 33447758; PMCID: PMC7803025.
投稿/转载/商务合作,请联系:[email protected]