糖尿病肾病核心教程 | 2018年更新
糖尿病肾脏病变(Diabetic kidney disease,DKD)和糖尿病肾病(Diabetic nephropathy,DN)是终末期肾病(ESRD)的主要原因。在美国,30% ~ 50% 的 ESRD 由糖尿病(DM)引起。但值得注意的是,只有 30% ~ 40% 的 DM 患者患有 DN。
美国亨利福特医院肾脏病与高血压科的 Kausik Umanath 教授和范德堡大学医学中心肾脏病与高血压科的 Julia B. Lewis 教授在 AJKD 杂志近期推出的系列课程中概述并详细讨论了 DN 的流行病学、病理生理学、诊断和治疗的相关知识,为肾脏病学的受训人员提供专业核心知识。
流行病学
DKD 的肾功能减退可能由许多不同的原因导致,包括高血压性肾硬化和未知的急性肾损伤等。DN 是一种诊断,指的是因 DM 对肾脏的影响导致 DM 患者的肾脏中出现特定的病理结构和功能变化。这些变化导致以蛋白尿、高血压和肾功能渐进性降低为特征的临床表现。
DN 具有多基因遗传和家族聚集特征,并因种族和民族而异。正在进行的研究试图鉴定与 DN 发展相关的特定遗传因素和基因。但是由于其非简单的孟德尔遗传特征和在不同人群中基因间相互作用的差异,几个确定的候选基因,包括葡萄糖转运蛋白 2,转化生长因子β和内皮型一氧化氮合成酶,尚未获得公认。
病理生理学
糖尿病环境引起的糖基化终产物的产生和循环、生长因子的加工以及血液动力学和激素的变化,导致活性氧和炎症介质的释放,会引起肾小球超滤、肾小球高血压、肾肥大和肾小球组成改变,临床表现为蛋白尿和高血压。病理学上,肾脏发生多种改变,包括细胞外基质沉积(主要是系膜)、肾小球基底膜增厚、增殖改变和肾小管萎缩,最终导致间质纤维化和肾小球硬化。
糖尿病肾病的病理生理学

肾组织检查显示肾小球基底膜增厚和系膜扩张。DN 的典型病理损害是结节性的,结节通常是无细胞,并且通过过碘酸 - 希夫染色呈阳性,但仅有 10%〜50% 的 DM 患者行肾活检检查。更常见的是弥漫性肾小球病变,其特征在于弥漫性系膜基质扩张。
糖尿病肾病病理图
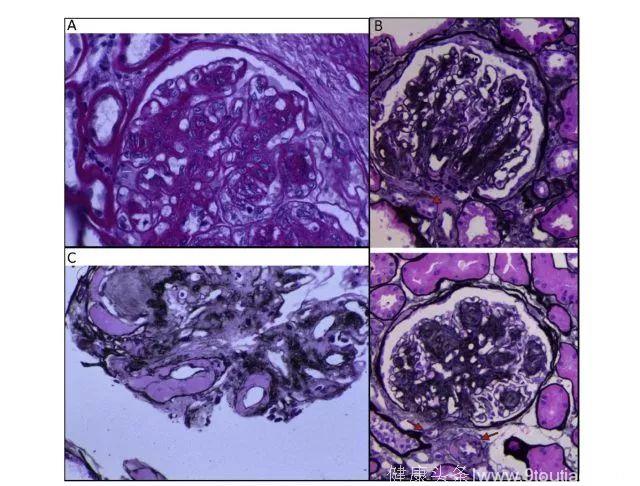
值得注意的是,在其他疾病状态,如膜增生性肾小球肾炎、淀粉样变性和轻链沉积疾病中可以看到类似于结节性和弥漫性病变。因此,特异性染色、免疫荧光染色、电子显微镜检查结合患者的临床病史将有助于诊断。
自然病史
Kussman 等人基于研究发现,在 T1DM 诊断后 11 ~ 23 年出现蛋白尿,在 13 ~ 25 年后血清肌酐开始增加,在 18 ~ 30 年后发展为 ESRD。而更加敏感的尿白蛋白排泄检测发现,在 DM 诊断后 5 ~ 10 年,大多数患者在发生大量白蛋白尿(>300 mg/g 肌酐)之前就存在微量白蛋白尿(30~300 mg/g 肌酐)。
微量白蛋白尿和大量白蛋白尿分别被 KDIGO 指南称为 A2 和 A3。纵向研究 T2DM 患者的自然病史与 T1DM 患者基本相同。但是,T2DM 患者的发病时机很难评估,在诊断之前,患者可能就已经出现蛋白尿,并且肾活检有 DN 病变。另外,大血管并发症可以发生在 T2DM 患者病程中的任何时刻,而 T1DM 患者发展为晚期肾病才明显。
肾功能恶化和 DN 进展的最大预测指标是蛋白尿。
根据对 20 世纪 80~90 年代进行的 T2DM 患者的队列分析发现,心血管死亡比 ESRD 更频繁。然而,最近研究显示,ESRD 的风险显著高于心血管死亡和全因死亡率。这可能说明旨在减少 DM 或心血管疾病并发症的多种疗法,已经充分降低了大血管并发症的发生率,从而使更多的患者进展至 ESRD。
最近有报道指出,尽管活检证实为 DN,但高达 25% 的 T2DM 患者和肾功能减退的患者很少或没有蛋白尿。造成这种变化的原因尚不清楚。可能和长期 RAS 抑制剂治疗、未诊断的急性肾损伤或影响前述传统自然史的其他因素有关。
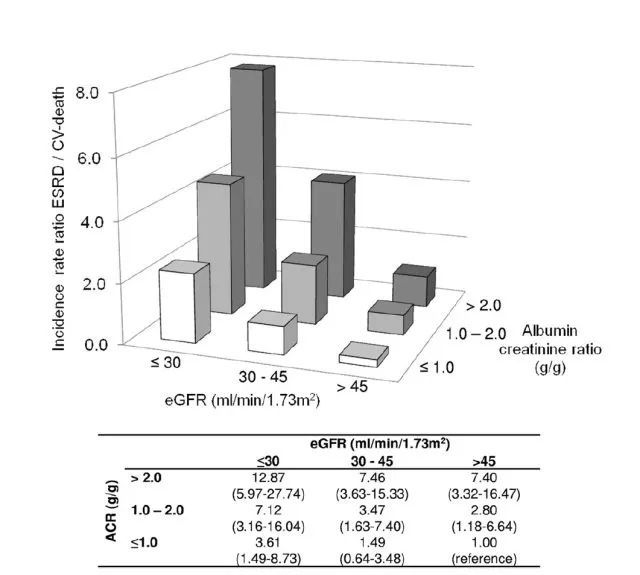
终末期肾病风险与 eGFR 降低和 ACR 增加的关系
糖尿病肾病的诊断
对于伴有 DM 和肾病证据(例如蛋白尿、血尿或 eGFR 下降)的患者,最重要的是鉴别是否为 DN 合并其他肾脏疾病。
对于 T1DM 患者,自然病程和进展时间线有助于 DN 的诊断。在 T1DM 诊断之前 5 年或之后 25 年出现显著白蛋白尿,发生 DN 的可能性降低。此外,95% 的 T1DM 和 DN 患者患有糖尿病视网膜病变,因此缺乏视网膜病变可能意味着不是 DN。由于眼科检查不敏感,因此必须获得 7 个视野的眼底照片并加强肾活检。
对于 T2DM 患者,视网膜病变仅与约 60% 至 65% 的病例中的 DN 相一致。因此,缺失视网膜病变不会对 DN 的诊断产生高的阴性预测值。此外,T2DM 的发病一般是未知的,所以不能可靠地使用自然史时间线来辅助诊断。医师需要通过包括病史、体格检查以及实验室和影像学检查,以确定肾活检是否有益。
关于什么时候开展 DM 患者的肾活检没有正式的实践指南。
糖尿病肾病的治疗
DN 的治疗可分为 4 大领域:
降低心血管风险
控制血糖
控制血压
抑制肾素 - 血管紧张素系统(RAS)
降低心血管病风险
DN 患者必然有 DM,因此不仅具有较高的心血管疾病风险,而且有肾衰竭的风险。治疗方法包括戒烟和降脂治疗。由于这些治疗方法对改变肾脏疾病疗效的数据不足,本综述不详述。
控制血糖
对于 T1DM 患者,大型研究和循证医学证据显示,血糖控制对微血管并发症的有益作用是显着且持久的。
对于 T2DM 患者,数据并不明了。最近的三项大型研究显示,强化血糖控制对于心血管风险和肾脏没有益处,除了 1 项试验显示白蛋白尿减少,但对保护肾功能并没有益处。而 HbA1c 浓度接近 6.0% 时,3 项试验都显示强化血糖控制相关的低血糖事件增加。因此,强化血糖控制至 HbA1c 水平为 7.0% 可防止微血管(非大血管)并发症(UKPDS),但是目前还不清楚进一步降低 HbA1c 水平是否有用,特别是对于肾病的预防。
根据现有证据,早期患者应该强化血糖控制,目标是 HbA1c 水平为 7.0%,以减少微血管并发症和 DN 进展。任何进一步降低的益处都未经证实,并可能使患者处于低血糖事件的风险中。这与目前的美国糖尿病协会(ADA)和 KDOQI 临床实践指南一致。
控制血压
根据现有证据,显著降低血压对于 DN 患者的治疗非常重要。心血管事件发生率和肾脏事件发生率随着血压升高而增加,随着治疗而降低。
目前的 KDOQI 指南推荐目标血压 <130/80 mmHg,而 JNC8 指南建议对大多数 T2DM 和 DN 患者的目标血压为 <140/90 mmHg,但需要个体化。我们建议应进一步加强降压治疗,目标血压 <140/90 mmHg。为了实现这一目标,应该在治疗方案中加入 1~2 个降压药物。
抑制肾素 - 血管紧张素系统(RAS)
RAS 抑制已被证明是减缓 DN 进展的最有效的单一疗法。现有证据支持使用 RAS 阻断剂治疗 DN 患者,以减缓 DN 进展和额外的血压控制。虽然 RAS 阻滞剂对降低蛋白尿有效,但其不良事件(高钾血症、急性肾损伤和心血管事件增加)以及无法预防 ESRD 的特性,阻碍了其使用。
新兴疗法
目前已经尝试针对多种损伤分子机制(包括炎症、纤维化和细胞外基质沉积)的多种疗法,但迄今取得成功者极少。
使用第三代盐皮质激素受体拮抗剂(曲格列酮)90 天,可减少 DN 的蛋白尿,并且没有显著的安全性问题。正在进行的临床试验将确定白蛋白尿的减少是否会有效预防 DN 发展和 ESRD 发展。
钠葡萄糖协同转运蛋白 2(SGLT2)抑制剂是已批准用于治疗糖尿病的相对较新的药物。其作用机制是阻断近端小管中的葡萄糖和钠摄取,从而产生钠尿和糖尿排泄。近日,以心血管安全性为目的的两项研究(EMPA-REG 和 CANVAS)显示,SGLT2 抑制剂可显著减少心血管疾病的危险,还显示 SGLT2 抑制剂对肾脏结局有积极影响,但这些是在评估心血管安全性的试验中是次要结果。目前有多项正在进行的肾脏结局试验在研究 SGLT2 抑制剂对减缓 DN 进展的有效性。
最后,目前正在研究的用于治疗 DN 的其他干预措施还包括降低尿酸和碳酸氢盐水平。
治疗的其它注意事项
除了降低心血管风险、控制血糖、控制血压以及抑制 RAS 之外,在 DN 患者的治疗中还有一些独特的问题需要考虑:
(1)30% 到 45% 的胰岛素被肾脏代谢并清除。因此,随着肾功能降低,胰岛素持续作用时间更长,使患者处于低血糖发作的危险中;
(2)大多数口服降血糖药物被肾代谢和清除。因此,随着肾功能降低,这些药物和胰岛素的剂量通常必须降低;
(3)如果发生低血糖症,可能需要持续较长时间,因此需要住院观察;
(4)二甲双胍禁用于 eGFR<30 mL/min/1.73 m2 的患者,因为这些患者与严重乳酸性酸中毒相关;
(5)许多较新的口服和注射糖尿病药物应注意剂量调整,这些新药中有两类,即二肽基肽酶 4(DPP-4)和 SGLT2 抑制剂,已经证实了心血管疾病的益处。因此,应该熟悉这些药物及其在肾功能减退的患者中的剂量;
(6)IV 型肾小管性酸中毒在 DM 患者中常见。因此,任何肾功能水平的 DN 患者都有高血钾和代谢性酸中毒的风险。这种特定的肾小管运输缺陷可以用低钾饮食、利尿剂和补充碱来治疗。治疗这种疾病对于这些患者能够接受持续不间断的 RAS 阻断药物疗法至关重要,否则这些药物会因高钾血症而剂量受限或完全排除;
(7)碘化放射造影剂、容积减少或非甾体抗炎药,会使 DN 患者发生急性肾损伤的风险增加;
(8)DM 也是动静脉瘘成熟失败的已知风险因素。与所有 4 期 CKD 患者一样,透析通路规划至关重要。
看完这些最新的知识点,做几道题目来挑战一下自我吧!
问题一:
52岁女性,1年前诊断为2型糖尿病,3个月前发现蛋白尿,有家族史。体格检查显示血压为140/95 mmHg,眼底检查正常,其他无明显表现。 实验室研究显示血清肌酐浓度为0.9mg / dL(79.6μmol/L),尿液分析显示蛋白质(3+)具有不显著的沉积物。
问题二:
一名患有2型糖尿病的48岁肥胖非裔美国女性。目前每天使用二甲双胍500 mg,每日两次,赖诺普利20 mg。血压为129/74 mm Hg,体检结果无其他表现。主要实验室结果包括:钾,4.7 mEq / L,血清肌酐,0.9 mg / dL(79.6μmol/L);白蛋白-肌酐比率,400mg / g;和糖化血红蛋白(HbA1c),9.1%。
问题三:
一名52岁的2型糖尿病患者伴白血病并发视网膜病变、神经病变和CKD 3期。 目前每天用胰岛素和40 mg赖诺普利治疗。 BP为150/95 mm Hg,检查结果无其他表现。主要实验室值包括:血钾,4.7 mEq / L;血清肌酐,1.5 mg / dL(132.6μmol/L);白蛋白-肌酸酐比率,800mg / g;和HbA1c 7.1%。
问题四:
一名45岁的非裔美国男子在肾脏病诊所进行初步评估。他有2年的2型糖尿病,并且控制得很好。他还报告了过去5年的高血压,并且一直处于良好的控制之下。 BP是135/75 mm Hg。体检发现胫骨中部以下水肿(1+),无其他表现。使用二甲双胍 1000 mg bid 以及 氯噻酮 25 mg qd 控制血压。主要实验室值如下:血钾,4.1 mg / dL;血清肌酐,1.3 mg / dL(114.9 μmol/L);白蛋白-肌酐比率,1257mg / g和HbA1c 6.9%。
答案见下期
参考文献:
Update on Diabetic Nephropathy: Core Curriculum 2018. AJKD.2018.Feb.
编辑 | 徐德宇