快速上手指南:非 ST 段抬高型急性冠脉综合征
在 2017 年 5 月的《中华心血管病杂志》上,中华医学会心血管病学分会、中华心血管病杂志编辑委员会发布了最新的《非 ST 段抬高型急性冠状动脉综合征诊断和治疗指南(2016)》。笔者整理了阅读笔记,带诸位一览其中的关键知识点。
非 ST 段抬高型急性冠状动脉综合征(non-ST—segment elevation acute coronal syndrome,NSTE - ACS)的病理生理基础主要为冠状动脉严重狭窄和(或)易损斑块破裂或糜烂所致的急性血栓形成,伴或不伴血管收缩、微血管栓塞,从而引起冠状动脉血流减低和心肌缺血。

诊断
1. 临床表现
以加拿大心血管病学学会(CCS)的心绞痛分级为判断标准。
1)长时间(>20 min)静息性心绞痛;
2)新发心绞痛:表现为自发性心绞痛或劳力型心绞痛(CCS Ⅱ或Ⅲ级);
3)过去稳定性心绞痛最近 1 个月内症状加重,且具有至少 CCS III 级的特点(恶化性心绞痛);
4)心肌梗死后 1 个月内发作心绞痛。
其中,典型胸痛的特征是:胸骨后压榨性疼痛,并且向左上臂(双上臂或右上臂少见)、颈或颌放射,可以是间歇性或持续性。不典型表现包括上腹痛、类似消化不良症状和孤立性呼吸困难,常见于老年人、女性、糖尿病和慢性肾脏疾病或痴呆症患者。
2. 体格检查
没有特殊表现。
1)非特异性体征:心肌缺血引起心功能不全时,可有新出现的肺部啰音或啰音增加、第三心音。
2)鉴别诊断:非心源性胸痛的相关表现(例如主动脉夹层、急性肺栓塞、气胸、肺炎、胸膜炎、心包炎和心脏瓣膜病等)。
3. 诊断方法
(1)心电图
检查时机:首诊 10 min 内应进行 12 导联心电图检查;如果患者症状复发或诊断不明确,则复查(I,B);如果怀疑患者有进行性心肌缺血,且常规 12 导联心电图结论不确定,建议加做 V3R、V4R、V7~V9 导联(I,C)。
特征性改变:ST 段下移、一过性 ST 段抬高和 T 波改变。
(2)生物标志物
cTn:最敏感和最特异,是诊断和危险分层的重要依据之一。
肌酸激酶同工酶:心肌梗死后迅速下降,可补充判断心肌损伤的时间和诊断早期再梗死。
高敏肌钙蛋白 (high-sensitivity cardiac troponin,hs-cTn):预测急性心肌梗死,可减少「肌钙蛋白盲区」时间,故建议 60 分钟内获得结果(I,A)。
(3)诊断与排除诊断流程(图 1、图 2)
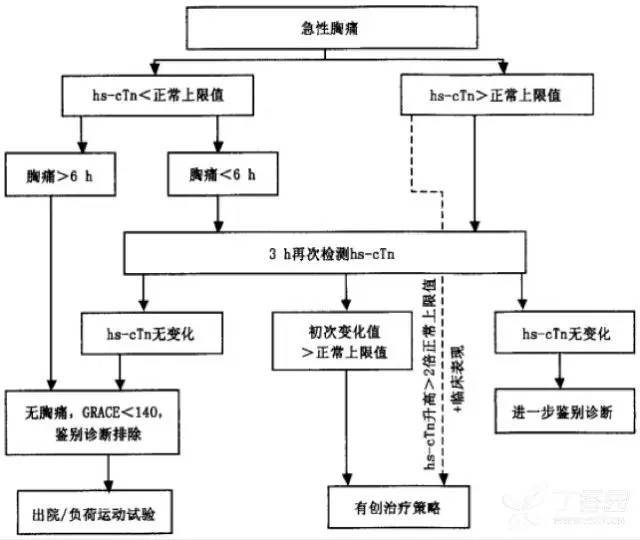
图 1 通过 hs-cTn 检测对 NSTE - ACS 患者进行 0h/3h 诊断和排除的方案
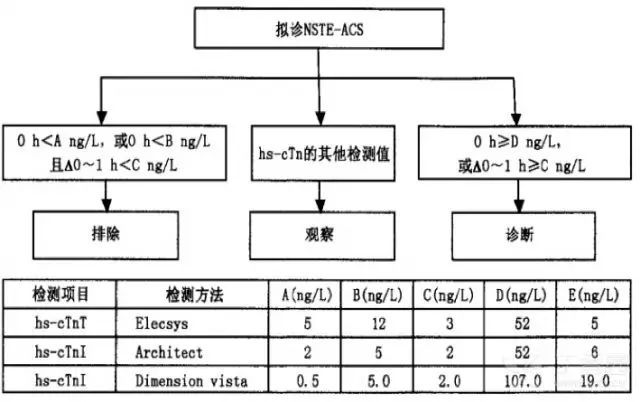
图 2. 通过 hs-cTn 检测对 NSTE-ACS 患者进行 0h/1h 诊断和排除的方案
(4)无创影像学检查
无创药物或运动负荷检查(I,A)、超声心动图(I,C)、冠状动脉 CT 血管成像(IIa,A)。

危险分层
建议根据上述临床检查结果,需做出初始诊断和最初的缺血性及出血性风险分层(I,A)。
1. 临床表现
(1)临床风险特征:如高龄,糖尿病和肾功能不全;
(2)临床表现:如静息性胸痛,胸痛频繁发作,就诊时心动过速、低血压、心力衰竭和新出现的二尖瓣反流等,提示预后不良。
2. 心电图表现
ST 段下移的导联数和幅度与心肌缺血范围呈正相关;ST 段压低伴短暂抬高,则风险更高。
3. 生化指标
(1)hs – cTn
类型:hs - cTnT 的预后价值优于 hs – cTnI;
升高幅度:与长期预后相关 (I,B);
动态变化:第 3 天或第 4 天复测 cTn,评估梗死面积和心肌坏死的动态变化(IIb,B);
(2)新型生物标志物
尤其是 B 型利钠肽,可提高对预后判断的准确性(Ⅱb,B)。
4. 缺血风险评估
(1)评分工具(I,B)
常用 GRACE 风险评分和 TIMI 风险评分。
GRACE 风险评分:最准确的风险评估。参数包括:年龄、收缩压、脉率、血清肌酐、就诊时的 Killip 分级、入院时心跳骤停、心脏生物标志物升高和 ST 段变化。
TIMI 风险评分:包括 7 项指标(每项 1 分),即年龄 ≥ 65 岁、≥ 3 个冠心病危险因素(高血压、糖尿病、冠心病家族史、高脂血症、吸烟)、已知冠心病(冠状动脉狭窄 ≥ 50%)、过去 7 天内服用阿司匹林、严重心绞痛(24h 内发作 ≥ 2 次)、ST 段偏移 ≥ 0.5 mm 和心肌损伤标志物升高。
(2)心电监测
建议持续心电监测,直到明确诊断或排除 NSTEMI(I,C):
心律失常风险低危的 NSTEMI 患者,心电监测 24h 或直至 PCI(Ⅱa,C);
心律失常风险中至高危的 NSTEMI 患者,心电监测 > 24h(II a,C)。
5. 出血风险评估 (Ⅱb,B)
(1)CRUSADE 评分
基线特征:女性、糖尿病史、周围血管疾病史或卒中;
入院时的临床参数:心率、收缩压和心力衰竭体征;
入院时实验室检查:血细胞比容、校正后的肌酐清除率。
(2)ACUITY 评分
包括 6 项独立的基线预测因素(即女性、高龄、血清肌酐升高、白细胞计数、贫血和 NSTEMI 或 STEMI 表现)和 1 项与治疗相关的参数(使用普通肝素和血小板糖蛋白 Ⅱb/IIIa 受体拮抗剂而不是单用比伐卢定)。
但是,目前尚不明确药物治疗或口服抗凝药(oral anticoagulant,OAC)治疗时上述评分方法的价值。

治疗
1. 一般治疗
辅助氧疗(I,C)、吗啡止痛(Ⅱb,B);但不予非甾体类抗炎药物(阿司匹林除外),以防主要心血管事件的发生风险增高(Ⅲ,B)。
2. 抗心肌缺血药物治疗
(1)硝酸酯类
舌下或静脉(如患者有反复心绞痛发作、难以控制的高血压或心力衰竭;I,C)使用。
(2)β受体阻滞剂:
使用建议:早期(24 h 内)(I,B)、长期使用(目标:静息心率 55~60 次/min)(I,B)。从小剂量开始,并逐渐增至最大耐受剂量。
禁忌证:有心力衰竭症状、低心排综合征、进行性心源性休克风险、怀疑冠状动脉痉挛或可卡因诱发的胸痛患者。
(3)钙通道阻滞剂(CCB)
1)非二氢吡啶类 CCB
适用:持续或反复缺血发作、并且存在 β 受体阻滞剂禁忌的患者的初始治疗。
禁忌:有严重左心室功能障碍、心源性休克、PR 间期 > 0.24s 或二、三度房室传导阻滞而未置入心脏起搏器的患者(I,B)。
2)二氢吡啶类 CCB
适用:应用 β 受体阻滞剂和硝酸酯类药物后,仍然存在心绞痛症状或难以控制的高血压的患者(I,C);可疑或证实血管痉挛性心绞痛的患者(联用 CCB 和硝酸酯类药物)(IIa,B)。
(4)尼可地尔
适用于对硝酸酯类不能耐受的 NSTE-ACS 患者(I,C)。
(5)肾素-血管紧张素-醛固酮系统抑制剂
1)ACEI:所有 LVEF < 40%、高血压病、糖尿病或稳定慢性肾脏病的患者(I,A);但急性心肌梗死的前 24h 内应谨慎使用。
2)ARB:对 ACEI 不耐受的 LVEF < 40% 的心力衰竭或心肌梗死患者(I,A);
3)醛固酮受体拮抗剂:心肌梗死后正在接受治疗剂量的 ACEI 和 β 受体阻滞剂且合并 LVEF ≤ 40%、糖尿病或心力衰竭,且无肾功能不全(男性血肌酐 < 212.5 μmol/L 或女性血肌酐 < 170μmol/L)或高钾血症的患者。
3. 抗血小板治疗
(1)阿司匹林:抗血小板治疗的基石。首剂负荷量 150~300 mg,长期口服 75~100 mg/d(I,A)。
(2)P2Y12 受体抑制剂:联用阿司匹林,维持至少 12 个月(I,A)。
替格瑞洛:负荷剂量 180 mg,维持量 90 mg、2 次/d。
氯吡格雷:负荷剂量 300~600 mg,维持量 75 mg/d(I,B)。
给药时机:尽早用药。
用药监测:综合考虑有效性和经济成本,暂不推荐常规进行血小板功能检测和 CYP2C19 功能缺失的基因检测。
(3)双联抗血小板治疗的时间
NSTE - ACS 患者,DAPT 治疗至少 1 年,根据缺血或出血风险的不同,予选择性缩短或延长。
接受药物保守治疗、置入裸金属支架(BMS)或药物涂层支架(DES)的患者:至少 12 个月(I,B);
能耐受双联抗血小板治疗(DAPT)、未发生出血并发症且无出血高风险(如曾因 DAPT 治疗、凝血功能障碍、使用 OAC 出血)的患者, DAPT 可维持 12 个月以上(IIb,A);
DES 置入后接受 DAPT 且伴有出血高风险(如接受 OAC 治疗)、严重出血并发症高风险(如重大颅内手术)或伴有明显出血的患者,治疗 6 个月后停用(IIb,C);
(4)提前终止口服抗血小板治疗
服用 P2Y12 受体抑制剂且需进行择期非心脏手术的患者,术前至少停服 5 天(Ⅱa,C)。
择期非心脏手术应延迟到 BMS 置入 30 天后、DES 置入 6 个月后进行(I,B),术后尽早恢复用药(I,C)。
不能推迟的非心脏手术或存在出血并发症时,置入 BMS 最短 1 个月或 DES 最短 3 个月后停用(Ⅱb,C)。
对围术期需要停止 DAPT 治疗的患者,BMS 置入后 30 天内、DES 置入后 3 个月内不应进行择期非心脏手术(Ⅲ,B)。
近期置入支架、非心脏手术前停用 P2Y12 受体抑制剂的患者,GPI(如替罗非班)作为桥接治疗。
(5)GPI:替罗非班。PCI 过程中使用 GPI,尤其是高危(cTn 升高、合并糖尿病等)或血栓并发症患者(II a,C)。不建议早期常规使用 GPI(Ⅲ,A)。
4. 抗凝治疗
(1)急性期:推荐抗凝联合抗血小板治疗。
普通肝素:NSTE - ACS 患者冠状动脉造影前的短期抗凝,70-100 U/kg(I,B),术中可在活化凝血时间(ACT)指导下追加普通肝素(ACT ≥ 225s)(Ⅱb,B)。
低分子肝素:常用依诺肝素。如果最后一次皮下注射距离 PCI 的时间 < 8h,则不需要追加依诺肝素;反之,则需追加依诺肝素(0.3 mg/kg)静脉注射。
磺达肝癸钠:2.5 mg/d 皮下注射,药效和安全性最好(I,B)。建议 PCI 术中一次性静脉推注普通肝素 85 U/kg 或在联合应用 GPI 时推注普通肝素 60 U/kg(I,B)。
比伐卢定:抗凝可预测性高。
(2)急性期后的抗凝治疗
适用:无卒中/TIA、高缺血风险,有低出血风险的 NSTEMI 患者,可改用阿司匹林、氯吡格雷或低剂量利伐沙班(2.55 mg、2 次/d)治疗,持续约 1 年(Ⅱb,B)。
禁忌:既往有缺血性卒中或 TIA 的患者。
5. 需长期 OAC 治疗患者抗血小板治疗的建议
(1)接受 PCI 的患者
抗凝治疗: PCI 术中额外给予肠外抗凝药(I,C);围术期可不中断使用 VKA 或 NOAC(Ⅱa,C)。
抗血小板治疗:PCI 后,对 NSTE - ACS 且 CHA2DS2-VASc 评分 1 分 (男性) 或 2 分 (女性) 的房颤患者,可将 DAFT 作为三联抗栓治疗的替代治疗(Ⅱa,C)。
a. 低出血风险(HAS-BLED 评分 ≤ 2):可使用 OAC、阿司匹林(75~100 mg/d)和氯吡格雷(75 mg/d)三联治疗 6 个月,然后 OAC 联合阿司匹林(75~100 m/d)或氯吡格雷(75 m/d)维持至 12 个月(II a,C)。
b. 高出血风险(HAS-BLED评分 > 2):无论支架为何种类型(BMS 或新一代 DES),OAC、阿司匹林和氯吡格雷三联治疗维持 1 个月,然后 OAC 联合阿司匹林或氯吡格雷维持至 12 个月(II a,C)。
c. 支架类型:需服用 OAC 的患者,首选新一代 DES(IIa,B)。
冠状动脉造影检查期间应避免中断 OAC;
尽量缩短三联抗栓的时间并同期使用质子泵抑制剂保护胃黏膜;
氯吡格雷联合 OAC 可考虑作为高出血风险患者三联抗栓治疗的替代方案。
(2)接受药物治疗或 CABG 的患者:
药物治疗:1 种抗血小板药物联合 OAC 使用 1 年(Ⅱa,C)。
择期 CABG 者:术前 48h 停用 NOAC; CABG 术后控制出血后,尽早恢复抗血小板(通常为阿司匹林)和抗凝药物,避免使用三联抗栓治疗。
6. 他汀类药物治疗
早期、长期使用他汀治疗(I,A)。对已接受中等剂量他汀治疗但低密度脂蛋白胆固醇(LDL-C)仍 ≥ 1.8 mmol/L 的患者,可增加他汀剂量或联合依折麦布进一步降低 LDL - C(Ⅱa,B)。
7. 血运重建治疗
(1)侵入性治疗策略
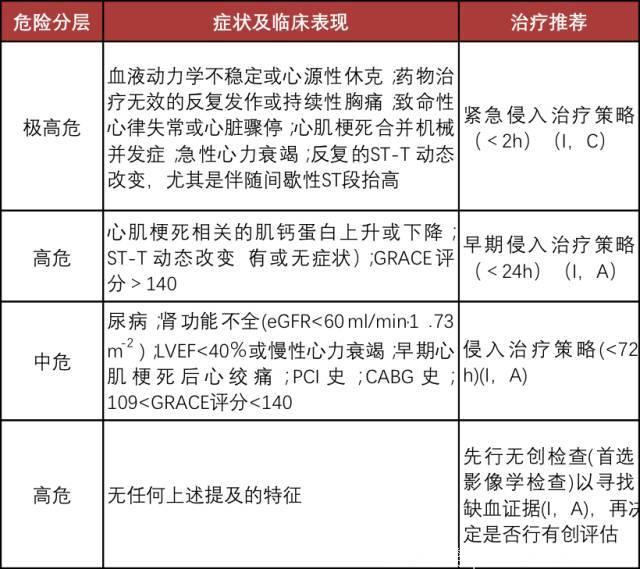
(2)保守治疗
1)冠心病患者
非阻塞性冠心病;不适合血运重建治疗的冠心病患者。
2)冠状动脉造影正常的患者
a. 应激性心肌病:特点是具有与心肌梗死相似的胸痛、心肌酶升高、短期左心室功能不全,但冠状动脉造影正常;
b. 冠状动脉血栓栓塞:机制可能是系统性疾病导致动脉血栓形成或心源性栓塞、其他疾病如卵圆孔未闭导致的体循环栓塞;
c. 冠状动脉痉挛;
d. 冠状动脉微血管病变:特点是典型的劳力型心绞痛、负荷试验表现为心电图 ST 段压低(提示心内膜下缺血)和冠状动脉造影表现为非闭塞性病变;
e. 自发性冠状动脉夹层:病因不明,临床罕见,治疗尚存争议。
(3)PCI:
入路:桡动脉路径(I,A)。
策略选择:基于临床状况、合并疾病和病变严重程度(包括分布、病变特点和 SYNTAX 评分)(I,C),建议在 NSTE - ACS 患者应用新一代 DES。
(4)CABG
适应证:左主干或三支血管病变且左心室功能减低(LVEF<50%)的患者(尤其合并糖尿病时),双支血管病变且累及前降支近段伴左心室功能减低(LVEF<50%)或无创性检查提示心肌缺血患者(I,A),强化药物治疗下仍有心肌缺血而不能进行 PCI 的患者(I,B)。
急诊 CABG:首选 PCI, PCI 不成功或不适合时,再选急诊 CABG。
非急诊 CABG:稳定后的 NSTE - ACS 患者进行非急诊 CABG 的时机应个体化。
需 CABG 的 NSTE - ACS 患者围术期抗血小板治疗:
a. 建议一种 P2Y12 受体抑制剂联合阿司匹林维持治疗超过 12 个月(I,A);
b. 血液动力学不稳定、持续心肌缺血或极高危冠状动脉病变者,不应推迟 CABG 时机(I,C);
c. 在无持续出血事件的情况下,建议 CABG 后 6-24h 使用阿司匹林(I,A)小剂量持续至 CABG 前(I,B);
d. 双联抗血小板治疗并且明确需行 CABG 的患者,术前应用替格瑞洛和氯吡格雷 5 天(Ⅱa,B);
e. 正在接受 DAFT 且拟行 CABG 的患者,CABG 术后继续接受 P2Y12 受体抑制剂治疗至 DAPT 达 12 个月(I,C)。
(5)心源性休克的治疗
合并顽固性心绞痛、ST 段改变或心源性休克的急性心力衰竭患者,紧急冠状动脉造影(I,B)。
合并心源性休克的患者,如果冠状动脉解剖条件适合,建议采取即刻 PCI(I,B);若不适合 PCI,建议行紧急 CABG(I,B)。
机械性并发症导致血液动力学不稳定和 (或) 心源性休克的患者,建议主动脉内球囊反搏术(IIa,C)。
合并心源性休克的患者:短时间机械循环支持(Ⅱb,C)。

出血并发症的处理
1.一般支持措施:维持动脉血压在可接受的低正常水平(即控制性低血压);但目前还不明确控制性低血压多长时间是安全的。
2.服用抗血小板药物期间的出血事件:输注 2~5 U 血小板可恢复受阿司匹林抑制的血小板聚集功能。
3.服用 VKA 期间的出血事件:采用浓缩的 Ⅸ 因子凝血酶原复合物,并反复缓慢静注 10 mg 维生素 K(Ⅱa,C)。
4.服用 NOAC 期间的出血事件:采用浓缩的凝血酶原复合物或有活性的凝血酶原复合物(Ⅱa,C)。
5.PCI 相关出血事件:重在预防,其余根据病史予对症治疗。
6.CABG 相关的出血:输注浓缩血小板。
7.输血治疗:血液动力学不稳定或红细胞比容 < 25% 或血红蛋白水平 < 70 g/L 时输血(II b,C)。

特殊人群和临床情况
1. 老年
(1)抗栓治疗:根据体重和肾功能制定(I,C)。
(2)血运重建:需谨慎评估潜在风险和获益、预期寿命、合并疾病、生活质量、体质和患者的价值观与喜好(II a,A)。
(3)CABG:适合的老年 NSTE - ACS 患者,尤其是合并糖尿病或复杂三支血管病变(如 SYNTAX 评分 > 22 分),无论是否涉及前降支近段病变的冠状动脉疾病患者(II a,B)。
(4)联合调整用药:β 受体阻滞剂、ACEI、ARB 和他汀类药物剂量(IIa,C)。
2. 女性
(1)住院期间和二级预防:与男性相同。
(2)调整剂量:根据体重和(或)肾功能(I,B)。
(3)早期有创治疗:
高危的 NSTE - ACS 女性患者(如 cTn 阳性)(I,A)。合并妊娠者,如果抗缺血药物不能控制症状和危及生命的并发症时,行冠状动脉血运重建治疗(II a,C)。
低危 NSTE - ACS 女性患者,不应实施早期有创治疗(Ⅲ,B)。
3. 糖尿病
原则是较为宽松的血糖控制。
(1)糖尿病筛查:所有 NSTE -ACS(I,C)。
(2)治疗:
a. 降糖治疗:血糖 >10 mmol/L 者;
b. 抗栓治疗(I,C);
c. 有创策略优先于无创治疗(I,A):
接受 PCI 的患者:新一代 DES 优先于 BMS(I,A);
稳定的多支血管病变且手术风险可接受的患者:CABG 优先于 PCI(I,A);
合并基线肾功能损伤或正在使用二甲双胍的患者:冠状动脉造影或 PCI 后,监测肾功能 2~3 天(I,C)。
4. 慢性肾病
(1)评估肾功能:所有患者的 eGFR(I,C)。
(2)治疗:
a. 抗凝:根据对肾功能不全的分级,建议调整肠外抗凝药为普通肝素、磺达肝癸钠、依诺肝素、比伐卢定或小分子 GPI 的剂量(I,B)。
b. 有创治疗者:生理盐水水化、并使用低渗或等渗对比剂(最小剂量)(I,A)。
多支病变、手术风险可接受并且预期寿命 >1 年的患者,CABG 优先于 PCI(IIa,B);
多支病变、手术风险高或预期寿命<1 年的患者:PCI 优先于 CABG(Ⅱa,B)。
5. CABG 术后患者
抗血小板治疗、抗凝治疗,并早期有创治疗(I,B)。
适当放宽 CABG 术后 NSTE-ACS 患者行冠状动脉造影的限制。
6. 贫血
(1)危险分层时测定血红蛋白(I,B)。
(2)有创治疗:慎重考虑。
(3)抗栓治疗:优先选择短效或可逆制剂。
7. 变异性心绞痛
(1)单独使用 CCB 或联合使用长效硝酸酯类:治疗并且减少发作(I,B);
(2)他汀类药物、戒烟和控制其他动脉粥样硬化危险因素:治疗(I,B);
(3)发作性胸痛伴一过性 ST 段抬高的患者:冠状动脉成像检查(有创或无创)(I,C)。冠状动脉造影示严重病变的变异性心绞痛患者,不建议行药物激发试验(Ⅲ,B)。
(4)非药物性激发试验:诊断。
8. 左心室功能不全和心力衰竭
(1)LVEF ≤ 40% 的患者稳定后,建议用 ACEI(不耐受 ACEI 者可换用 ARB))(I,A) 或 β 受体阻滞剂(I,A)。
(2)所有有持续症状(NYHA Ⅱ~Ⅳ 级) 和 LVEF ≤ 35% 的患者:盐皮质激素受体拮抗剂(I,A)。
(3)LVEF ≤ 40% 的患者:醛固酮受体拮抗剂(I,B)。
(4)严重左心功能不全(LVEF ≤ 35%)、有左心室收缩不同步的证据、且在发生急性事件后予以药物治疗 > 40 天但无法选择血运重建的有症状患者:器械治疗(基于 QRS 时限的心脏再同步治疗除颤器或植入式心脏复律除颤器)。
(5)有冠状动脉疾病且 LVEF ≤ 35% 的患者:考虑残余心肌缺血评估和血运重建之后连续 6 个月评估左心室重构逆转情况,以确定是否适合实施 ICD/CRT - D(II a,B)。
9. 心房颤动
抗凝药物:所有确诊的心房颤动患者(I,A)。
合并心房颤动和 cTn 升高的患者:评估心肌缺血(II a,C)。
合并快心室率且血液动力学不稳定的心房颤动患者:电复律(I,C)。
首次心房颤动 <48 h(或者经食管超声心动检查无明确左心房附壁血栓),或接受抗凝治疗至少 3 周,并在非紧急恢复窦性心律情况下:电复律或胺碘酮转复(I,C)。
血液动力学稳定的患者:静脉注射 β 受体阻滞剂(I,C)。无效时,静脉用强心苷类药物控制心室率(Ⅱb,C)。
未使用 β 受体阻滞剂并且没有心力衰竭体征时:静脉应用非二氢吡啶类 CCB(维拉帕米、地尔硫卓)控制快速心室率(Ⅱb,C)。
10. 血小板减少
(1)血小板减少到 <100 G/L(或者较血小板计数基础值下降 > 50%):立刻停用 GPI 和(或)肝素(I,C)。
(2)接受 GPI 治疗的患者:活动性大出血事件或存在严重的无症状性血小板减少(<10×109/L)时,输注血小板(I,C)。
(3)明确怀疑有肝素诱导的血小板减少症(HIT):非肝素类(如比伐卢定)的抗凝治疗(I,C)。
(4) 特殊类型的血小板减少:
a. GPI 相关的血小板减少:
监测:初始给药的 8~12 h 检查血小板计数, 24h 复查。
治疗:如果血小板计数下降至 <100 G/L 或较基线水平降低 > 50%,应停止输注 GPI,必要时输注血小板。
b. HIT:血小板计数下降至<100 G/L 时(通常不会低于 10 G/L~20 G/L),需怀疑 HIT。
c. 非免疫介导的血小板减少:轻微,不需停药。
d. 免疫介导的血小板减少:严重,致死性血栓事件风险。
治疗:立即停药。
11. 非心脏外科手术
病因学治疗:纠正贫血、低血容量和控制感染等;
标准药物治疗:结合指南和疾病严重程度(I,C);
多学科合作:因为抗血小板和抗凝治疗可能受限于外科手术或合并疾病。

长期治疗
改善生活方式为主,包括戒烟、有规律的锻炼和健康饮食(I,A)。
1. 二级预防的药物治疗
降脂治疗:二级预防的基石。
降压治疗:舒张压目标值 < 90 mmHg(糖尿病患者 < 85 mmHg)(I,A);收缩压目标值 < 140 mmHg (Ⅱa,B)。
糖尿病患者的降糖治疗:一般原则是,心血管病越严重,年龄越大、糖尿病病程越长和合并症越多,血糖控制的越严格,糖化血红蛋白 < 7%(I,B)。
2. 生活方式改变和心脏康复
改变生活习惯,包括规律体育锻炼、戒烟和饮食咨询、有氧运动、运动耐量和运动风险的评估,提高治疗的依从性(Ⅱa,A)。
该指南的全文发布在《中华心血管病杂志》2017 年 5 月第 45 卷第 5 期上,在看完指南要点后,不妨再翻阅杂志细读全文。
心内科 40 句经典总结 轻松避开那些坑
一表总结:CCU 常用静脉泵入药物用法
编辑:任杨源
⬇️ ⬇️ ⬇️ 点击 阅读原文,即可进入丁香园心血管版块,指南资源、病例讨论、热门话题,就等你来!