溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021版本) — 要点一览
在临床工作中,多数医师对溶瘤病毒类药物的作用机制及循证医学证据缺乏足够的了解,临床应用缺乏统一规范,且目前国内外尚无溶瘤病毒在抗肿瘤治疗方面的专家共识。鉴于此,由上海市抗癌协会肿瘤免疫治疗专业委员会和中国医药生物技术协会许青教授、陆舜教授和陈健华教授牵头,组织上海数十位肿瘤生物免疫治疗基础与临床研究领域的专家,参考近年来溶瘤病毒在抗肿瘤治疗领域的基础与临床研究结果,结合专家们的实际临床工作经验,从溶瘤病毒的分类、抗肿瘤机制、临床应用的循证医学证据、使用方法、不良反应管理及疗效评估等方面,编写了《溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)》,近期发表在《中国癌症杂志》,以期为临床医师规范使用溶瘤病毒类药物提供参考。
溶瘤病毒是一类能选择性地感染并杀死肿瘤细胞而不损伤正常细胞的天然或重组病毒。与传统免疫治疗相比,溶瘤病毒治疗具有靶向性好、不良反应小、杀伤肿瘤途径多、不易产生耐药性等优势。多项临床研究显示,溶瘤病毒可为不同类型、不同进展阶段,甚至转移性和无法治愈的肿瘤患者带来临床获益。更重要的是,其与化疗、放疗、免疫治疗等联合应用时,具有协同增效的作用,可使原先对免疫检查点抑制剂等免疫治疗药物反应欠佳的瘤种变得敏感。
目前开发用于肿瘤治疗的溶瘤病毒类药物已有数十种,包括腺病毒(adenovirus)、 HSV-1、牛痘病毒(vaccinia virus)、呼肠孤病毒(reovirus)、新城疫病毒(newcastle disease virus)等。在2000—2020年发表的临床试验中,最常用的5种溶瘤病毒分别为腺病毒、HSV-1、呼肠孤病毒、牛痘病毒和新城疫病毒。本共识主要介绍已完成Ⅲ期临床研究并获批上市的两种溶瘤病毒类药物:H101(重组人5型腺病毒)和T-VEC(HSV-1)(表1)。
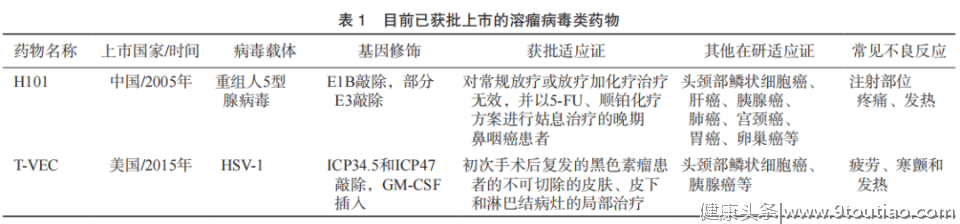
1.循证医学证据
已获批适应证
➤H101:鼻咽癌
中国一项多中心的Ⅲ期临床研究比较了瘤内注射H101联合化疗与单纯化疗的治疗效果及不良反应,研究共纳入160例头颈、食管鳞癌患者,其中91例为鼻咽癌,所有入选患者均接受化疗。结果显示,从目标病灶看,在符合试验方案并完成试验的123例患者中,H101联合化疗的完全缓解(complete response,CR)率和部分缓解(partial response,PR)率(CR+PR为有效)显著高于单纯化疗组(72.7% vs 40.4%),从受试者全身疗效看,联合组的有效率同样显著高于单纯化疗组(71.2% vs 35.1%)。试验期间发生的不良反应主要包括发热、注射部位局部反应、流感样症状、白细胞下降、血小板下降、肝肾功能异常、脱发和恶心呕吐等。
2005年,国家药品监督管理局批准溶瘤腺病毒药物H101联合化疗药物用于治疗晚期鼻咽癌,这也是全球第一个获批具有临床应用适应证的肿瘤溶瘤病毒治疗方案。
➤T-VEC:黑色素瘤
一项Ⅲ期临床试验将436例不能通过手术切除的ⅢB~Ⅳ期黑色素瘤患者以2∶1的比例随机分配至瘤灶内注射T-VEC组(n=295)和皮下注射GM-CSF组(n=141)。结果显示,病灶内注射T-VEC组患者的持续缓解率(durable response rate,DRR)(16.3% vs 2.1%,P<0.001)、客观缓解率(objective response rate,ORR)(26.4% vs 5.7%)和中位总生存期(overall survival,OS)(23.3个月 vs 18.9个月, P=0.051)均高于GM-CSF皮下注射对照组;且T-VEC的疗效在ⅢB期、ⅢC期或Ⅳ期(M1a期) 患者和既往未接受过治疗的患者中最为显著;与T-VEC使用相关的常见不良反应为疲劳、寒颤和发热,发生率≥2%的3或4级不良反应为蜂窝织炎(2.1%),无治疗相关致死性不良反应发生。
2017 年发表在 Cell 杂志上的一项Ⅰ期临床试验提出了一种新的联合用药方案,即溶瘤病毒联合程序性死亡[蛋白]- 1(programmed death-1,PD-1)抗体帕博利珠单抗 (pembrolizumab)治疗晚期黑色素瘤患者。结果表明,T-VEC联合帕博利珠单抗治疗的耐受性良好,常见不良反应为疲劳、发热和寒颤,未出现剂量限制性毒性。ORR为62%,CR率为33%;患者经联合治疗后CD8+ T细胞增加,PD-L1蛋白和IFN-γ表达量升高,提示溶瘤病毒治疗可通过改变肿瘤微环境来提高PD-1抗体的疗效。
一项Ⅱ期临床试验评估了T-VEC联合CTLA-4抑制剂治疗晚期黑色素瘤的安全性和有效性。结果显示,T-VEC和伊匹木单抗联合治疗组的ORR高于伊匹木单抗单药治疗组(39% vs 18%,P=0.002);联合组的反应并不局限于注射病灶;联合组脏器病变减少了52%,单药组减少了23%;常见不良反应包括疲劳(联合组为59%,单药组为42%)、寒颤(联合组为53%,单药组为3%)和腹泻(联合组为42%,单药组为35%);≥3级不良反应的发生率分别为45%和35%,无治疗相关致死性不良反应发生。
因此,对于手术不可切除的晚期黑色素瘤患者,可考虑使用T-VEC进行局部治疗。此外,T-VEC的应用可以增加免疫检查点抑制剂的抗肿瘤活性,在局部治疗的同时,推荐溶瘤病毒联合免疫检查点抑制剂治疗用于晚期恶性黑色素瘤。2015年美国FDA批准T-VEC用于手术切除后复发的黑色素瘤患者的局部治疗,这也是美国首次批准的肿瘤溶瘤病毒治疗方案。
02
探索适应证
➤H101:肝细胞癌
经 动 脉 化 疗 栓 塞 术 ( transarterial chemoembolization,TACE)是最常用于中晚期肝细胞癌患者的治疗方法。有研究回顾并分析了TACE单用或联合腺病毒H101治疗肝细胞癌的疗效,共纳入175例不能通过手术切除的肝细胞癌患者。结果显示,相比单用TACE(n=88),TACE联合H101的治疗方案(n=87)可显著延长患者的OS(12.8个月 vs 11.6个月,P=0.046)和PFS(10.49个月 vs 9.72个月,P=0.044),提高CR率(14.8% vs 28.7%,P=0.017)并降低疾病进展(progressive disease,PD)率(25.0% vs12.6%,P=0.011)。两组均未出现4级临床毒性或因肝衰竭导致的手术相关死亡(30 d),治疗后1个月内未出现严重并发症或3~4级肝脏毒性。两组治疗相关不良反应的发生率差异无统计学意义(P>0.05)。
2.使用方法

3. 疗效评估
目前临床常用的抗肿瘤药物疗效评价标准包括传统的WHO标准、实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)和在此基础上发展出的改良的RECIST(modified RECIST,mRECIST)(表3)。

4. 小结
作为一种新兴的肿瘤生物免疫治疗方法,溶瘤病毒已被中国及多个欧美国家的监管机构批准使用。溶瘤病毒通过多种机制杀死癌细胞。已有的大量临床研究证实其具有良好的临床安全用药记录,其对肿瘤细胞的感染增强了机体抗肿瘤免疫反应,并可产生较为持久的反应,溶瘤病毒与化疗、放疗、靶向治疗特别是免疫治疗相结合,可以提高原有药物的疗效。但肿瘤微环境中的系统和物理屏障目前仍然是影响溶瘤病毒临床疗效的主要障碍,这也是其未来基础与临床研究的焦点。相信随着未来研究的进展,会有更多的肿瘤患者从溶瘤病毒类药物治疗中获益。
参考文献:
许青, 陆舜, 朱蕙燕, 郑磊贞, 姜斌, 梁晓华, 赵任, 周箴, 王梅, 陈健华, 徐宇, 秦环龙, 魏于全. 溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)[J]. 中国癌症杂志, 2021, 31(3): 231-240.
转自:医脉通肿瘤科
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])