当肠道细菌改变大脑功能时,不自闭不抑郁不焦虑
到目前为止,肠道细菌可以影响一个人的健康的观点,已经不是什么新鲜事,相信很少人会再怀疑。许多人都知道肠道微生物会影响消化、过敏和新陈代谢。这一趋势几乎已经司空见惯。
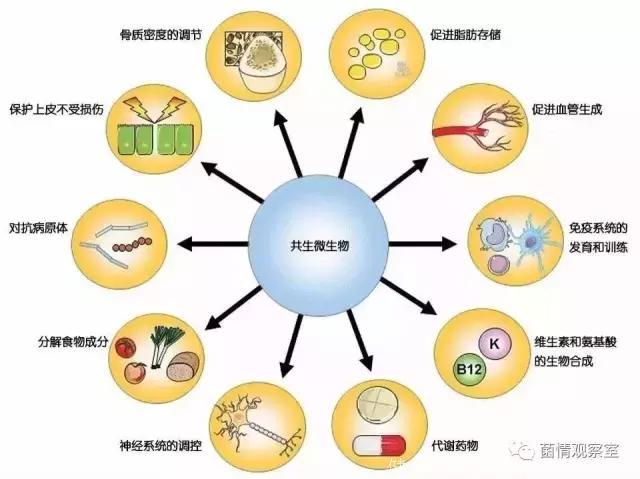
肠道微生物的触角也在进一步延伸,已经进入到我们的大脑。世界各地越来越多的研究开始关注肠道微生物是如何调控人们的思想和感受的。科学家们已经发现证据表明,肠道中上千种、数以万亿计、重达2-3公斤的细菌可能在自闭症、焦虑症、抑郁症、阿尔茨海默病、帕金森病、多发性硬化症以及其它神经系统疾病中发挥关键作用。
一些最有趣的研究是关于自闭症的。几十年来,医生、自闭症患儿父母和研究人员都注意到,大约四分之三的自闭症患者也有一些消化道异常,比如消化问题、腹泻便秘、食物过敏或麸质过敏等等。这一认识使科学家们开始研究肠道微生物与自闭症之间的潜在联系。一些研究发现自闭症患者的肠道菌群组成与健康对照差异显著。加州理工学院的微生物学家Sarkis Mazmanian专注于一种叫做脆弱拟杆菌(Bacteroides fragilis)的常见物种,这一物种在一些自闭症儿童中数量较少。2013年发表在《Cell》杂志上的一篇论文中,Mazmanian及其同事给母体免疫激活造成的具有类似自闭症症状的小鼠补充从人类中分离的脆弱拟杆菌,结果发现脆弱拟杆菌改变了小鼠的肠道菌群组成,更重要的是改善了它们的行为:它们变得不那么焦虑,与其它小鼠交流得更多,并且表现出较少的重复刻板行为。
究竟肠道微生物是如何与自闭症相互作用的,究竟是原因还是结果,仍有待进一步的研究。Mazmanian及其同事发现了一种可能的联系:一种叫做4-乙基苯基硫酸盐(4-ethylphenylsulphate,4EPS)的化学物质,似乎是由肠道细菌产生的;他们发现,有自闭症症状的小鼠血液中的4EPS水平比其它小鼠高40多倍。4EPS的水平与大脑之间的联系尚不清楚,但是当动物被注射这种化合物时,它们就会出现类似自闭症的症状。
这些结果表明,调节肠道菌群,至少在一部分患者中,可能是一种可行的治疗自闭症的方法。4EPS在这个过程中发挥了重要作用;这就像水流一样,如果你关掉产生这种化合物的水龙头,那么症状就会消失,我们就可能能够扭转这种疾病,这就是研究人员在小鼠模型中看到的结果。
科学家们也发现证据表明肠道细菌可以影响焦虑和抑郁。加拿大麦克马斯特大学肠胃病学研究人员Stephen Collins发现,乳酸杆菌和双歧杆菌菌株可以减轻小鼠的焦虑样行为。人类肠道中也携带有这两种细菌。在另一项研究中,Stephen Collins及其同事从一种平常活动较少的胆小的小鼠身上收集肠道细菌,然后将它们移植到另一种平常比较活跃的敢于冒险的小鼠中。结果发现,原本活跃的小鼠似乎变成了不那么活跃的“胆小鬼”。
总的来说,这两种微生物似乎都是肠-脑轴中肠道与大脑交流的主要参与者。爱尔兰科克大学的神经学家John Cryan已经在动物模型中研究了它们对抑郁症的影响。2010年发表在《Neuroscience》杂志上的一篇论文中,研究人员给小鼠提供了双歧杆菌或常见抗抑郁药西酞普兰;然后让小鼠接受一系列的应激事件,其中包括一项称为“强迫游泳”的试验,测试它们在一个没有出口的水箱中持续游泳的时间。双歧杆菌和西酞普兰都能有效地减少小鼠在强迫游泳实验中的不动时间,提高小鼠的耐力,并降低应激相关激素的水平,表明它们的抗抑郁作用。另一项实验中,研究人员使用的是乳酸菌,也发现有类似的结果;补充乳酸菌使小鼠变得更有冒险精神,而且受压力的影响更小,表明其抗焦虑作用。
到目前为止,大多数微生物影响大脑的研究都在小鼠身上进行的,但是也有一些涉及人类的研究。例如,研究人员将焦虑人群的肠道细菌转移到无菌小鼠中,移植后,这些小鼠也表现得更加焦虑。
其它研究也检查了整个人体的反应,而不仅仅是他们的肠道菌群。2015年5月,牛津大学神经生物学家Phil Burnet发表在《Psychopharmacology》杂志上发表的一篇论文中,研究人员研究了一种益生元对45名健康志愿者的压力水平的影响,益生元是为肠道细菌提供食物和营养的一组碳水化合物。一组受试者被给予5.5克低聚半乳糖(galactooligosaccharide,GOS),而另一组被给予安慰剂。研究人员此前在小鼠身上进行了同样的研究,这种益生元可以促进了小鼠肠道内乳酸菌和双歧杆菌的生长;具有更多这两种微生物的小鼠体内影响焦虑的几种神经递质的水平也明显上升,包括脑源性神经营养因子。
在健康人类志愿者中进行的这个研究中,摄入益生元低聚半乳糖的受试者表现出关键应激激素皮质醇的水平较低;而补充益生元的志愿者在注意力点探测任务(Attentional dot-probe task)中也更侧重于关注正面情绪信息,而较少关注负面情绪信息。这个任务通常用于测量焦虑和抑郁水平,因为焦虑和抑郁患者通常更加关注那些具有威胁性的或负面的刺激。 研究人员发现,补充益生元的受试者所表现出的结果与那些服用抗抑郁药或抗焦虑药的受试者相似。
最众所周知的一项人类研究是加州大学洛杉矶分校的研究人员Mayer完成的。他招募了25名健康女性受试者;其中12人每天补充两次酸奶,其余则没有,为期四周。这种酸奶是由乳双歧杆菌、嗜热链球菌、保加利亚乳杆菌和乳酸乳球菌发酵的。在酸奶干预前后,研究人员对受试者进行脑部扫描,以评估他们对一系列面部表情图像的反应,包括快乐、悲伤、愤怒等等。
令人惊讶的是,结果显示两组受试者在测试中的反应存在显著差异;与不喝酸奶的对照组相比,补充酸奶的受试者对这些面部表情图像的反应更为冷静,表明酸奶可以影响控制情绪和感觉的大脑中枢的活动。结果反差很明显,完全出乎研究人员的预料,每天喝两次酸奶,持续四周,会对人的大脑产生如此大的影响。研究人员认为酸奶中的活性益生菌改变了受试者肠道菌群的组成,并导致改变大脑生化的活性物质的产生。
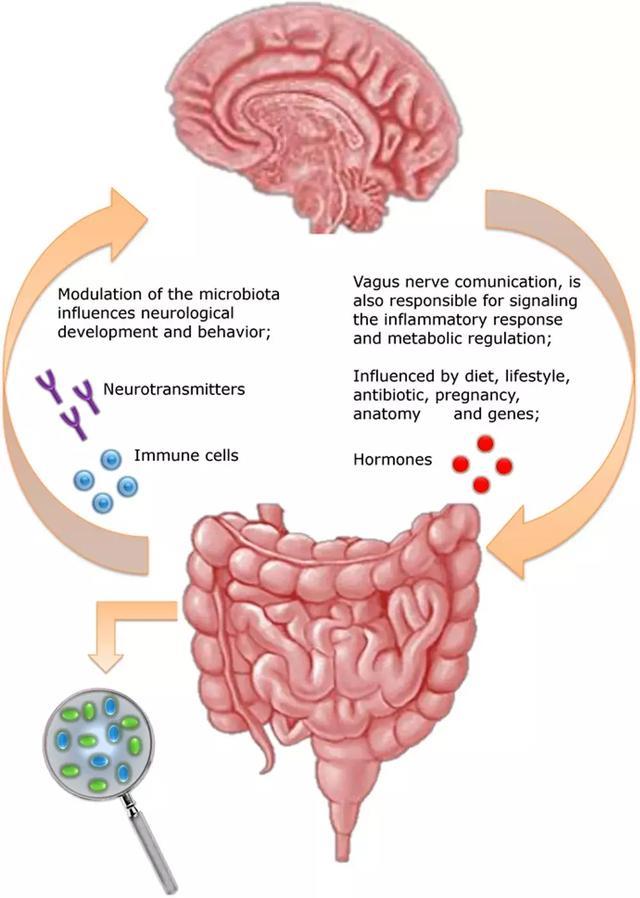
肠道微生物可能通过多种机制影响大脑。科学家们发现肠道细菌可以产生5-羟色胺、多巴胺和γ-氨基丁酸等神经递质,所有这些都在情绪中发挥关键作用,许多抗抑郁药同样也会增加这些神经递质的水平。某些细菌还会影响人体对这些化合物的代谢,从而有效地调节它们在血液和大脑中的水平。肠道细菌也可以产生其它神经活性物质,包括丁酸,它们与减少焦虑和抑郁有关。研究人员也表明,一些肠道微生物可以激活迷走神经,这是连接肠道和大脑的主要交流途径。另外,肠道微生物与免疫系统也紧密联系在一起,免疫系统自身也可影响人的情绪和行为。
从进化的角度似乎也可以解释肠道微生物与大脑之间的相互连接。毕竟,细菌已经在人体内生活了数百万年。随着时间的推移,至少有一部分微生物已经进化出一些通过塑造宿主行为以达到自身目的的方法。改变情绪似乎是一种看似合理的微生物生存策略,因为“快乐的人往往更具有社交性;而我们越爱社交,微生物就有更多的机会交换和传播”。
随着科学家们对肠-脑-微生物网络的了解越来越深入,肠-脑-微生物之间的相互作用将成为治疗精神疾病的新靶点,最终,我们可能可以像使用百忧解一样来使用细菌帮助我们对抗精神疾病。由于肠道微生物具有改变我们大脑的丰富经验,它们可能比目前的药理学方法更加精确和微妙,并且可能意味着更少的副作用。我们坚信,肠道微生物会对我们如何治疗精神疾病产生重大的影响,这将是调节大脑功能的一种全新的方式。
图片来自网络
文本编译自:When Gut Bacteria Change Brain Function