《自然》双重磅:让肿瘤像伤口一样愈合!MSKCC科学家发现,靶向CD4+T细胞中的TGF-β可以重塑肿瘤微环境,抑制肿瘤发展
为了打击癌症,科学家们从各种不同的角度,想了各种办法,昨天,纪念斯隆·凯特林癌症中心(MSKCC)的Li Ming博士团队在《自然》杂志上同时发表了两篇文章。他们在伤口愈合机制的启发下,发现了新的遏制癌症的方法。
他们选中的靶点是CD4+T细胞中的TGF-β信号通路,通过抗体靶向阻断,可以切断肿瘤的营养和氧气供应,高效阻止肿瘤的发展。

Li Ming博士(图片来自于MSKCC官网)
伤口愈合是如何和治疗癌症联合在一起的呢?让我们一起回忆一下以前被刀或者其他锋利的东西割伤的时候,伤口会出现“红热肿痛”的炎症反应,进入愈合阶段后,血管扩张,免疫细胞在伤口处值守,清除可能接触到的病原体。最后,随着伤口被新的组织填补,炎症也消退。
在这个过程中,一个关键的分子——TGF-β的水平随着炎症的出现和消退,同步增加再减少。而肿瘤发展和伤口愈合的前半段很像,始终保持高炎症水平,新生血管增加,因此,在上世纪80年代中期,就有研究人员将肿瘤喻为“无法愈合的伤口”。
之前的研究表明,在癌症患者中,T细胞中的TGF-β始终处于高水平,在体外实验中,抑制它可以增强CD8+T细胞(杀伤性T细胞)的活性,抑制肿瘤进展。
但之前的研究还不够深入,TGF-β对不同类型的T细胞的作用不一样,作用机制也不是很清楚。
在目前有限的信息基础上,研究人员首先想知道的是,TGF-β促进肿瘤生长的效果究竟是通过哪类免疫细胞实现的。鉴于之前发现过TGF-β和CD8+T细胞的关系,研究人员一开始也奔着这个方向去做了实验,结果在乳腺癌小鼠模型中,虽然CD8+T细胞中的TGF-β受体被消除了,但肿瘤却是该怎么长就怎么长。
排除了这个,下一个就是CD4+T细胞。同样的实验,这一次,他们成功阻止了肿瘤。
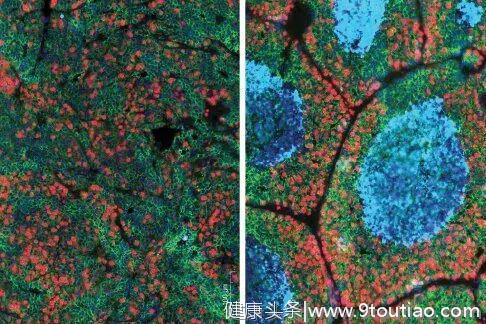
敲除CD4+T细胞中TGF-β受体后,小鼠肿瘤细胞死亡(右图蓝色部分)
靶向CD4+T细胞中的TGF-β既没有直接杀死癌细胞,也没有调动其他的免疫细胞去杀死癌细胞,它们所做的,是“模拟”正常的伤口愈合过程,让癌细胞驻扎位置的脉管结构重塑,变得像普通组织一样,缺少了复杂致密的血管来传输氧气和营养,癌细胞就无法生存扩增,最终迈向死亡。研究人员把这个过程归类为肿瘤微环境的重编程。
CD4+T细胞是辅助性T细胞,主攻对免疫反应的抑制,实验观察到的现象支持了,TGF-β是通过操纵这类T细胞,促进癌细胞的免疫逃逸的。
在以前的研究中,TGF-β被发现可以抑制1型和2型辅助T细胞(Th1/Th2)的分化,它们两个的特征在于分泌的细胞因子不同,一个是干扰素-γ,一个是白介素-4,反之,这两种细胞因子也有利于各自分泌细胞的发育。
在这次的研究中,研究人员发现,依赖于白介素-4的Th2主导了肿瘤微环境的重编程,预防了肿瘤的发生发展。
其实重塑脉管系统的另一种方法,也就是抗肿瘤血管生成治疗,已经用了很多年了,但对于患者来说,临床益处有限。
因此,在另一篇文章中,研究人员在对免疫检查点抑制剂或抗血管内皮生长因子(VEGF)治疗有抗性的乳腺癌小鼠模型中验证了靶向CD4+T细胞中TGF-β的效果。
他们设计了一种可以特异性结合CD4+T细胞中TGF-β的抗体药物——4T-Trap,它对TGF-β的抑制比普通的TGF-β抗体更有效,80%最大抑制效果需要的浓度仅为1.3nM,而普通抗体为25nM。
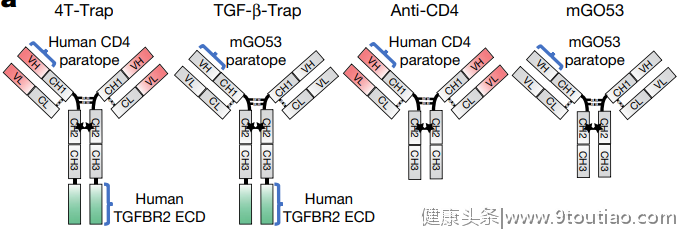
AT-Trap和抗CD4抗体以及抗非靶向CD4的TGF-β抗体的结构对比
根据测定的4T-Trap的药代动力学和药效学特性,研究人员选择了每周两次,每次100μg剂量的方案,静脉内给药,在小鼠中进行了10剂治疗,监测接下来6周的肿瘤进展情况。
根据免疫组织学分析结果,和抗CD4抗体以及抗非靶向CD4的TGF-β抗体的对照组相比,只有4T-Trap治疗的小鼠才出现了实质性的脉管系统的重组,且这一组小鼠纤维蛋白原的血管外沉积减少,说明治疗抑制了血管的渗漏。
从血管结构上来说,4T-Trap组小鼠的血管更明显地表现出覆盖紧密的NG2+周细胞和GP38+成纤维细胞,以及强连接性的基底膜蛋白,胶原IV和纤连蛋白。这些变化都表明,4T-Trap的的确确促进了小鼠的脉管系统重组。
与此同时,4T-Trap组小鼠在治疗后5-6周时,肿瘤脉管系统的不规则模式被有效抑制,远端缺氧面积大幅增加,癌细胞大量死亡,总的肿瘤负荷最小。

4T-Trap和其他抗体治疗后肿瘤负荷随时间的变化
对于肿瘤来说,缺氧环境下,它们会通过更强力地诱导VEGF来适应缺氧环境,解决供给不足,继续扩张。研究人员也确实观察到了4T-Trap组小鼠肿瘤缺氧区域的VEGF表达增加,因此,他们又设计了一个名为VEGF-Trap的VEGF受体诱饵,可以和缺氧区域的VEGF结合。
当4T-Trap和VEGF-Trap双管齐下时,癌细胞的死亡一直扩展到了缺氧区域的外边界,这意味着,癌细胞得以垂死挣扎的那一点“星火”也被扑灭了。
因此,总的来说,靶向CD4+T细胞的TGF-β信号通路是研究人员新发现的一个潜在抗癌靶点,通过重塑肿瘤微环境,或者是说,肿瘤的脉管系统,来抑制肿瘤的发展。虽然之前有靶向TGF-β的研究未能取得成功,但这可能是因为他们没有限定到CD4+T细胞中,只有这种更有针对性的抑制才是对肿瘤有效,且不伤害其他与TGF-β有关的功能的。
Li Ming博士表示,他们这算是“治愈了癌症的伤口”,他提出,这种疗法能够成为当前癌症免疫治疗的有力补充,他的团队目前正在和中心的临床研究人员进行合作,希望将新发现能够转化到患者的治疗中。
编辑神叨叨
GIST领域过去二十年的发展,是癌症分子靶向治疗发展的一个经典的缩影。在过去的三个月里,奇点团队也试图从更高的视野俯瞰GIST领域发展的全景,为大家精心打造了一份GIST全景课程:《GIST学术前沿8讲》。
8讲课程涵盖了GIST治疗的最新进展,深度解析了不同靶向药物的作用机制,系统梳理了GIST领域全球范围内的重要研究,让您在100分钟内洞悉GIST前沿学术进展。
即刻开启GIST前沿学术之旅吧!
认证用户购买只需9.9元!


参考资料:
Dvorak H F. Tumors: wounds that do not heal. New England Journal of Medicine, 1986, 315(26): 1650-1659.
Gorelik L, Flavell R A. Immune-mediated eradication of tumors through the blockade of transforming growth factor-β signaling in T cells. Nature medicine, 2001, 7(10): 1118-1122.
Donkor M K, Sarkar A, Savage P A, et al. T cell surveillance of oncogene-induced prostate cancer is impeded by T cell-derived TGF-β1 cytokine. Immunity, 2011, 35(1): 123-134.
Oh S A, Li M O. TGF-β: guardian of T cell function. The Journal of Immunology, 2013, 191(8): 3973-3979.