十大新药爆发!2020年FDA,肿瘤好药接连获批上市或进入审批
2020年1月,美国药监局FDA在短短一个月内,先后批准了多癌种的新方案,还将几个新药纳入优先审评、孤儿药认定、快速通道或孤儿药资格。这都归功于进展神速的肿瘤医学。好药已经铺天盖地而来,你准备好了吗?随小编看看。
肺癌:双免疫取代化疗;解决奥希替尼耐药
1.O药+伊匹双免疫一线治疗NSCLC
FDA已经接受PD1单抗O药(欧狄沃)+CTLA4抑制剂伊匹木单抗(ipilimumab)联合疗法的sBLA(补充生物制剂上市申请),用于一线治疗EGFR/ALK阴性晚期NSCLC(非小细胞肺癌)患者,同时FDA授予该申请优先审评资格。该适应症申请是基于CheckMate227三期研究结果,让NSCLC患者无论PDL1表达高低,都可以做到去化疗。调整后的双免疫方案毒性也低于化疗。
该研究对PD-L1阳性(≥1%)的人群使用O药+低剂量伊匹vs O药vs化疗,为Part 1a组。PD-L1阴性(<1%)患者则用O药+低剂量伊匹vs化疗vs O药+化疗,为Part 1b组。Part 1a和1b的研究终点有两个:PDL1表达选择人群下双免vs化疗的OS及TMB选择人群下双免 vs 化疗的PFS(无进展生存期)。
结果显示,在PDL1≥1%(part1a)患者中,O药+伊匹的中位OS(总生存期)明显优于化疗,为17.1 vs 14.9个月(P=0.007,HR=0.79)。
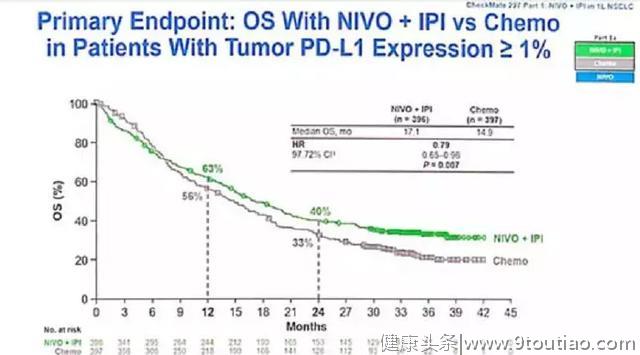
PDL1<1%人群中(part1b),O药+伊匹的中位OS也优于化疗,延长了5个月(17.2 vs 12.2个月,HR=0.62)。亚组分析显示,无论PDL1表达及TMB高低,双免疫的OS都优于化疗。
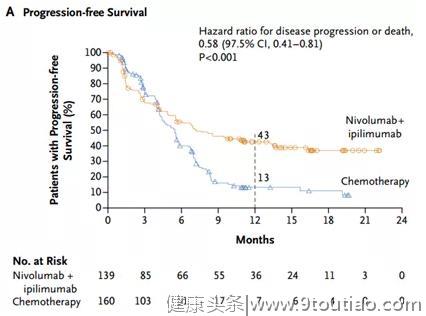
而另一个主要终点指标同样取得了阳性结果。在TMB≥10的患者中,O药+伊匹相比化疗成功延长了中位PFS(无进展生存期),为7.2 vs 5.5个月,差异显著(P<0.001)。
2. Oncoprex+奥希替尼治疗奥希替尼耐药
FDA授予Oncoprex联合奥希替尼“快速通道资格”(Fast Track Designation),用于治疗奥希替尼耐药后的EGFR突变晚期NSCLC(非小细胞肺癌)。Oncoprex是美国Genprex公司开发的免疫基因治疗药物,它的主要活性成分是名为TUSC2的抑癌基因。将TUSC2基因包封在称为纳米囊泡内,静脉给药后,被带负电荷的肿瘤细胞吸引,TUSC2基因在肿瘤细胞内就会生成一种蛋白质,帮助恢复肿瘤细胞中某些功能缺陷,以截断肿瘤细胞复制增殖的通路。
Oncoprex联合厄洛替尼的初步研究纳入了以下三种人群:
①EGFR敏感突变(19del/L858R),靶向耐药;
②EGFR罕见突变突变;
③EGFR阴性。
共有9例患者可评估疗效。
结果显示,4例患者出现肿瘤缩小,中位DOR(缓解持续时间)为3个月,DCR(疾病控制率)为78%。其中有1例患者达到完全缓解CR,为EGFR罕见突变患者;1例EGFR阴性患者靶病灶缩小了24%;1例EGFR阴性患者靶病灶缩小30%,所有病灶缩小18%;1例靶向耐药的EGFR敏感突变T790M阴性患者达到疾病稳定,肿瘤有所缩小。Oncoprex被FDA授予快速通道资格,意味着该药在疗效、安全性等较现有疗法具备优势。同时,该药也具有BLA(生物制品许可申请)的加速审批资格或滚动审查,若有理想数据支持,可以获得优先审批上市的资格。因此,这款被FDA看好的奥希替尼耐药处理方案将会加快进入临床。
3.BBT-176治疗奥希替尼耐药
新型EGFR抑制剂BBT-176的IND(研究性新药申请)已经被FDA批准,用于治疗EGFR C797S突变的晚期NSCLC患者。而C797S正是3代EGFR药奥希替尼耐药后的常见机制,因此BBT-176有着“第四代EGFR靶向药”的属性,或可解决奥希替尼耐药。
专门针对C797S突变的BBT-176在前期研究中取得了亮眼的成绩。在携带包括C797S在内的三重突变(Del19/T790M/C797S,和L858R/T790M/C797S)的异种移植动物模型中,BBT-176表现出强力的抗癌活性。而且,BBT-176与抗EGFR抗体联用,表现出显著增强的活性。
该公司计划明年在韩国的晚期NSCLC(非小细胞肺癌)患者中启动剂量递增研究,然后在韩国和美国进行进一步临床研究。1/2期临床研究将观察BBT-176的安全性、耐受性、和疗效。
4.LOXO-292及BLU-667治疗RET融合NSCLC
①礼来公司(Lilly)的RET抑制剂selpercatinib(LOXO-292)已获得美国FDA授予的优先审评资格,用于治疗RET融合NSCLC患者。
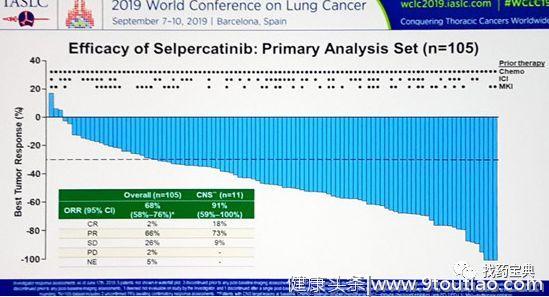
在前期LIBRETTO-001这项1/2期研究中,纳入了RET融合的晚期NSCLC患者,使用LOXO292(Selpercatinib)进行治疗。结果显示,总人群的ORR达到68%,DCR为94%。对于脑转移患者,ORR为91%,DCR为100%!可见,LOXO292不仅高效,入脑能力还非常强。中位DOR为20.3个月,中位PFS为18.4个月。疗效非常持久。
②Blueprint Medicines公司的 Pralsetinib(BLU-667)在治疗RET融合阳性非小细胞肺癌(NSCLC)患者的1/2期临床研究ARROW中,获得积极的顶线结果,并已开始向美国FDA递交这一适应症的滚动新药申请(rolling NDA),预计将在今年第一季度完成递交,有望为RET变异癌症治疗带来高效新药。
试验数据显示,在80名先前接受过铂类化疗的RET融合阳性NSCLC患者亚组中,BLU-667的治疗使患者的ORR达到61%,并且使95%的患者肿瘤缩小,其中包括14%目标肿瘤完全消退的患者。在含有26名初治患者的亚组中,BLU-667治疗患者的ORR达到73%,其中12%的患者获得了CR(完全缓解),此外,所有患者的肿瘤均有缩小。
肝癌:突破一线;新靶点逆袭
1.I药双免疫一线治疗肝癌
1月20日,阿斯利康官网首报,PD-L1单抗Imfinzi(Durvalumab,度伐利尤单抗)和CTLA4单抗tremelimumab联合疗法已被美国FDA授予治疗肝细胞癌(HCC)的孤儿药资格。这是肝癌一线免疫疗法在历经多次失败后的新突破。目前,Imfinzi已于今年在国内上市,并于2月底开售,用于临床用药。
I药双免疫组合来势汹汹,目前也开展了全球临床试验。III期HIMALAYA试验是一项评估Imfinzi单药疗法、Imfinzi+tremelimumab组合疗法、标准治疗药物sorafenib(索拉非尼,一种多激酶抑制剂),用于先前未接受过系统治疗、且没有资格接受局部区域治疗(局限于肝脏的治疗)的不可切除性、晚期HCC患者的全球性研究。该研究纳入了美国、欧洲、加拿大、南美、亚洲等16个国家的189个临床中心的肝癌患者,主要终点是总生存期(OS),关键次要终点包括客观缓解率(ORR)和无进展生存期(PFS)。值得一提的是,该研究是第一个在一线晚期HCC患者中测试双重免疫检查点阻断的试验。HIMALAYA试验结果有望今年出炉。

2.阿特珠单抗+贝伐单抗一线治疗肝癌
1月27日,罗氏宣布已向美国FDA提交了PD-L1抗体Tecentriq(atezolizumab)联合Avastin(bevacizumab)用于既往未接受过全身治疗的不可切除性肝细胞癌(HCC)患者的补充生物制品许可申请(sBLA)。
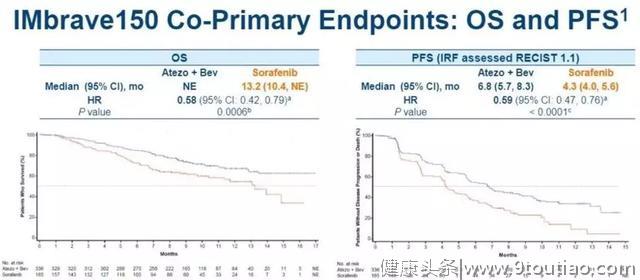
IMbrave150三期研究显示,相比与肝癌目前一线标准方案索拉菲尼,A+T成功延长了OS(未达到 vs 13.2个月)与PFS(6.8 vs 4.3个月),成功为肝癌谱写新历史章节。期待该方案获批上市。
3.Infigratinib治疗FGFR阳性胆管癌
FDA授予Infigratinib(BGJ398)快速通道资格,用于治疗一线进展后的晚期胆管癌患者。该药为FGFR抑制剂,目前已经开展了全球III期研究,对比化疗一线治疗FGFR2融合/重排晚期胆管癌患者。
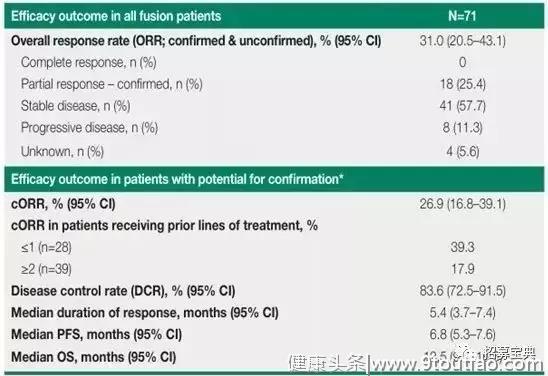
既往的一项研究纳入71名患有FGFR2融合/易位的患者,其中62%为女性患者,38%为男性患者。患者每日口服125mg的infigratinib,口服21天,28天为一周期。
总体患者人群中,18例(25.4%)的患者部分缓解,41例(57.7%)的患者疾病稳定,8例(11.3%)患者疾病进展。ORR为25.4%,DCR为83.6%,中位DoR为5.4个月,中位PFS为6.8个月,中位OS为12.5个月。
卵巢癌、前列腺癌:PARP抑制剂进击
1.奥拉帕利治疗HRR突变去势抵抗型前列腺癌
1月20日,阿斯利康宣布FDA已受理奥拉帕利新适应症申请,并授予优先审评资格,用于治疗携带HRR(同源重组DNA损伤修复缺陷)突变的晚期去势抵抗性前列腺癌(mCRPC)。这些患者之期接受过恩杂鲁胺、阿比特龙等新一代内分泌疗法后疾病发生进展。
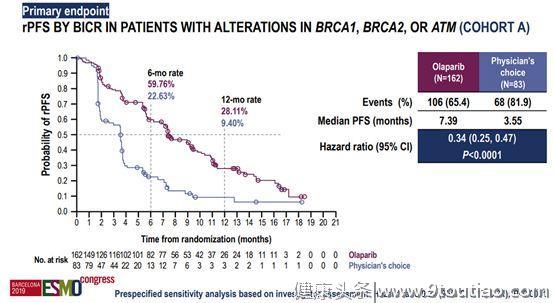
PROfound的III期临床研究结果显示,奥拉帕利相比恩杂鲁胺或阿比特龙,可以使BRCA1/2或ATM基因突变(HRR基因突变的一个亚型)患者的放射学无进展生存期(rPFS)显著延长(7.39 vs 3.55个月)。
2.奥拉帕利联合贝伐单抗一线治疗卵巢癌
奥拉帕利联合贝伐单抗一线维持治疗卵巢癌的补充新药申请已经获得FDA优先审查。双靶用于卵巢癌一线的突破是基于PAOLA-1研究结果。
PAOLA-1是一个随机双盲3期试验,纳入初治的晚期高级别浆液性/子宫内膜样卵巢癌、输卵管癌或腹膜癌患者,一线接受含铂化疗联合贝伐单抗治疗有效(达到部分缓解/完全缓解)后,随机接受PARP抑制剂奥拉帕利+贝伐单抗vs贝伐单抗单药进行一线维持治疗。
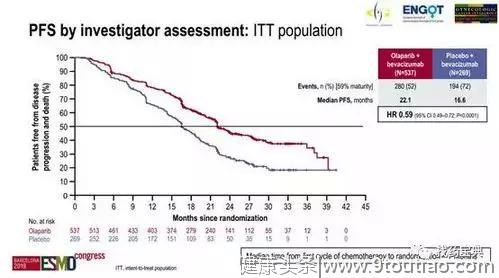
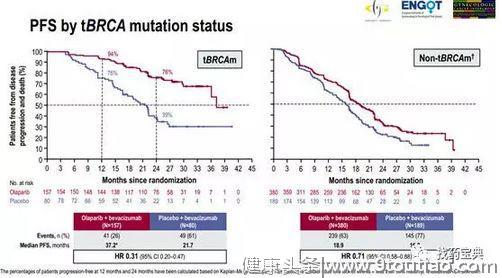
研究者评估的结果显示,与贝伐单抗单药相比,奥拉帕利+贝伐单抗可将患者的中位PFS(无进展生存期器)延长5.5个月(16.6 vs 22.1个月),使疾病进展和死亡风险降低41%(HR=0.59,P<0.0001)。
该研究对tBRCA(体系)突变及HRD情况进行了亚组分析。在无tBRCA突变患者中,,同样可以获益。不过,有BRCA突变患者的获益还是要更为显著。
3.Rucaparib治疗前列腺癌
Rucaparib为PARP抑制剂,在今年1月份获得FDA优先审查用于BRCA1/2突变、复发性、转移性去势抵抗性前列腺癌(CRPC)成人患者的治疗。2019年欧洲肿瘤医学学会(ESMO)年会上,TRITON2的结果显示,在携带BRCA1/2突变的57例RECIST/PCWG3缓解可评估患者中,研究调查员评估的确认ORR为43.9%。当由独立放射学审查评估时,缓解率相似(40.4%)。此外,在携带BRCA1/2突变的98例缓解可评估患者中,确认的前列腺特异性抗原(PSA)应答率为52.0%。确认的放射学缓解具有持久性,60%(15/25)患者的缓解持续≥24周。
接下来,TRITON3研究进一步评估了Rubraca治疗晚期前列腺癌的潜力,该研究正在招募携带BRCA1/2突变和ATM突变(包括生殖系和体细胞)肿瘤患者。
新药正在连绵不绝上市或步入优先审批,肿瘤医学发展日新月异。
"