骄傲!中国国产抗癌药集体亮相,表现不俗
今年9月7日-10日在西班牙巴塞罗那举行的世界肺癌大会(WCLC 2019)是世界上最大的致力于肺癌和其他胸部恶性肿瘤病因/机理/基础研究、治疗和预防的学术会议,有来自100多个国家的超过10000名与会者代表,共同讨论胸部恶性肿瘤研究的最新进展。
今年世界肺癌大会上中国“智造”的抗癌药物受到格外关注,既有先进的第三代EGFR靶向药奥美替尼,也有包括卡瑞利珠单抗、信迪利单抗、特瑞普利单抗的免疫治疗药物。
从大会上报道的研究数据看这些自主研发的国产药物治疗肺癌的疗效和安全性并不亚于进口药物,尤其是国产免疫治疗药物的迅速发展,可以说打破了欧美制药企业对PD-1单抗的垄断,为中国患者带来更多的治疗选择,这将有力地促进高昂的免疫治疗费用下降,切实让患者获得救命药,让更多的患者可以治愈肺癌。
下面就由肺腾助手为大家总结世界肺癌大会上亮眼的中国“智造”抗癌药物吧。
奥美替尼抗耐药,控脑转,第三代EGFR靶向药新选择在中国有一半的肺腺癌患者是敏感EGFR突变,这些敏感EGFR突变患者可以接受靶向治疗,疗效很好,不良反应低。然而患者接受第一、二代EGFR靶向药治疗几乎都要面对耐药的问题,这些耐药的患者大约一半是因为出现了继发的T790M突变。
目前唯一获批对付这个T790M突变的第三代EGFR靶向药是进口的奥希替尼。最近奥希替尼还在中国获批一线治疗的适应症,可以说奥希替尼在EGFR靶向药物市场上具有统治地位,奥希替尼的售价也是EGFR靶向药之冠。
因此如果我国能自主研发一种可以媲美奥希替尼的第三代EGFR靶向药,那么我国患者将有更多药物选择,市场竞争也有利于第三代靶向药价格进一步下降,而江苏豪森药业自主研发的奥美替尼(Almonertinib)则可能是奥希替尼的有力挑战者。
今年世界大会上由上海交通大学附属胸科医院陆舜教授口头报告了国产第三代EGFR 靶向药奥美替尼(研发代号HS-10296)二线治疗EGFR T790M突变阳性局部晚期或转移性非小细胞肺癌的Ⅱ期临床研究结果。
研究纳入244例第一代EGFR靶向治疗耐药且T790M突变阳性的非小细胞肺癌患者,其中37.3%的患者有脑转移。入组患者接受奥美替尼(110mg,口服,每日1次)治疗,直至出现疾病进展(PD)或不可耐受的毒性,或患者停药。
经独立评审委员会评估的研究结果显示,客观缓解率为68.4%,疾病控制率为93.4%,可以说绝大部分患者的疾病都受到控制。
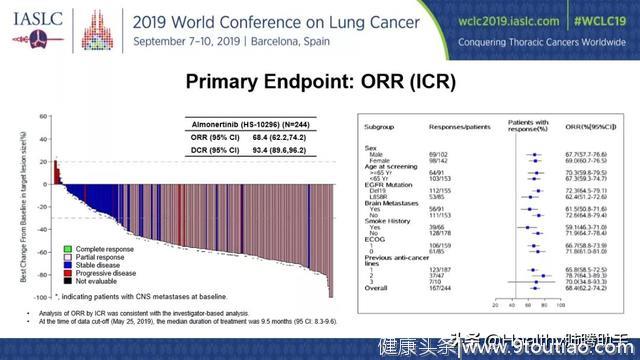
图一 接受奥美替尼治疗患者的肿瘤变化瀑布图(左)和各亚组的客观缓解率(右)
亚组分析显示,奥美替尼在各亚组患者中均有效,在脑转移患者中也显示出良好的治疗效果。基线有脑转移的患者,其客观缓解率为61.5%, 基线无脑转移患者的客观缓解率为72.6%。
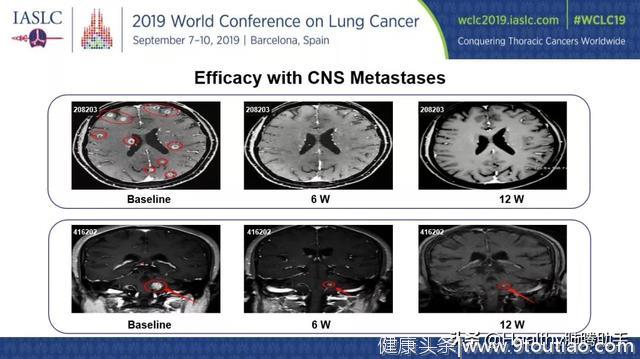
图二 2例患者脑转移病灶核磁影像
可见治疗6周和12周后脑转移病灶显著缩小。
中位无进展生存期、持续缓解时间以及总生存期数据均未成熟,12个月无进展生存率为53%,这意味着中位无进展生存期将超过12个月。
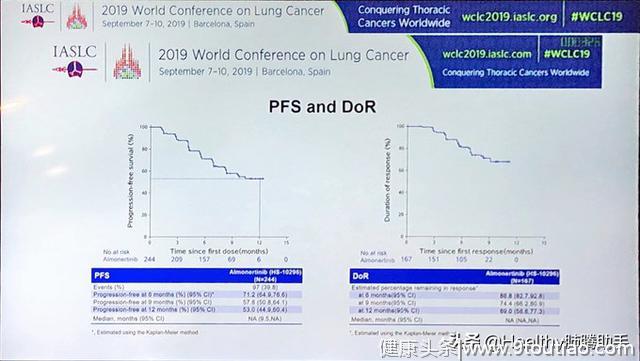
图三 无进展生存期曲线(左)和持续缓解时间曲线(右)
研究中未发生非预期的不良反应,不良反应严重程度多为1或2 级,3级及以上严重的药物相关不良反应发生率为20.9%,因药物相关不良反应而减量或停药的患者比例各为2.0%,4例(1.6%)患者因药物相关不良反应死亡,研究期间未见患者出现间质性肺病。
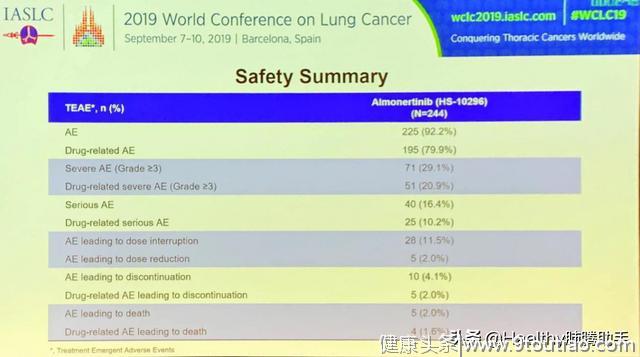
图四 安全性数据汇总
江苏豪森药业已于2019年4月递交奥美替尼新药上市申请(NDA),并于5月获得优先审评资格。奥美替尼的早日获批上市,将填补国内自主研发的第三代EGFR 靶向药空白,为患者带来更多治疗选择。
卡瑞利珠单抗+化疗一线治疗驱动基因阴性非鳞非小细胞肺癌,死亡风险降低28%!卡瑞利珠单抗(camrelizumab)是我国恒瑞医药自主研发的抗PD-1单克隆抗体,在多种恶性肿瘤中显示出良好的抗肿瘤活性,目前已在国内上市,适应症为经典型霍奇金淋巴瘤,商品名为艾瑞卡。
今年的世界肺癌大会上同济大学附属上海市肺科医院周彩存教授口头报告了卡瑞利珠单抗联合化疗一线(初始)治疗驱动基因阴性(EGFR/ALK)非鳞非小细胞肺癌的III期研究结果。这是首个公布的针对中国非小细胞肺癌患者的一线免疫联合治疗III期临床研究结果,也是中国自主研发的PD-1单抗第一个III期临床研究亮相国际舞台。
研究入组了419例未经治疗的驱动基因阴性晚期非鳞非小细胞肺癌患者按照1:1随机分组,分别给予4-6个周期的化疗(卡铂AUC=5、培美曲塞500mg/m2)±卡瑞利珠单抗(200mg),之后使用培美曲塞±卡瑞利珠单抗维持治疗,直到疾病进展或不能耐受不良反应。对于化疗组中证实病情进展的患者,允许交叉使用卡瑞利珠单抗治疗。
研究结果显示卡瑞利珠单抗+化疗组患者的客观缓解率达60%,疾病控制率87.3%,显著优于化疗组的39.1%和74.4%。
中位无进展生存期方面卡瑞利珠单抗+化疗组达11.3个月,显著优于化疗组的8.3个月,PD-L1阳性患者卡瑞利珠单抗单抗+化疗的中位无进展生存期更达15.2个月,也显著优于化疗组的9.9个月。
更关键的中位总生存期数据方面,卡瑞利珠单抗+化疗组尚未成熟,即超过50%的患者依然存活,而化疗组的中位总生存期为20.9个月,目前的数据显示卡瑞利珠单抗+化疗相比化疗可降低28%的死亡风险。两组患者总生存期曲线在研究初期即表现出分开的趋势,这提示卡瑞利珠单抗+化疗相比化疗可改善患者的总生存期。
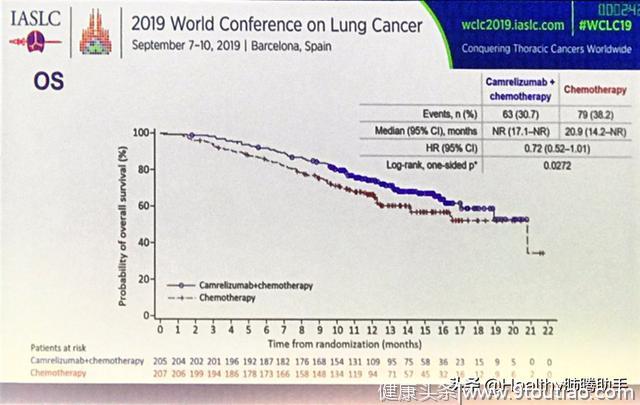
图五 总生存期曲线
蓝色为卡瑞利珠单抗+化疗,20个月时仍有超过50%的患者存活
安全性方面,卡瑞利珠单抗+化疗组和化疗组发生3/4级严重不良反应的比例分别为66.8%和51.2%;治疗相关的死亡人数分别为5和4例。卡瑞利珠单抗+化疗组仅有反应性皮肤毛细血管增生症的发生率较高,任意级别发生率为77.6%,但其中3级及以上的比例仅为1%。
另一方面,血液学毒性包括中性粒细胞减少、贫血等的发生比例较对照组略高,不过值得注意的是,毒副反应虽然发生,但对患者生存与生活质量并未造成严重影响,两组中治疗相关的死亡率并没有统计学差异;同时,治疗中断的发生率与国外研究也基本一致。
从免疫相关的毒副反应的角度来看,卡瑞利珠单抗联合化疗组3级以上的免疫相关不良事件中最高的发生率也只有3.4%(肝功能异常),提示卡瑞利珠单抗联合化疗的安全性非常好。
目前国内一线免疫治疗联合化疗治疗非小细胞肺癌仅有进口的帕博利珠单抗(K药)获批,不过进口药一家独大的局面很快就要改变了!9月12日,恒瑞医药发布公告称,国家药品监督管理局已受理公司研发的卡瑞利珠单抗联合培美曲塞加卡铂一线治疗晚期或转移性非鳞癌非小细胞肺癌的上市申请。
卡瑞利珠单抗单药治疗经治非小细胞肺癌,疗效不输进口药在今年世界肺癌大会上广东省人民医院吴一龙教授口头报告了一项卡瑞利珠单抗单药治疗经治晚期非小细胞肺癌的Ⅱ期研究。研究纳入146例含铂双药化疗耐药的患者,其中54.8%为非鳞癌,EGFR突变患者要求至少接受过一种获批的EGFR靶向药治疗,而且要求PD-L1表达≥50%。入组患者接受卡瑞利珠单抗单药治疗,剂量为200mg每2周静脉滴注一次。
研究结果显示意向治疗人群(ITT)即纳入研究的总体人群的客观缓解率(ORR)为18.5%,中位持续缓解时间(DOR)为15.1个月,中位无进展生存期(PFS)为3.2个月,中位总生存期(OS)为19.4个月。ITT人群的疗效数据优于二线标准化疗方案多西他赛的历史数据。
研究依据患者PD-L1表达和EGFR基因状态进行亚组疗效分析,分析结果如下表:
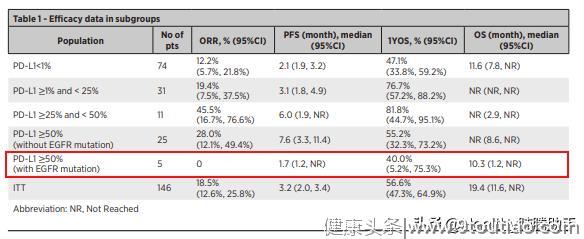
图六 亚组疗效数据,红框处为EGFR突变患者
PD-L1<1%亚组患者的中位总生存期达到11.6个月,优于多西他赛历史数据,对比进口免疫治疗药物,K药二线治疗非小细胞适应症不包括PD-L1<1%的患者,O药(纳武利尤单抗)二线治疗PD-L1<1%患者的1年生存率为48%,与卡瑞利珠单抗的47.1%相近。
而其他PD-L1表达水平患者的疗效与K药、O药二线治疗的疗效相近,值得注意的是EGFR突变患者即使PD-L1表达≥50%,客观缓解率却为0,提示对于EGFR突变患者,单药免疫治疗疗效不佳。
安全性方面,20.5%的患者出现3级及以上治疗相关不良反应,15.8%的患者出现严重不良反应。21.2%的不良反应致治疗中断,7.5%的不良反应导致治疗终止,总体来说单药卡瑞利珠单抗治疗耐受良好。
二线特瑞普利单抗联合培美曲塞+卡铂,EGFR突变患者也适用的免疫治疗方案我国肺腺癌患者中约一半是EGFR敏感突变,这些患者靶向治疗效果很好,然而靶向治疗耐药问题难以避免,当靶向治疗失败后因为EGFR突变患者接受单药免疫治疗效果不佳,患者往往只能接受化疗,但疗效仍不理想。
基于此同济大学附属上海市肺科医院周彩存教授牵头组织了一项特瑞普利单抗联合化疗治疗靶向治疗失败的EGFR突变患者的Ⅱ期临床研究。特瑞普利单抗是我国首款自主研发的PD-1单抗,由上海君实生物研发生产,商品名拓益,目前国内批准的适应症为恶性黑色素瘤二线治疗。
今年世界大会上周彩存教授团队的张洁教授口头报告了这项II期临床研究的结果。研究纳入了40例先前接受EGFR 靶向治疗失败同时未伴有T790M突变或接受奥希替尼治疗失败的EGFR敏感突变患者,接受240mg或360mg固定剂量的特瑞普利单抗(每3周静脉滴注一次)联合卡铂和培美曲塞4~6周期,后续接受特瑞普利单抗联合培美曲塞维持治疗,直至疾病进展(PD)或不能耐受毒性。
40例患者全部纳入评估,确认的客观缓解率(ORR)为50%,20例患者部分缓解(PR),15例患者疾病稳定(SD;包括1例未确认的PR),疾病控制率(DCR)达87.5%;中位持续缓解时间(DOR)7.0个月;整体人群的中位无进展生存期(PFS)为7.0个月。
根据PD-L1表达水平进行分层分析:PD-L1阳性患者,ORR为60%,中位PFS达8.3个月;而PD-L1阴性患者,ORR为38.9%,中位PFS达5.7个月。根据患者基因突变类型:EGFR L858R突变患者ORR为58.9%,中位PFS为7.1个月;19Del患者ORR为43.5%,中位PFS为5.1个月。
以患者肿瘤突变负荷(TMB)状态前20% 4.6 Muts/Mb为界,TMB≥4.6 Muts/Mb,ORR为50.0%,中位PFS为7.1个月;TMB<4.6 Muts/Mb,ORR为50.0%,中位PFS为5.6个月。尽管PD-L1阳性、EGFR L858R突变或TMB高患者中观察到更好的ORR和PFS,但差别没有统计学意义。
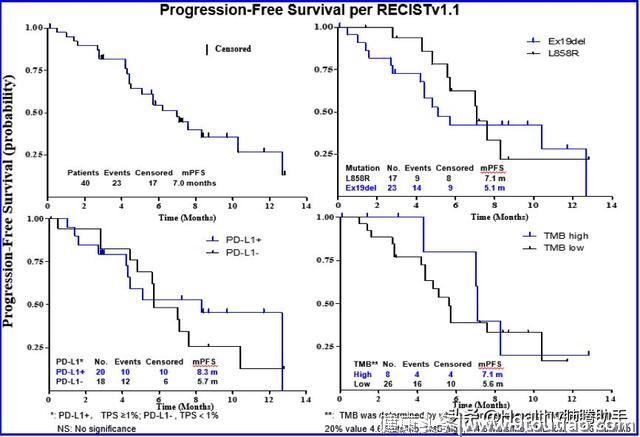
图七 总体人群与各亚组的PFS曲线图
联合治疗方案安全可耐受。≥3级治疗相关不良反应发生率为55%,常见不良反应包括白细胞减少、中性粒细胞减少、贫血等。≥3级免疫相关不良反应发生率为7.5%,包括1例患者死亡。10.8%的患者因不良反应而终止治疗。
既往研究数据表明,化疗的ORR一般在30%左右,PFS仅约4个月,可见无论ORR还是PFS,联合方案均优于单纯化疗。在安全性方面,主要是化疗相关的不良反应,免疫相关不良反应发生率非常小,仅为7.5%,安全可控。
免疫治疗联合化疗能改变免疫微环境而起到协同作用,疗效大大提高,EGFR突变患者同样能从免疫治疗中获益。这这项Ⅱ期研究入组的主要为一线靶向治疗(一代/二代EGFR靶向药)失败后的无T790M突变的患者,但理论上,一线直接应用第三代EGFR靶向药(奥希替尼)治疗失败后的患者接受特瑞普利单抗联合化疗同样能取得相似的疗效。
因此,在后续的Ⅲ期研究(登记号NCT03513666)设计中,周彩存教授团队将进一步扩大入组人群,一线应用奥希替尼治疗失败后的患者无需再进行基因检测同样能入组临床研究。
信迪利单抗联合安罗替尼,晚期非小细胞肺癌一线治疗无化疗新尝试信迪利单抗是我国信达生物自主研发的PD-1单抗,目前已在国内上市,适应症为经典型霍奇金淋巴瘤,商品名达伯舒。安罗替尼我国正大天晴自主研发的口服抗血管生成药物,适应症包括非小细胞肺癌和小细胞肺癌的三线治疗,商品名福可维。
既往研究证实,免疫治疗与抗血管生成治疗具有协同效应,基于此上海市胸科医院韩宝惠教授团队开展了一项评估信迪利单抗与安罗替尼这一无化疗联合方案,一线治疗晚期非小细胞肺癌的疗效和安全性的I期临床研究。
今年世界大会上韩宝惠教授口头报告了该项研究的结果,研究纳入22例驱动基因(EGFR/ALK/ROS1)阴性、未经治疗的ⅢB~Ⅳ期非小细胞肺癌患者,其中鳞癌占54.5%,4例患者合并脑转移。同时21例患者进行了PD-L1表达检测;18例患者进行了肿瘤突变负荷(TMB)检测。
入组患者接受信迪利单抗(200mg,每3周一次静脉滴注)和安罗替尼(12mg/天,口服,连续2周,休息1周)治疗,直至疾病进展(PD)或不能耐受不良反应。
研究结果显示16例患者确认为部分缓解(PR),6例患者疾病稳定(SD),客观缓解率(ORR)高达72.7%,疾病控制率(DCR)为100%。
亚组分析显示,不论患者PD-L1表达高低,TMB高低,客观缓解率都不低于60%。
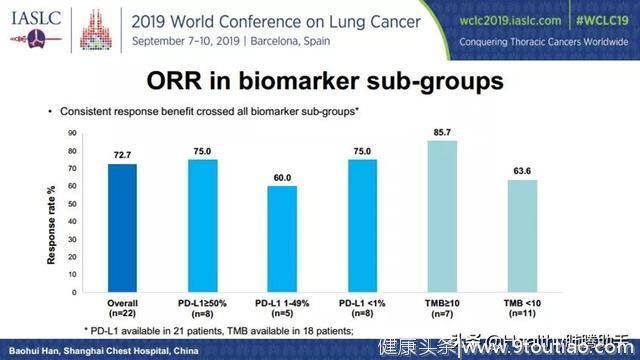
图八 不同PD-L1表达,TMB状态患者的客观缓解率
至数据截取时,81.8%(18/22)的患者仍在接受治疗中,仅2例患者出现疾病进展,中位无进展生存期数据尚不成熟,预估6个月 无进展生存率为93.8%。
值得注意的是,总共40.9%(9/22)的患者治疗后出现肿瘤内空洞形成,其中4例患者确认为部分缓解,5例患者为疾病稳定。既往研究显示,抗血管生成药物治疗后出现空洞可能提示有获益。
患者接受信迪利单抗联合安罗替尼治疗耐受性总体良好,未观察到意料之外的不良反应。3级及以上严重治疗相关不良反应发生率为27.3%(6/22),且多数可逆可控。1例患者死于免疫相关肺炎。
3级及以上严重不良反应包括:手足综合征、高血压、皮疹、免疫相关肺炎、蛋白尿、心包积液,发生率均为4.5%。
总的来说信迪利单抗联合安罗替尼在未经治疗的驱动基因阴性晚期非小细胞肺癌中展现出令人鼓舞的疗效,值得进一步研究,为患者提供无化疗的一线治疗选择。
信迪利单抗新辅助治疗,为可手术非小细胞肺癌患者带来更大的治愈希望对于可手术的患者,术后肿瘤复发依然是严峻的考验,在手术前进行新辅助免疫治疗可以利用手术前患者免疫系统完整,肿瘤体积大,新抗原多的特点,充分增强体内抗肿瘤免疫T细胞的活性,让它们分散到全身,清除微小的癌症转移灶,理论上可降低患者术后复发率。
基于上述背景由国家癌症中心、中国医学科学院肿瘤医院赫捷院士、高树庚教授、李宁教授牵头开展了信迪利单抗用于可手术切除的、初治型非小细胞肺癌患者术前新辅助治疗的临床研究。今年世界肺癌大会上中国医学科学院肿瘤医院王书航教授口头报告了上述研究的结果。
研究纳入了40例未经治疗的、可手术切除的ⅠA期~ⅢB期非小细胞肺癌患者,肿瘤原发病灶≥2cm、ECOG PS评分为0、年龄在18~75岁之间。入组的患者经过PET-CT检查,排除远处转移之后,接受2周期的信迪利单抗新辅助治疗(200mg,每3周一次静脉滴注)。
在开始信迪利单抗治疗后的第29至43天之内,患者行第二次PET-CT检查评估治疗疗效并证实无远处转移时,患者接受手术切除。根据术后病理诊断进行重新分期后,患者将接受以下三种术后辅助治疗:传统化疗联合或者不联合放疗、信迪利单抗单药辅助治疗、传统化疗联合信迪利单抗治疗。
结果40例患者均完成了2个周期的信迪利单抗新辅助治疗。有3例患者接受了探查术,其中1例患者在术中冰冻病理证实胸壁结节转移,即疾病进展,另外2例患者在信迪利单新辅助治疗后评估为疾病稳定(SD)。
另外37例患者接受了手术切除,除了其中1例肺鳞癌患者为R2切除外,36例患者均为根治性切除(R0),被纳入显著病理学缓解的分析,包括5例肺腺癌、30例肺鳞癌、以及1例腺鳞癌患者。
信迪利单抗新辅助治疗的疗效方面,影像学客观缓解率(ORR)为20%,没有患者完全缓解。在37例可做病理缓解分析的患者中,15例(40.5%)达到病理学显著缓解(MPR),就是说这些患者的肿瘤切下来,里面依然存活的肿瘤细胞<10%。
6例(16.2%)达到病理学完全缓解(pCR),即这些患者的肿瘤切下来,发现里面没有一个活的肿瘤细胞。这个疗效数据与国外免疫治疗药物新辅助治疗效果不相伯仲甚至更好。
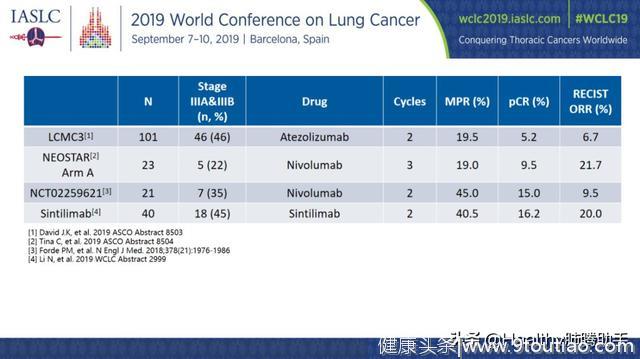
图九 信迪利单抗(Sintilimab)与国外O药(Nivolumab)、T药(Atezolizumab)新辅助治疗研究数据比较
安全性方面不同级别的新辅助治疗相关不良反应发生率为52.5%(21例),其中≥3级不良反应发生率为10%(4例)。
发生率最高不良反应分别为乏力(17.5%;7例)、甲状腺功能减退(17.5%;7例),其次为发热(15%;6例)、谷氨酰转移酶升高(10%;4例)等。≥3级的严重不良反应,发生率最高的为肺炎(5%;2例,分别是3级和5级)。
无手术延期率可达82.5%;另外两例患者由于2级治疗相关的不良反应而导致手术延期。此外,有4例(10%)患者出现了手术并发症,分别为咯血(1级)、术后手术切口感染(2级)、疼痛(1级)、发热(2级)。
研究还发现PET-CT的SUVmax值的降低程度可以作为预测病理缓解率的指标,但信迪利单抗新辅助治疗后有假进展的病例,因此病灶直径改变程度并不能作为病理缓解率的预测标志;原发病灶和转移性淋巴结可能对信迪利单抗新辅助治疗的应答存在较大的异质性。
总的来说可手术非小细胞肺癌患者接受信迪利单抗新辅助治疗具有良好的安全性和耐受性,疗效也不输国外免疫治疗药物,具有良好的应用前景。
中国“智造”,造福中国患者经过国内药企的多年努力奋斗,我国自主研发的肺癌药物越来越多,类别也越来越全,由各种靶向药到免疫治疗药物均有产品研发上市,水平已经接近国际先进水平,世界肺癌大会报道的多项研究就是明证。
而且国内的研究更多地考虑中国患者的特征,更加接地气,更符合中国患者的需求。期望有更多中国“智造”的肺癌药物获批上市,为患者带来更多,更廉价的好药!
参考资料
1、S. Lu et al.OA02.03 THE THIRD GENERATION EGFR INHIBITOR (EGFR-TKI) HS-10296 IN ADVANCED NSCLC PATIENTS WITH RESISTANCE TO FIRST GENERATION EGFR-TKI. Presented at WCLC 2019.
2、C. Zhou et al. OA04.03 A RANDOMIZED PHASE 3 STUDY OF CAMRELIZUMAB PLUS CHEMOTHERAPY AS 1ST LINE THERAPY FOR ADVANCED/METASTATIC NONSQUAMOUS NON-SMALL CELL LUNG CANCER. Presented at WCLC 2019.
3、Y.-L. Wu et al. JCSE01.09 A PHASE II UMBRELLA STUDY OF CAMRELIZUMAB IN DIFFERENT PD-L1 EXPRESSION COHORTS IN PRE-TREATED ADVANCED/METASTATIC NON-SMALL CELL LUNG CANCER. Presented at WCLC 2019.
4、J. Zhang et al. MA11.06 A PII STUDY OF TORIPALIMAB, A PD-1 MAB, IN COMBINATION WITH CHEMOTHERAPY IN EGFR+ ADVANCED NSCLC PATIENTS FAILED TO PRIOR EGFR TKI THERAPIES. Presented at WCLC 2019.
5、B. Han et al. P1.04-02 EFFICACY AND SAFETY OF SINTILIMAB WITH ANLOTINIB AS FIRST-LINE THERAPY FOR ADVANCED NON-SMALL CELL LUNG CANCER (NSCLC). Presented at WCLC 2019.
6、Li N,Ying JM,Tao XL,et al.Efficacy and Safety of Neoadjuvant PD-1 Blockade with Sintilimab in Resectable Non-Small Cell Lung Cancer. Presented at WCLC 2019.
7、Gettinger S N, Horn L, Jackman D M, et al. Five-Year Follow-Up of Nivolumab in Previously Treated Advanced Non–Small-Cell Lung Cancer: Results From the CA209-003 Study[J]. Journal of Clinical Oncology, 2018.
DOI:10.1200/JCO.2017.77.0412
更多精彩,添加微信:ftzs03获取哦~
(封面图片来源:摄图网)
"