这种癌症在化疗之后,可以使用新药进行维持治疗
在刚刚举行的ESMO 2019 年会上,尼拉帕利作为一线维持治疗的临床试验结果又不负众望,展示了广谱的抗癌效果。但是,要看懂这个临床试验,还得等到大阅兵之后。
PRIMA临床试验:疾病进展或死亡的风险降低了38%!这个名字叫做PRIMA的临床研究,是在初治晚期卵巢癌患者中进行的。
卵巢癌是一种比较常见的妇科恶性肿瘤,中国每年的新增病例为5万人,死亡病例为2.2万人。
对卵巢癌的药物治疗,长期以来只有化疗。对于进展期的患者,一线治疗药物治疗是含铂化疗。
在这个试验中,患者分成了两组,对照组只是接受含铂化疗,而实验组在接受含铂化疗后,又继续使用尼拉帕利作为一线维持治疗。研究结果显示,经过尼拉帕利治疗后,患者发生疾病进展或死亡的风险降低了38%,治疗效果明显优于对照组。
根据癌细胞的基因修复功能,卵巢癌患者可以分为几种亚型:BRCA基因突变型、BRCA基因正常但有其他同源重组缺陷型(其他HRD型)、无同源重组缺陷型(HRD阴性型)。前面两种亚型的癌细胞,基因修复的功能都有缺陷,而最后一种亚型,可以认为其基因修复功能是正常的。
该临床试验最重要的结果,是发现不管哪种亚型的卵巢癌患者,尼拉帕利都展现出了明显的治疗效果:
- 携带BRCA突变的患者,疾病进展或死亡的风险降低60%
- 其他HRD型患者,疾病进展或死亡的风险降低50%
- HRD阴性患者,疾病进展或死亡的风险降低 32%
因为这个研究的结果很重要,有望改变目前的临床实践,论文也就同时发表于《新英格兰医学杂志》[1]。
看了大阅兵,就容易理解这个临床试验的意义了在国庆70周年大阅兵的仪式上,大家注意到一辆空的检阅车。
大多数人此时都会迷惑不解,难道是想说咱们很富了,车都需要两辆,开一辆,空一辆?
等到看清楚“1949”这个车牌,才恍然大悟:这辆空车,是留给先烈的。
先烈打下了江山,但是没有看到今天的江山。只有通过这样的方式,才能让先烈看到这盛世正如其所愿。
借用这个阅兵式,可以引申解读一下PRIMA临床试验为什么需要分成两组。
这个试验里入组的患者,都是病理期3期或者4期的患者,都需要化疗来治疗。化疗,就是对癌细胞摧枯拉朽的革命,可以说是打下了卵巢癌治疗的江山,但是因为是比较激进的治疗手段,正常的细胞也会受到损伤,副作用也不小。
而且因为化疗的作用有限,患者病情容易复发。一但复发,就需要再次化疗。
尼拉帕利走的是“坐江山”的套路,是一种维持治疗,目的是为了减少复发、延长生命,也可以说是为了达到治疗的“盛世”。
所以,阅兵仪式上的那辆空车并不是浪费,临床试验里的对照组也不是浪费。不但不浪费,而且很关键。
而只有通过对比两组治疗方式,才能知道化疗能达到什么样的效果,也才能看出尼拉帕利延迟复发的效果如何。
临床试验结果表明,整体上对照组的中位无进展生存为8.2个月,也就是说,这些进展期卵巢癌患者在化疗之后,有50%的人在8个月内就会发生病情进展,不得不再次化疗。
而如果在化疗之后进行尼拉帕利维持治疗,中位无进展生存就延长到了13.8个月!
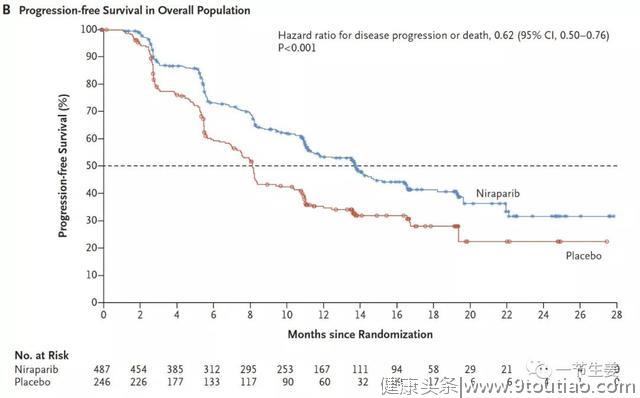
图:PRIMA临床试验PFS生存曲线(来源:文献1)
从健康人的角度,可能很难理解这点治疗优势,不明白半年左右的提高为什么能够被称作“盛世”。
但是如果从患者的角度看,每一个疾病没有复发的日子,都是盛世!她们不用被病痛折磨,也不用死扛化疗的副作用。
说是盛世,其实并非没有危险,只是感慨一步步走到今天不容易,值得珍惜!
PRIMA临床试验的看点一:广谱!尼拉帕利这个药物,属于PARP抑制剂,虽然不是第一个PARP抑制剂药物,但尼拉帕利有一个特点:广谱!
PARP抑制剂一开始出现的时候,发现只是对有BRCA突变或者基因修复功能缺陷的癌细胞有治疗效果[2]。
BRCA在人体里的正常功能,是修复基因在复制过程中出现的错误。这个功能很重要,如果BRCA出现突变,基因修复功能受到影响,就容易发生癌症。美国好莱坞影星安吉丽娜就有这个家族性遗传突变,也正是因为有这个突变,她娘家出现了不少癌症患者,包括因卵巢癌去世的妈妈和因乳腺癌去世的小姨,以及得前列腺癌的舅舅、得汗腺癌的外公。

为了预防乳腺癌,安吉丽娜在2013年作了双侧乳腺切除。两年后,她又手术切除了卵巢和输卵管,以预防卵巢癌。
总之,这个BRCA基因的突变,是一个很糟糕的突变。但是,上天在给你关上一道门的时候,也会打开一道窗!研究发现,正是在这些有BRCA基因突变的患者中,PARP抑制剂的抗癌效果才更好。
为什么呢?
PARP抑制剂的功能是阻碍癌细胞里的基因修复,如果把癌细胞想象成一个运输系统,PARP抑制剂就是铁道游击队。但是,PARP抑制剂刚把铁道破坏掉,癌细胞的基因修复系统就会很快进行修复。
但如果BRCA有突变,或者其他的基因修复系统有缺陷(如HRD),铁路的修复就不容易进行,就会导致运输系统的瘫痪,癌细胞就会死翘翘。
所以,PARP抑制剂一开始的适应症,是有BRCA突变的患者,只有这些患者才能用。
但是尼拉帕利是不一样的烟火,其治疗效果显示了广谱性,即便是没有BRCA突变、基因修复功能正常的患者,也能展示效果。正是因为如此,在2017年,尼拉帕利就被美国FDA批准,成为了第一个所有铂敏感复发卵巢癌患者都可以用的维持治疗药物。
而这次PRIMA临床研究则更进一步证实,即便是在一线治疗中,不管有没有基因修复缺陷,尼拉帕利对患者是来者不拒,都能显示出治疗效果,整体上把疾病进展或死亡的风险降低了38%。
当然了,如果是有突变,尼拉帕利治疗效果会更好。PRIMA试验结果表明,对于HRD型的患者,对照组的中位无进展生存为10.4个月,而进行尼拉帕利维持治疗后,中位无进展生存提高到了21.9个月,翻了一倍!
因为广谱,即便是没有BRCA突变、没有同源重组缺陷型的患者,在化疗之后都有了一个治疗选择:尼拉帕利维持治疗。从实际发生的比例看,有一半的卵巢癌都属于这样的情况。本来没有什么治疗办法的,如今多了一个治疗选项,这是一件很好的事。
总之,尼拉帕利太强大,感觉就是嫌上天窗口开得不够大,直接把它改造成了一道门!
PRIMA临床试验的看点二:一线!尼拉帕利的广谱性优点,其实不是新鲜事了。之前尼拉帕利在美国、欧洲都获得了批准,用于对含铂化疗完全或部分缓解的复发性上皮卵巢癌、输卵管癌或原发性腹膜癌患者的维持治疗,并且已于2018年10月在香港获批上市。
但是,这已经批准的适应症里,有一个关键词:复发!虽然治疗的患者来者不拒,但必须等到复发以后。
也就是说,如果一个患者被查出是卵巢癌,在接受了手术和含铂化疗后,还不能马上就使用尼拉帕利,需要等待复发,要在复发之后再次使用化疗,等获得缓解之后才能使用尼拉帕利。
目前已经批准的适应症,是二线以后的维持治疗。
能不能不用等待复发,直接在一线化疗后就直接使用尼拉帕利呢?
FDA的回答只有一个:Show me the evidence! (拿出数据来)
之前二线适应症获得批准,是因为二线的临床试验获得了成功!
而刚刚公布数据的PRIMA,就是一线辅助治疗的临床试验,如今获得了成功,意味着对卵巢癌的临床治疗方案将会有所改变。一但一线使用获得批准,患者在初诊之后经过手术和含铂化疗,不用等待复发,就可以直接单独使用尼拉帕利作为维持治疗!
PRIMA临床试验的看点三:单药!尼拉帕利的这个最新的临床试验结果,还有一个看点:单药。在完成化疗之后,患者只需要单独使用利拉帕利一个药物,就可以进行维持治疗。
要想靠单药维持治疗,这个药的效果需要很好才行。
就像三国时候,吕布能够单挑刘、关、张三个豪杰,全凭自己本事不错。
当然,有人肯定会问:癌症治疗不是古时候比武逞英雄,毕竟治疗的黄金时机比较重要,可不可以几个药一起上,从而获得更好的“盛世”?
在现代医学里,药物能不能一起用,需要通过临床试验来验证。
如果不管是否有BRCA突变或其他HRD,晚期卵巢癌的一线维持治疗方案,目前单药的只有尼拉帕利可以显示出疗效。多药的方案也有,但并没有显示出更佳的疗效。
如果疗效上没有多少区别,显然单药是更佳的选择。为什么呢?
首先,从药物的价格上看,因为这些抗癌新药目前都是专利药,药价不便宜,如果要作为长期维持治疗方案,同时使用两个以上的药,意味着价格会“强强联合”,可能会让患者受不了。
其次,虽然这些药物的副作用相对比化疗要少一些,但多少还是有的。几个药一起上,除了价格的强强联合,副作用也可能强强联合。
钱可能不是问题,但是副作用却可能是个大问题,让患者对治疗的依从性更加降低。
所以,如果单独一个药就能达到很好的维持治疗效果,真没有必要去用多个药。

PRIMA临床试验目前还在进行中,因为患者的治疗时间还不够长,总生存期数据尚未成熟,但是目前已经看到尼拉帕利治疗的总生存期有优于对照组的趋势。
但是,根据无进展生存期的数据,尼拉帕利就有可能获得批准,作为一线的治疗方案。
对于卵巢癌来说,化疗就是昨天,尼拉帕利是今天。
套用阅兵式的发言,卵巢癌治疗的昨天已经被化疗所建立,卵巢癌治疗的今天正在被尼拉帕利创造,卵巢癌的明天必将更加美好!
没有昨天,就没有今天。
因为有今天,才可能有明天。
参考文献:
1.González-Martín, A., et al., Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. New England Journal of Medicine, 2019.
2. Fong,P.C., et al., Inhibition of poly(ADP-ribose) polymerase in tumors from BRCA mutation carriers. N Engl J Med, 2009. 361(2): p. 123-34.
(作者:张洪涛,笔名“一节生姜”。宾夕法尼亚大学医学院病理及实验医药系研究副教授,研究领域:癌症的靶向治疗以及免疫治疗。著有科普读物:《吃什么呢?——舌尖上的思考》,《如果舌尖能思考》。可以谈最前沿的医学研究,也可以讲最通俗的故事。)
".jpg