人工智能在乳腺癌和前列腺癌的临床应用中的现在和未来
编译:Dr.YY
来源:“EYE2-2EYE”微信公众号
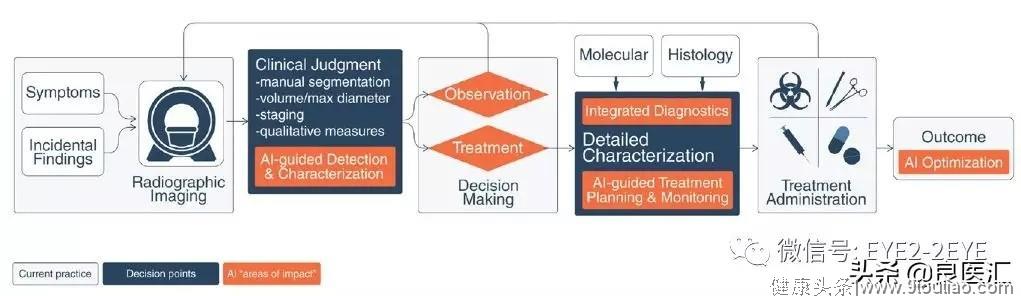
人工智能(AI)有望在临床专家对肿瘤成像进行定性解释方面取得重大进展,包括对肿瘤的体积描绘、从放射学表型推断肿瘤基因型和生物学过程、预测临床结果、评估疾病和治疗对邻近器官的影响。神刊CA开年发表题为《肿瘤影像学中的人工智能:临床挑战与应用》(Artificial Intelligence in Cancer Imaging:Clinical Challenges and Applications )的综述。文章回顾了人工智能在肿瘤影像学中的应用现状。迄今为止,人工智能在肿瘤领域中的研究还没有得到可重复性和可推广性的有效验证,但研究结果显示人工智能正在影响临床应用和肿瘤治疗方向。
在肿瘤治疗的每个阶段都可能会出现困境,比如早期检查,准确区分癌前病变和肿瘤病变,确定手术治疗期间浸润性肿瘤边缘,监测疾病进展和获得性耐药,以及预测肿瘤侵袭性、转移模式和复发风险。医学影像技术和生物标志物为解决肿瘤检测、治疗和监测提供了支持。
当肿瘤病变最初被发现时,需要根据其预测的临床过程和生物学侵袭性进行区分与分型,以优化治疗方案与治疗强度。CT和MRI的广泛应用促进了对临床意义不明的身体内病变的检测,便于医生进行一系列观察、进一步检查或经验性干预,包括手术减瘤,放疗直接和间接诱发肿瘤杀伤机制,以及药物治疗来杀死肿瘤细胞。但肿瘤细胞可以不断适应治疗而不断进化和复发,复发时,肿瘤病变显示出与原发肿瘤不同的分子学异常,可能对药物或放疗产生耐受性,这可能是由于肿瘤的异质性,但常规临床病理取样和分析很难捕捉。无创成像作为最常用的监测治疗反应和提供肿瘤关键信息的方法,需求从未如此之大。
传统的肿瘤影像学评价主要依赖于定性特征,如肿瘤密度、增强模式、肿瘤内细胞和组织成分(包括血管、坏死和矿化)、肿瘤边缘的规则性、与周围组织的解剖关系以及对肿瘤的影响。这些结构基于大小和形状的肿瘤测量可以在一维、二维和三维分析中得以量化。相比之下,一个迅速发展的领域称为放射影像学,它使无线电图像的数字解码成为定量特征,包括形状、大小和纹理模式的描述。
人工智能在医学中自动量化放射影像模式方面取得了巨大进展。深度学习是人工智能的重要组成,是一种特别有潜力的方法,被证明可以自主从样本图像中学习和获取特征,在特定任务的应用中等同甚至超过人类的表现。人工智能的自动化功能提供增强临床医师定性专业知识的潜力,包括精确的肿瘤大小随时间变化的体积测量描述、多个病变的平行追踪、将肿瘤内表型细微差别转化为基因型以及通过单个肿瘤信息与数据库中无限可比案例交叉参考来预测临床预后。此外,深度学习方法保证了疾病和成像方式的更广泛性、对噪音抵抗的稳健性、错误的减少,最终导致早期干预,诊断以及临床治疗的显著改善。
人工智能在肿瘤成像中的应用
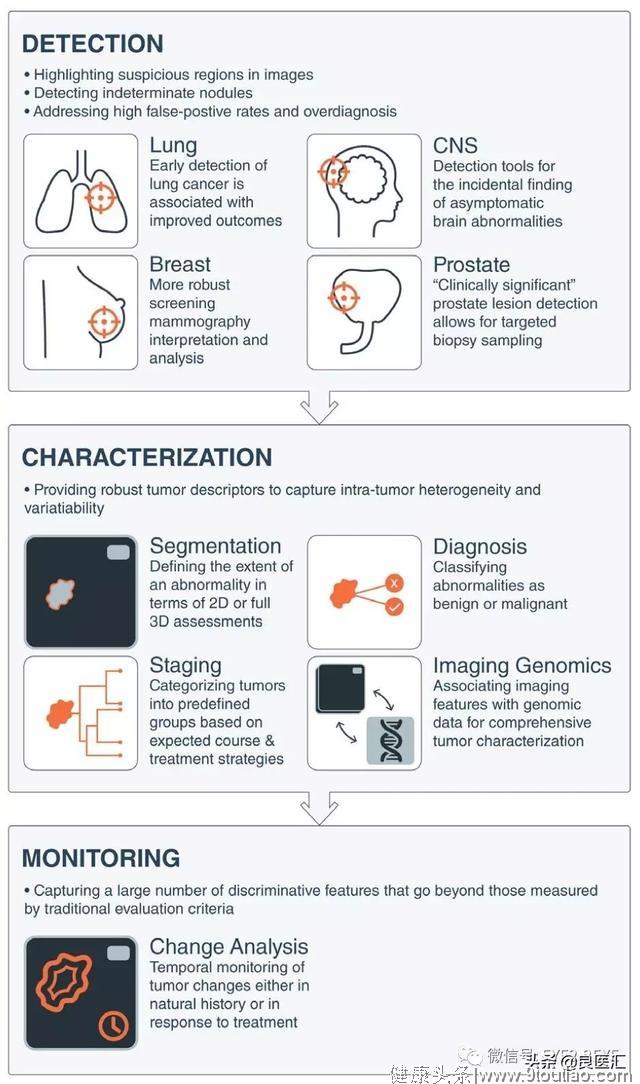
随着对医疗服务需求的不断增加,以及每天从并行流中生成的大量数据,临床工作流程的优化和简化变得越来越重要。人工智能擅长识别图像中的复杂模式,从而提供了将图像解释从纯定性转换为可量化和轻松再现任务的可能;此外,人工智能可以量化来自人类无法检测到的图像信息,从而补充临床决策;还可以将多个数据流聚合到强大的综合诊断系统中,这些系统包括影像学图像、基因组学、病理学、电子健康记录和社交网络。人工智能主要应用于基于图像的三大类肿瘤学临床任务:①异常检测;②通过定义疑似病变的形状或体积、组织病理诊断、疾病分期或分子特征来描述其特征;③实时监测以预测预后或对治疗的反应。
除了成像,其他用于肿瘤诊断和纵向跟踪疾病的微创生物标记物也正在开发中。最值得注意的是,液态活检或循环肿瘤DNA分析。循环DNA从肿瘤细胞释放,实现对肿瘤细胞的动态监测,从而监测疾病进展,实时监测靶向治疗或耐药相关肿瘤突变。一种可能是,液态活检结合影像分析通过无创肿瘤生物学特性准确地评估预后和实时监测疾病,从而显著改善肿瘤治疗,有助于实现精确医疗。人工智能除了向临床医师提供辅助信息外,多项研究也显示了其在临床决策阶段的作用。
人工智能在乳腺癌影像学中的应用
乳腺癌是美国妇女最常见的癌症,也是癌症死亡的第二常见原因。自20世纪80年代以来,乳腺癌5年生存率有了明显提高,这可能要归功于乳腺癌筛查的普及以及乳腺癌治疗方案的改善。乳腺癌是一种异质性疾病,肿瘤的病因、预后和治疗反应各不相同。雌激素受体的存在对于预测特异性治疗(如ER阳性患者服用他莫昔芬)和预后(ER阴性患者的预后较差)至关重要。三阴性乳腺癌是ER阴性,孕激素受体阴性,人表皮生长因子受体2阴性。在标准乳腺X线检查中可能不存在典型的恶性肿瘤征象,诊断发现时更可能是晚期肿瘤,5年生存率较差。影像学和计算机技术的进步使人工智能在乳腺癌影像学中的应用迅速增加,如风险评估、检测、诊断、预后和对治疗的反应。
乳腺癌筛查:乳腺影像报告数据系统
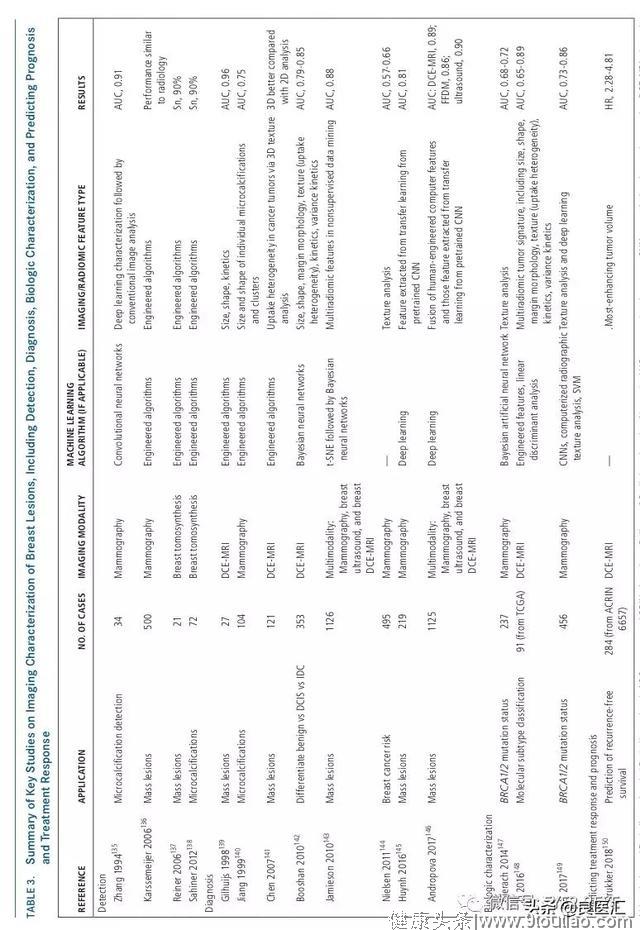
乳腺癌影像学中的CADe和CADx已经发展了几十年。自20世纪90年代末,CADe系统专门用于筛查乳房,X线摄影开始在临床常规中使用。放射科医生对肿瘤的检测受到限制:结构噪声(伪装正常解剖背景)、不完整的视觉搜索模式、疲劳、分心、对细微和/或复杂不易状态的评估、大量图像数据以及乳房图像本身的物理特征。在计算机辅助检测中,目标是定位可疑病变,由放射科医生进行分类。CADe仍在开发用于乳房X线筛查,研究人员也在尝试通过三维超声、MRI和乳腺合成成像结合更精准的深度学习算法自动监测乳腺损伤。CNNs自20世纪90年代早期就被用于医学影像分析,用于检测数字化乳房X线片中的微钙化,以及在乳房X线片上区分活检证实的肿瘤组织和正常组织。最近,人工智能的深度学习方法能够计算机辅助检测乳房MRI、超声和乳房X线检查中的乳房病变。
乳腺癌风险评估:密度
计算机视觉技术已经发展到提取乳腺图像上实质模式的密度和特征,以产生定量的生物标志物,用于乳腺癌风险预测,最终用于个人筛查。基于区域和体积的密度评估都被用于估计乳房X线密度,密度增加是乳腺癌的危险因素,同时也会掩盖病变。乳腺密度是指乳腺中纤维腺组织相对于脂肪组织的数量。在全视野数字乳房X线摄影(FFDM)中,这些组织类型是可以区分的,纤维腺组织比脂肪组织更能减弱X线。FFDM是乳房的二维投影,所以可以估算三维百分比密度值。
除乳腺密度外,还有证据表明实质模式的变异性(例如,表征致密组织的空间分布)也与乳腺癌风险有关。通过放射纹理分析,研究者将偏态测量纳入乳腺X线片的密度变化分析中,表征FFDM区域内灰阶水平的空间分布。其他研究者使用纹理分析和深入学习来讨论BRCA1/BRCA2基因突变。近500例低乳腺癌风险妇女的携带者(或对侧乳腺癌妇女)的研究发现高乳腺癌风险妇女存在致密的影像学特质,其实质形态粗糙,对比度低(AUC,约0.82)。进一步研究已应用纹理分析法对乳腺癌进行风险评估,初步结果表明,纹理特征与乳腺密度的相关性优于数字乳腺图。
深度学习越来越多地被用来评估乳腺密度和实质特征,比如,根据BRCA1/BRCA2表达情况区分乳腺癌正常风险和高风险携带者的学习性能评估。
人工智能提高乳腺癌诊断水平
自20世纪80年代以来,研究人员一直在开发CADx的学习技术,以区分恶性和良性乳腺病变。这些人工智能方法涉及肿瘤的自动特征化,最初由放射科医生或计算机标记。计算机描述可疑区域或病变,并/或估计其发病概率,然后由医生进行患者管理。将人工智能应用于乳腺图像数据,可以量化肿瘤大小、形状、形态、纹理和动力学特征。例如,使用乳腺MRI成像对比剂摄取的动态评估,研究人员可以根据异质性来量化肿瘤,产生空间和动态特征的表型。例如,熵是随机性的数学描述,并提供了在该模式下肿瘤的异质性信息,从而描述造影增强乳腺MRI成像的肿瘤内血管系统摄取(即造影剂摄取)的模式。如NCI的癌症基因组图谱(TCGA)乳腺癌表型组所示,这种分析可能反映血管生成的异质性和治疗敏感性。使用CADx,已经评估了预先定义的和深度学习的算法。有趣的是,研究表明,在区分恶性和良性病变的任务中,使用人工智能或深度学习功能在乳腺病变分类中表现良好,并且这两种方法的“融合”可以达到统计上的显著改善。在3种乳腺成像方式(690例DCE-MRI、245例FFDM和1125例超声)中,“融合”分类器表现最佳,表明在诊断乳腺癌检查中,完全利用人工智能和深度学习肿瘤特征的潜力(DCE-MRI: AUC=0.89 [标准误差=0.01];FFDM:AUC=0.86 [标准误差=0.01]。超声:AUC=0.90[标准误差=0.01])。另有研究显示,使用CNN预训练的转移学习法在2282张数字化屏幕胶片上进行转移学习,并使用FFDMS在324个乳腺断层合成体积上对肿瘤进行特征化,证实其在乳腺断层扫描成像模式之间传输知识的能力。
基于图像分析的生物标志物
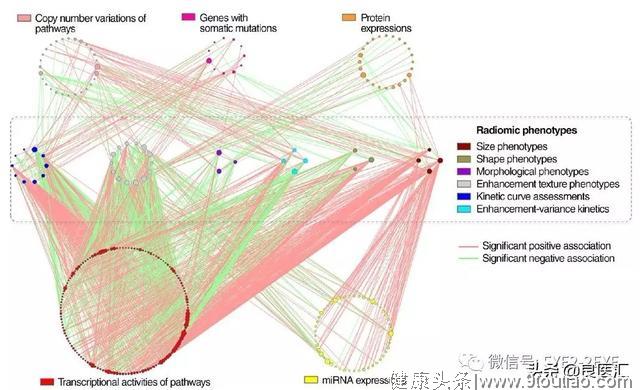
除CADe和CADx外,乳腺影像学中的其他2种人工智能应用包括通过预测精确医学乳腺癌的影像表型来评估分子亚型、预后和治疗反应。乳腺癌研究的一个重要领域是了解肿瘤的宏观表现与其肿瘤微环境之间的关系。这些关系可以尝试从临床乳腺图像和风险、预后或治疗反应的生物学指标中探索。生物标志物的发展得益于患者检查信息的整合(即临床、分子、成像和基因组数据;即通常在诊断检查和后续活检过程中获得的数据)。
NCI的TCGA乳腺表型组的一项合作研究中,多学科研究者对84例实体乳腺肿瘤进行了表型特征分析,以获得有关潜在分子特征和基因表达谱的基于图像的信息。研究人员发现,在两组间存在增强实质和分子亚型(正常样,管腔A,管腔B,富含HER2,基底样)显著统计学相关性,甚至在控制肿瘤大小后(对于病变≤2 cm,P=0.04;对于病变42至≤5 cm,P=0.02)。
美国放射学协作组的(ACRIN)研究发现,在接受新辅助治疗的患者中,乳腺MRI(141例女性:40例复发,101例无复发)半手工描绘的功能性肿瘤体积被确定为无复发生存率的预测因子,显示出自动化的潜力。
人工智能在前列腺癌影像学中的应用
前列腺癌是美国男性最为常见的男性恶性肿瘤,也是与癌症相关的第二大死亡原因,是一种非常常见的癌症,但它具有非常低的疾病特异性死亡率。前列腺癌患者的5年生存率从转移性疾病患者的大约30%到局部疾病患者的100%不等。目前,前列腺癌诊断中的关键临床问题包括:①由于无法预测特定癌症的侵袭性和风险而导致的过度诊断和过度治疗;②活检取样不足导致的误诊和看似低风险前列腺癌患者的疾病进展。在一项荟萃分析中,176例非临床意义前列腺癌的过度诊断率高达67%,导致不必要的治疗和相关的发病率。基于实际情况,有必要将有临床意义的肿瘤(活检Gleason评分为7和/或病理体积为0.5 ml)患者接受治疗,并与无临床意义的肿瘤区分开。
前列腺癌的肿瘤异质性导致不同的临床结果,从无痛溃疡到高发病率和死亡率的高侵袭性肿瘤不同的临床症状或结果,以及患者在治疗计划、治疗反应和预后方面的差异。这反映在将基因组分析纳入了NCCN指南中,包括Decipher、Oncotype DX前列腺癌(Genomic Health Inc,Redwood City,California)、Prolaris(Myriad Genetics Inc,Salt Lake City,Utah)等。与分子特征分析相比,人工智能能够帮助临床医师检测、定位、特征分析、分期和监测前列腺癌。目前还没有广泛的多中心试验,因此大部分初期研究仅限于单中心、单算法分析和小数据分析。一些机构如美国国家卫生研究院和医学计算机辅助教学研究所,正在开发基础设施,以使更大的、注释良好的数据集可用于人工智能开发。主要基于监督机器学习的计算方法已成功地应用于MRI和超声等成像方式,以检测可疑病变并区分临床意义上的癌症。目前深度学习在前列腺癌筛查和恶性肿瘤诊断方面的应用取得了有前景的结果。
多参数磁共振成像(mpMRI)提供了检测和定位可疑临床显著前列腺病变所需的软组织对比度,并提供了有关组织解剖、功能和特征的信息。重要的是,它具备检测所谓“临床意义”疾病的优越能力,即Gleason模式为4或更高(Gleason评分≥7)和/或肿瘤体积>0.5 cm3。近年来,前列腺癌的mpMRI检查量有所增加,因为它能够检测这些病变并进行有针对性的活检取样。英国一项大型研究表明,使用mpMRI作为初级活检前的分类可将不必要的活检次数减少四分之一,并可减少过度诊断。这在小于最佳值的数据集中得到进一步验证。在500例患者的多国PRECISION研究中,与10~12核经直肠超声引导活检(38%对26%)标准治疗相比,179例随机在活检前接受mpMRI检查的患者的临床意义疾病的检测显著增加。2015年,欧洲泌尿生殖学会、美国放射学会和ADMETECH基金会公布了第二版的前列腺影像报告和数据系统(PI-RADS)。这为放射科医师阅读和解释前列腺mpMRI提供了指导,目的是提高结果解释和交流的一致性。在过去的10年中,CADe和CADx系统用于检测、局部定位和描述前列腺肿瘤。与PI-RADS结合,CAD系统可以提高评分的可靠性,并提高mpMRI读取和解释的诊断精确性。
人工智能在前列腺癌检测的应用中显示出持续的进步。最近研究显示,从特征工程和经典机器学习方法向深度学习和使用大型训练集的转变。与肺癌和乳腺癌不同,前列腺癌的临床常规尚未采用规范的CAD系统。但是,最近在中型数据集(如PROSTATEx Benchmark)上的深度学习技术取得的成果是很有价值的结果。全世界前列腺MRI检查量快速增长,对准确解读的需求也日益增加。准确的计算机辅助系统将提高前列腺MRI读数的诊断准确度,这将使患者得到更好的治疗,因为良性和假阳性肿瘤患者较少需要进行侵入性活检和/或根治性前列腺切除术,这会降低他们的生活质量。相反,早期发现前列腺癌可改善有临床意义的前列腺癌患者的预后(Gleason模式4)。计算机辅助前列腺癌检测和诊断系统将有助于临床医师降低诊断性MRI中可疑目标丢失或过度诊断的可能性,尽管在常规临床应用前的尚需要临床研究验证。
挑战与未来
尽管人工智能在肿瘤影像学方面取得了不少进展,但距实现临床应用仍存在一定的限制与阻碍。如此大的数据量需要更具备系统组织管理,需要更容易获取,同时还要考虑到患者隐私,目前研究组织尚未对特定的数据集的应用与分享达成共识。另外,人工智能的理解能力也就是对特定结果的原因进行整合逻辑推理的能力,也存在局限性,预测失败的能力仍需提升。尽管目前研究更注重表现而非解释和透明,人工智能的理解力仍是研究热点。另外,伦理问题和监管问题也需要解决。
影像学并不是独立的疾病度量方法,多项研究显示,肿瘤的分子生物学特征包括肿瘤的生物标志物、社会经济地位,甚至社会网络,对肿瘤患者的预后都有影响。数据源也迅速扩展到直接医疗数据之外,包括可穿戴设备、手机、社交媒体、非结构化电子健康记录以及数字时代的其他组成部分。随着时代的进步,人工智能非常适合于整合平行的信息流——来自生物学、人口统计学和社会学,实时改进对患者结局的预测模型。
对于成像分析,人工智能的准确性和预测能力还需要显著提高,如果人工智能取代临床医师的特定工作流程,需证明其比医学专家能有更精准的专业判断。这或许在一些特定疾病条件下显示出初步希望,但仍需更多的临床实用性验证。尽管在查看人工智能生成的数据和结果时,对人们来说像是面对一个“黑盒子”,但是越来越多的工具可对如何做出决策进行可视化解释。
在全球范围内,如果无法接触到专业临床医师或接触到不常见的病理特征,人工智能可能会提供疾病解释方面的“专家”经验。相反,如果没有医学专家提供的基本事实,人工智能可能会破坏临床医师和患者现在熟悉的传统工作流程。此外,在监测卫生资源和结果中使用人工智能将可能提高效率并降低成本。与任何新的创新技术一样,人工智能在医学应用中的发展超越了当前的想象。