审批加速 中国患者可望比欧美更早获得新药
8月6日,辉瑞公司宣布全球首个细胞周期蛋白依赖性激酶(CDK)4/6抑制剂Ibrance(下称爱博新)已于7月31日获中国国家食品药品监督管理局(下称国家食药监总局)批准。这打破了国内近10年来晚期乳腺癌治疗无重大进展、缺乏突破性创新疗法的局面。
据悉,新药获批后通常会在2-3个月左右在国内上市,即医院开出处方,患者买到药。这也意味着爱博新即将于今年10-11月间上市,但目前尚无爱博新的定价信息。
爱博新之所以能在如此短的时间内获得CFDA的审批,主要得益于我国对药品审批制度的改革。
新药审批时限与发达国家接近
“近年来,我国对境外上市新药的审批速度明显提高。”国家药品监督管理局(下称国家药监局)局长焦红介绍说,近10年来,在美国、欧盟、日本上市的新药有415个,其中我国已上市或申报的新药有277个,占比66.7%。从新药临床审批和上市审批的总时限看,我国与发达国家的审批法定时限接近。
与此同时,为了让群众早用上境外上市新药,从4月12日至今,国家药监局针对国内临床需求,科学简化审批流程,加快临床急需的境外上市新药审评审批工作,共批准7个防治严重危及生命疾病的境外新药上市。比如,预防宫颈癌的九价HPV疫苗、治疗丙肝的第三代产品索磷布韦维帕他韦片。
“对于境外已上市的防治严重危及生命且无有效治疗手段疾病以及罕见病的药品,同时经研究确认不存在人种差异的,申请人无需申报临床试验,可直接以境外试验数据申报上市,提前2年时间进入中国市场。”焦红说。
自今年4月以来,国家已陆续出台多项简化境外上市新药审批的政策,境外上市新药审评审批工作已取得积极进展。
4月24日,国家药监局对外发布《关于进口化学药品通关检验有关事项的公告》,取消进口化学药品逐批强制检验,加强上市后的监督抽验。相关政策实施后,进口化学药品从口岸通关后可直接配送至医疗机构、零售药店,可缩短进入中国市场时间2-3个月,降低境外新药进入中国市场的成本。
5月17日,国家药监局会同卫生健康委发布《关于优化药品注册审评审批有关事宜的公告》,大幅简化境外上市新药审批程序。对于境外已上市的防治严重危及生命且无有效治疗手段疾病以及罕见病的药品,同时经研究确认不存在人种差异的,申请人无需申报临床试验,可直接以境外试验数据申报上市,药品上市时间将加快1-2年;对需要在我国开展临床试验的境外新药,将临床试验阶段的注册检验由逐一检验调整为根据审评需要检验,这进一步缩短企业检验周期,从而进一步加快上市。
7月27日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,促进药品医疗器械产业结构调整和技术创新。公告显示,申请人按相关要求提交新药首次临床试验申请和申报资料。药审中心在收到申报资料后5日内完成形式审查。符合要求或按照规定补正后符合要求的,发出受理通知书,自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验。
据了解,国家药监局正在努力加快审批工作,且审批队伍也在迅速扩大,预计今年年底可达1000人,而此前2014年只有不到100人。同时,等待审批的积压申请(主要是仿制药)也从19000减少到4000个。
我国政府对新药审批审批环节的完善,使得我国新药进口上市后变“旧药”的局面得到了巨大改观。对此,江苏恒瑞医药股份有限公司董事长孙飘扬表示,“无论是申请临床研究,还是申请新药生产,现在审评审批的速度大大加快了,成效显着。”
跨国药企对华市场重视增强
在过去,中国的药物审批程序对处方药进口产生巨大“影响”。据中国药品监督管理局统计,2001年和2016年期间,西方国家批准的433种新药中,只有三分之一进入中国。
据人民日报报道,我国创新药从递交临床申报材料到拿到许可批件,需要18个月之久。而从递交材料到得到反馈,澳大利亚是5天,美国、韩国是1个月,新加坡是1—2个月,巴西是2个月,欧盟是3个月,印度、俄罗斯是3—4个月,墨西哥是4—9个月。“我国创新药审批所花的时间,在全世界可能都是最长的。”有专家直言。
现如今,药品审批改革实施不到一年,中国患者就可以期待比美国患者更快获得某些突破性新药。例如,英国阿斯利康公司最新的贫血治疗药物有望率先进入上海和北京,比美国早一年。
去年10月,中国监管机构废除了一项要求,使得申报新药进口得以不必重新进行所有临床试验,同时该举措也意味着大型医药公司有望以与美国同步的速度在中国推出重磅新药。
“从现在起二十年内,中国的市场将与美国具有同等当量,甚至更大。”美国Polar Capital的基金经理Daniel Mahony博士说:“今天听起来,新药在中国获得首次批准好像不太可能,但5年内未必不会实现。”
市场因供需而变,跨国药企瞄准中国市场也不无道理。一方面,中国未来医疗市场巨大,跨国公司不得不提高对中国市场的重视程度;另一方面,随着经济和社会的发展,中国疾病谱正在悄然发生改变,抗癌、肿瘤等疾病的新药需求日渐上涨。
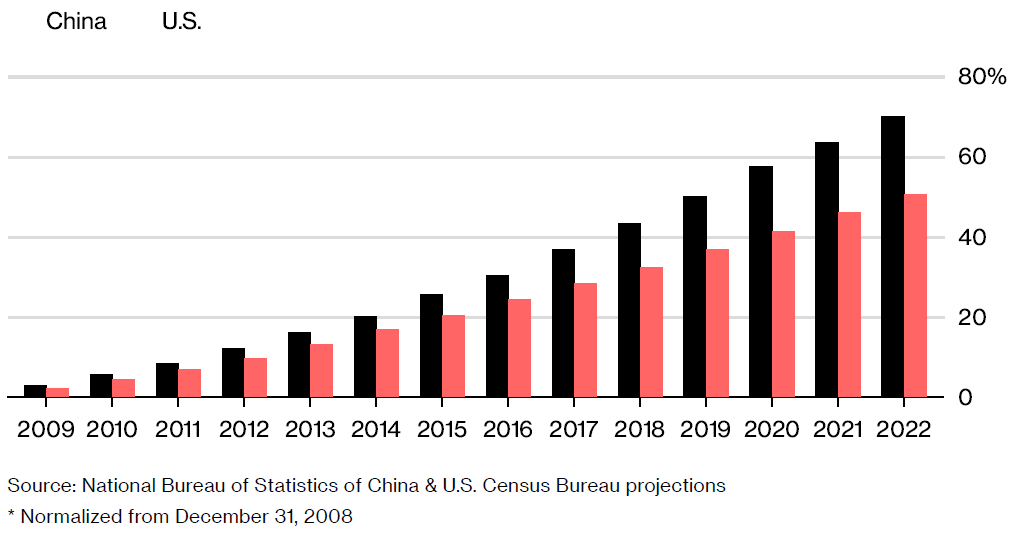
▲65岁及以上的中国人口增长速度快于美国
(资料来源:中国国家统计局和美国人口普查局预测)
中国由于人口迅速老龄化的趋势、饮食结构的变化以及工作压力的增加,肥胖、糖尿病、哮喘和肠道疾病等炎症的患病率正在逐年提升,同时由于我国缺乏癌症、糖尿病和肾脏疾病等重大疾病的创新疗法,中国的14亿人正在成为全球医药行业的重要目标。
此次,即将在中国上市的爱博新也是很好的顺应了我国疾病谱的变化。资料显示,乳腺癌是严重威胁全世界女性健康的第一大恶性肿瘤。2015年,中国新发乳腺癌病例达27.2万,死亡约7万余例。晚期乳腺癌的形势更为严峻,每年10个新发患者中就有1个被确诊为晚期。
近期,一篇在《Nature》发表的文章也指出,过去五年全球批准的42种抗癌药物中,只有4种在中国问世,这也意味着中国癌症患者用药目前多依赖于进口药物。
为提高疾病治疗药物的覆盖率,去年中国医保的覆盖范围新增了100多种进口药,包括阿斯利康的心脏病药物Brilinta、罗氏的抗癌药Herceptin以及GlaxoSmithKline的Viread,其中一些药物的价格比美国或欧洲的售价低50%。
FibroGen的中国业务副总裁Chris Chung博士面对中国市场的快速增长,表示超出预期,“我们没有预测到中国市场的快速扩张。”
以糖尿病药物Actos而闻名的日本武田制药也早已看准中国市场。该公司首席执行官Christophe Weber博士说,“我们计划五年内在中国推出7款新药,这比世界上其他任何地方都要多。我们中期的目标是将中国纳入新药研发早期阶段。”
药品审评审批改革推进新药研发
“医药审批改革是场‘攻坚战’,绝非短时间能见分晓。”沈阳药科大学教授、药物信息协会全球理事会前主席、礼来亚洲基金风险合伙人苏岭指出,医药审批制度改革是一项渐进的事业,国家食药监总局始自去年的改革,已经取得了一些立竿见影的成效。
随着药品研发、生产、流通的全球化进程加快,药品审批资源的全球共享正在成为趋势。据了解,国家食药监总局正积极推进我国的审批制度和国际标准接轨,通过主动地“引进来”,帮助中国医药“走出去”。近年来,国家药品审评中心专家队伍不断发展壮大,其中不乏从国外引进的高水平专家。
积极地引进来,从而推动中国医药走出去,也是国家食药监总局积极推进审批制度与国际标准接轨的策略之一。“目前看上去是很多国外制药企业研发的新药,跑到中国来做临床、开发。但是再过十年八年甚至更短的时间,中国一定会有更多新药走出去,到那时,在中国研究或者开发的数据也会被国外接受。因此,我国参与国际规则的制定、获得话语权尤为重要。”苏岭表示,相信未来中国会逐渐加入制定国际标准的行列,一步步实现医药审批体制改革的目标。
药物研发生态得到净化和规范,对药物创新十分有利。中国药学会理事长孙咸泽认为,药审改革中鼓励药物研发创新的导向也越来越明显。“比如上市许可持有人制度的推行,减少了药品研发者的资金投入和时间成本,新药上市大约减少了三到五年的时间。此外,优先审评审批制度的建立,给新药研发省去了更多时间成本。”
我国实施的审评审批制度改革从促进我国医药产业的创新发展、参与国际竞争、保障公众健康的高度出发,对改善人民生活、提高人民生活质量具有意义重大。由此产生的积极影响,国家食品药品监督管理总局副局长吴浈做出了以下三点总结:
第一方面是满足了公众用药需求。满足公众用药急需,归根到底要靠创新,只有创新才能研发出更多的质量高、疗效优的新药好药,才能使更多的新药好药在中国上市。我们在制度设计里有些优先审批,加快审批,通过这些来降低研发成本,有利于降低新药上市价格,更好的实现药品的可及性。我们既要有新药,还要有能让老百姓用得起的新药。
第二方面是提高仿制药的质量和疗效。我们讲要鼓励创新,既要鼓励原始创新,也要鼓励消化吸收再创新。我们要求仿制药和原研药的质量疗效要一样,要做一个好的仿制药仍然需要有创新的能力。
第三方面是推动药品供给侧结构性改革。要使我们的医药产业做大做强,使我们的医药产业更具竞争力,改变我们国家的新药长期依赖进口,这也是我国创新型国家战略在医药行业的具体实施。