临床推理:这种病因引发的卒中,你会诊治吗?
病例概述
患者为77岁白人男子,因“发作性运动性失语1周”就诊于急诊科。患者于1周前出现发作性运动性失语,每次持续3-30min,并且频率逐渐增加。患者否认其他任何与失语症有关的症状,在发作间歇也没有其他任何症状。
既往病史:银屑病关节炎、远端活检证实的巨细胞动脉炎(GCA)和转移性尿路上皮腺癌,并为此接受程序性死亡分子配体-1(PD-L1)免疫检查点抑制剂治疗。
包括语言在内的最初神系统经检查未见明显异常;肌肉骨骼检查提示慢性关节炎,可见手背软组织萎缩和骨关节肥大,但无活动性滑膜炎;皮肤、心肺以及胃肠道未见异常。
最初的头颅MRI(图1)显示右侧内囊急性梗塞,Flair相提示小血管病外余未见明显异常。CT血管造影显示颅内大血管严重狭窄:右侧颈内动脉(ICA)末端、左侧M1段近端和左侧A1起始部几乎完全闭塞;其他颅内和颅外颈动脉仅有轻微的动脉粥样硬化性病变。患者开始使用双重抗血小板治疗(阿司匹林和氯吡格雷)以及大剂量他汀类药物。
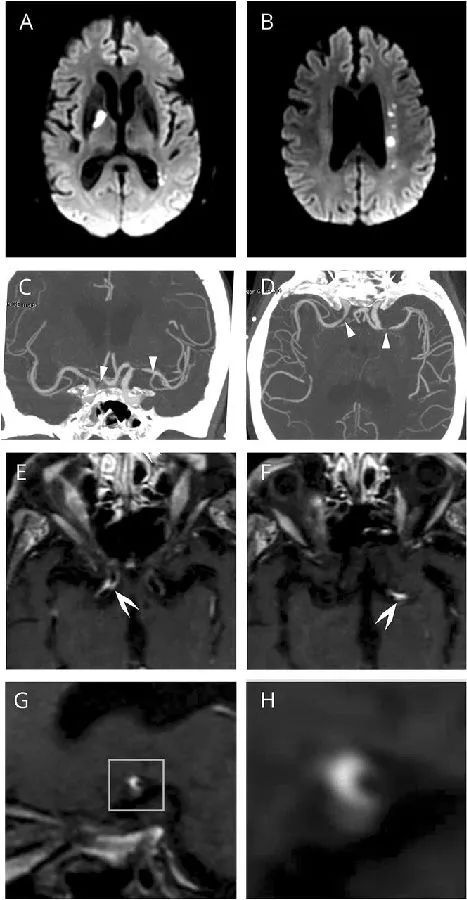
➤ DWI序列显示右侧内囊(A)和左侧放射冠(B)急性缺血性梗死灶;
➤ CT血管造影冠状位(C)和轴位(D)影像显示右侧颈内动脉(ICA)末端和左侧大脑中动脉(MCA)M1段高度局灶性狭窄;
➤ 高分辨对比增强血管壁成像(黑血T1加权MRI)显示右侧ICA末端(E)和左侧MCA近端(F)明显壁内增强;
➤ 左侧MCA的矢状层面(G;H为放大图)显示出与血管壁炎症一致的新月形增强。
思考:
1.颅内大动脉局灶性近端狭窄的潜在病因有哪些?
2.需进行哪些进一步检查以助鉴别诊断?
病因分析及鉴别诊断
颅内大血管狭窄可能由颅内动脉粥样硬化性疾病、血管炎、血管痉挛或感染等引起。颅内动脉粥样硬化是最常见的病因,在白人缺血性梗死中占5%-10%,而非洲裔美国人和亚洲人中甚至更高。颅内大血管狭窄还可能与疱疹病毒(水痘带状疱疹病毒[VZV]、巨细胞病毒以及Epstein-Barr病毒)、疏螺旋体病、梅毒和HIV等在内的感染相关。
血管痉挛导致的血管狭窄可见于可卡因的使用、可逆性脑血管收缩综合征以及非炎性血管病如纤维肌性发育不良和烟雾病。最后,包括巨细胞动脉炎、Takayasu动脉炎和肉芽肿性血管炎在内的血管炎(包括原发中枢神经系统性和系统性)均可出现局灶性颅内大血管狭窄。
系统性红斑狼疮、白塞氏病、抗中性细胞胞浆抗体(ANCA)相关性血管炎、结节性多动脉炎和冷球蛋白血症性血管炎也与颅内血管炎相关,尽管伴有神经系统以外的临床表现。血管内淋巴瘤中的大B细胞淋巴瘤亚型可以因肿瘤细胞浸润血管壁而引起中小血管变窄。
因此,其他确诊需要的检查应包括动脉粥样硬化的危险因素检查、全身性和CNS感染的评估、脑脊液检查、全身炎症标志物以及风湿性因子、抗核抗体(ANNA)和ANCA等风湿病筛查。头颅CT和MRI以及血管造影也需要。高分辨率血管壁对比增强黑血技术T1加权成像对血管炎也有诊断价值。
该患者头颅磁共振血管造影(MRA)显示沿右侧ICA床突段延伸至M1段可见明显壁内增强,左侧也可见类似的增强延伸至左侧M1段近端,高度提示血管炎。其低密度脂蛋白为96 mg/dL和A1C为5.9%,可以排除慢性代谢性危险因素。
全身炎症标志物适度升高(C反应蛋白为24和沉降率为40);风湿病筛查显示ANA和ANCA为阴性、C3和C4补体正常以及类风湿因子弱阳性(20 IU/mL)。超声心动图未见异常。血液和脑脊液培养和单纯疱疹病毒(HSV)-1、HSV-2及VZV的快速PCR检测均为阴性。CSF分析显示总蛋白为62 mg/dL、葡萄糖为62 mg/dL、无寡克隆条带以及免疫球蛋白G指数升高为8.4 mg/dL。针对恶性肿瘤的CSF流式细胞术为阴性。
对患者的外院病历进一步调查证实,患者既往银屑病性关节炎,并使用低剂量甲氨蝶呤(每周一次)和泼尼松(5mg/日)。此次发病前14年,患者出现新发严重头痛以及炎症标志物升高,右侧颞动脉活检提示GCA。为此患者继续使用强的松(每日)和甲氨蝶呤(每周)治疗其GCA和炎性关节炎,两者多年来一直处于临床缓解状态。
此次发病前9年,患者被诊断为IV期高级别肌层浸润性膀胱上皮癌。患者先接受了手术治疗,随后顺铂和吉西他滨联合化疗,化疗期间停用甲氨蝶呤。发病前7个月,由于转移性癌症进展,该患者开始使用阿特珠单抗(一种PD-L1检查点抑制剂)并停用泼尼松。
综合患者的GCA病史、实验室检查结果和MRA结果提示双侧颅内血管炎,并且与颅内GCA最为一致。GCA在停止免疫抑制剂治疗和开始检查点抑制剂治疗时复发。
思考:
1.什么是GCA,经典治疗方法如何?
2.如果累及颅内血管,GCA的治疗方法有何不同?
治疗策略
GCA是50岁以上人群中最常见的血管炎。女性患病风险是男性的2-3倍,发病率随年龄增长而增加,90岁以上人群每5,000人就有1人患病。
GCA通常影响主动脉的分支和颈外动脉。在活检证实的病例中,GCA相关性卒中的发生率为2%-7%。有趣的是,大多数卒中发生在GCA诊断的第一年,由此产生低剂量阿司匹林联合免疫抑制剂治疗的临床治疗方案。与该患者不同的是,超过75%的GCA相关性卒中累及椎基底动脉系统。
大剂量全身应用皮质类固醇是GCA的标准治疗方案。初始用药方法和剂量取决于临床表现的严重程度,通常冲击治疗后给予1mg/kg/d的剂量,并在6-12个月内逐渐减量。目前还没有关于激素节制治疗的相关指南。但越来越多的证据表明抗白细胞介素-6(托珠单抗)以及T细胞共刺激抑制剂(阿贝西普)联合皮质激素可降低GCA的复发率并可改善预后。
GCA相关性卒中的管理需要大剂量全身性皮质类固醇以有效进行免疫抑制。冲击治疗或1-2 mg/kg/d的甲基泼尼松龙均有使用,但孰优孰劣尚未明确。GCA相关卒中患者的存活率较差,并非所有患者都对初始类固醇治疗有反应。环磷酰胺可用于严重或难治性GCA病例。还有研究报道了可加用抗血小板药物和低分子量肝素,但这些药物的疗效尚未得到证实。因此,GCA相关卒中尚无明确的治疗方案。
该患者入院后几天内出现发作性找词困难。这些症状起初对静脉水化和特伦德伦伯(氏)卧位有反应。当怀疑是由GCA重新激活引起后该患者开始接受大剂量(1 mg/kg/d)甲基强的松龙治疗。但上述症状发作的频率和持续时间逐渐增加,在第5天出现持续的非流利性语言以及难以遵循口头指令。
随后的头颅MRI发现左侧大脑中动脉(MCA)区域出现新的缺血病灶。尽管激素剂量调整为冲击治疗剂量以及加用了环磷酰胺,其MCA分布区出现完全梗死并出血转化。患者家属最终决定采取安慰措施,患者于2周后死亡,其家属拒绝验尸。
讨论
该患者接受了阿特珠单抗治疗,一种靶向程序性死亡分子配体-1(PD-L1)的单克隆抗体,是免疫检查点抑制剂(ICI)中的免疫调节剂。研究显示癌细胞利用先天性免疫检查点系统来阻止免疫监测防御。抑制检查点系统可使免疫系统识别和杀死癌细胞。抑制免疫系统检查点机制也可以防止消除有害的自体反应性淋巴细胞并导致各种自身免疫并发症。
与ICI有关的免疫不良事件是一种相对较新且逐渐被认识的现象。这些事件可以类似于自身免疫疾病,表现为炎性关节炎、结肠炎、肺炎、肾炎和心肌炎等特征。有关使用免疫检查点抑制剂治疗重新激活已有自身免疫性疾病的报道相对较少,但不断增加。因此需要及时识别并终止ICI,同时针对自身免疫疾病给予治疗。
检查点抑制剂治疗的神经系统并发症也日益得到认识,包括头痛、癫痫发作、颅神经病和多发性神经病。最近的一项研究显示,347位使用抗PD1疗法的患者中有2.9%发生了神经系统并发症(主要是肌病和神经病)。最近的个案报告报道了抑制PD-1可导致脑血管炎。
值得注意的是,吉西他滨和顺铂应用也会引起血管炎(包括脑血管炎)。但这些报道中的血管炎发生在药物使用数月内,而该患者在发病前至少7年已经在使用化疗药。
该患者死于严重的颅内复发性GCA。免疫检查点抑制剂正在彻底改变许多实体瘤的治疗方法,并越来越受欢迎。本文报道的病例是因GCA的重新激活所致,强调了要对抗PD-L1和抗PD-1治疗相关免疫不良事件及时识别和给予适当的治疗。