失眠症新药!卫材双效食欲素受体拮抗剂lemborexant III期临床显著改善睡眠质量
本文系生物谷原创编译,欢迎分享,转载须授权!
日本药企卫材(Eisai)与普渡制药(Purdue Pharma)近日公布了实验性失眠症药物lemborexant治疗失眠症(一种觉醒节律紊乱)的长期III期临床研究SUNRISE-2的6个月疗效和安全性数据。

该研究是一项全球性、多中心、随机、对照、双盲、平行组研究,共入组了949例成人(18-88岁)失眠症患者,其中约28%的患者年龄在65岁或以上。该研究评估了lemborexant相对于安慰剂的疗效和安全性。在研究的前6个月中,患者被随机分成3个组,分别接受5mg剂量lemborexant、10mg剂量lemborexant、安慰剂。研究的主要和关键次要疗效目标通过电子睡眠日记采用患者自我报告进行评估。
结果显示,在为期6个月的安慰剂对照治疗期结束时,与安慰剂组相比,接受5mg剂量和10mg剂量lemborexant治疗的患者在患者报告的(主观)睡眠开始潜伏期(sSOL,主要疗效终点)以及主观睡眠效率(sSE)和主观睡眠中觉醒时间(sWASO)方面表现出统计学意义的显著改善,达到了研究的主要疗效终点和关键次要疗效终点。
6个月研究结果显示:(1)在6个月治疗结束时,lemborexant 5mg剂量组(-21.81分钟)和10mg剂量组(-28.21分钟)sSOL从基线的中位数降低比安慰剂组(-11.43)更大,数据具有统计学意义(均p<0.0001)。(2)在6个月治疗结束时,lemborexant 5mg剂量组(14.19%,p=0.0001)和10mg剂量组(14.31%,p<0.0001)sSE从基线的改善比安慰剂组(9.64%)更大,数据具有统计学意义。(3)在6个月治疗结束时,lemborexant 5mg剂量组(-46.75分钟,p=0.0005)和10mg剂量组(-41.95分钟,p=0.0105)sWASO从基线的降低比安慰剂组(-29.28分钟)更大,数据具有统计学意义。
该研究中,报告的大多数不良事件为轻至中度。严重不良事件发生率分别为2.2%(lemborexant 5mg剂量组)、2.9%(lemborexant 10mg剂量组)、1.6%(安慰剂组),只有一例被认为与治疗相关。最常见的不良事件(lemborexant治疗组发生率>5%,且高于安慰剂组)包括:嗜睡、头痛和流行性感冒。因不良事件导致的停药率在安慰剂和lemborexant 5mg剂量组(分别为3.8%和4.1%)具有可比性,而lemborexant 10mg剂量组的停药率更高(8.3%)。
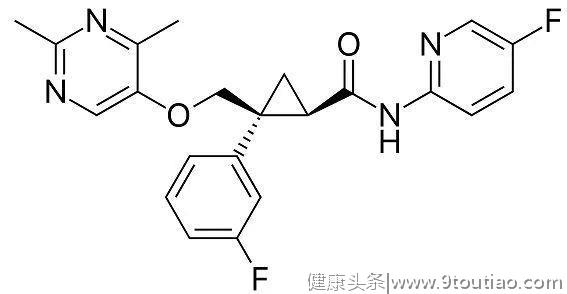
lemborexant分子结构式(图片来源:Wikipedia)
卫材神经病学业务组首席临床官兼首席医疗官Lynn Kramer表示,“这些发现增加了越来越多的临床数据来支持开发lemborexant治疗失眠,我们期待在未来的科学会议上公布这项研究的12个月结果。我们希望为医生和病人带来一种药物,帮助病人晚上睡得好,早上醒得好。”
SUNRISE-2是卫材与普渡制药开展的lemborexant治疗失眠症的2项关键性III期研究中的一项。这2项研究的数据支持了2018年12月27日向美国FDA提交lemborexant治疗失眠症的新药申请(NDA)。在日本,卫材计划在2018财年提交lemborexant的NDA。
lemborexant是欲素受体OX1和OX2双重抑制剂,由卫材内部发现和开发,该化合物通过竞争性结合2钟亚型的食欲素受体(食欲素受体1和受体2)抑制食欲素。在失眠障碍个体中,调节睡眠和觉醒的食欲素系统可能不能正常发挥功能。在正常的睡眠周期内,食欲素系统的活动被抑制;这揭示可能通过lemborexant干扰食欲素能神经传递,有目的的促进睡眠的启动和维持。
目前,卫材正与普渡合作开发lemborexant用于多种睡眠障碍的治疗。其中,一项II期临床研究正在评价lemborexant治疗存在觉醒节律紊乱(ISWRD)和轻至中度阿尔茨海默病(AD)患者中的疗效和安全性。
相关活动推荐:

直播日期 2019/03/06 14:00
本讲座将介绍量子级联激光红外成像技术(LDIR)在药物成分分布、晶型筛选、盐交换研究、多层片剂分析上的应用。相对于传统的配方分析技术,如红外成像和拉曼成像等技术,LDIR技术最新量子级联激光器(QCL),用化学成像的方式使配方含量分析的速度成倍提升。