诱导性多能干细胞研发新型抗癌疫苗
“癌 症疫苗”,一直是领域内许多研究人员的梦想。我们现在所见的癌症疫苗一般都是“治疗性疫苗”,通过增强免疫系统攻击肿瘤的能力,减小、甚至消灭肿瘤。然而 这和我们认知中的疫苗不太一样,从小到大,我们接种的都是预防性疫苗,将疾病扼杀在摇篮中的那种,那癌症能不能也这样呢?
在不久前的《细胞 干细胞》杂志上,斯坦福大学心血管研究所负责人Joseph Wu博士和他的同事就发表了一项癌症预防性疫苗的研究[1],他们使用诱导性多能干细胞(iPSCs)作为疫苗的“本体”,在小鼠中成功抑制了移植的癌细胞发展为肿瘤,有几只接种了疫苗的小鼠存活时间超过一年,抗体水平始终保持如初,再次移植的癌细胞也被免疫系统“团灭”。

Joseph Wu博士
他们是怎么做到的呢?
故事要从胚胎干细胞说起。胚胎干细胞本身有可能癌变,发展成畸胎瘤,而癌细胞的无限增殖特性也和胚胎干细胞有着相似之处,这种相似让研究人员忍不住猜测,从分子角度上来说,胚胎干细胞与癌细胞是不是也“表里如一”的相似呢?结果研究发现,胚胎干细胞与多种癌细胞果然“共享”转录组和抗原[2,3]。
那么让我们回想一下,传统疫苗是怎么做的?是将减毒或灭活的病原体上的大量抗原提呈给免疫细胞,让免疫系统记住它们,在病原体再次入侵时就可以循着记忆去消灭。所以这就意味着,让胚胎干细胞来“扮演”这个病原体,它就能成为癌症疫苗了。
但是呢,胚胎干细胞的应用有非常严肃的伦理问题,真正进行临床研究或是推广都会面临巨大的挑战。不过还好它们有“替身”——iPSCs,将转录因子用载体送入成熟细胞中,细胞会发生重编程,重获多能性,这样得到的iPSCs从形态和功能上都和胚胎干细胞相似[4],所以,研究人员希望能用iPSCs来代替胚胎干细胞成为疫苗。
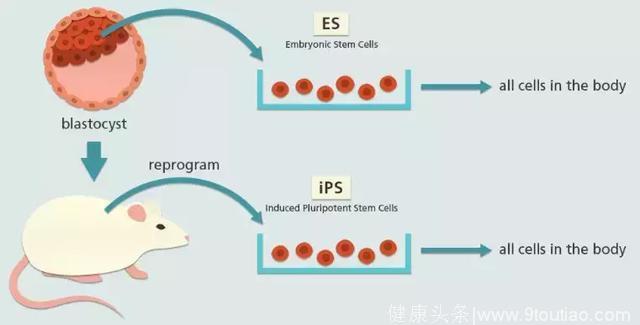
虽然来源不同,但是胚胎干细胞(ES)和iPSCs外形相似,且都具有多向分化的能力
完成这个愿望的第一步就是要验证iPSCs是否也像胚胎干细胞一样和癌细胞具有相同的抗原。研究人员将11种不同来源的人源iPSCs与癌症数据库中的数十种癌细胞系进行比较,发现它们的基因表达谱有显著的相似性,共享表面抗原。这一点在小鼠中也得到了验证。
接下来就是看看iPSCs做成的疫苗是不是真的能“预防”癌症了。普通的疫苗要将病原体灭活或减毒,研究人员也对iPSCs进行了射线照射处理,这样iPSCs就不会形成肿瘤,可以安心地做疫苗了。
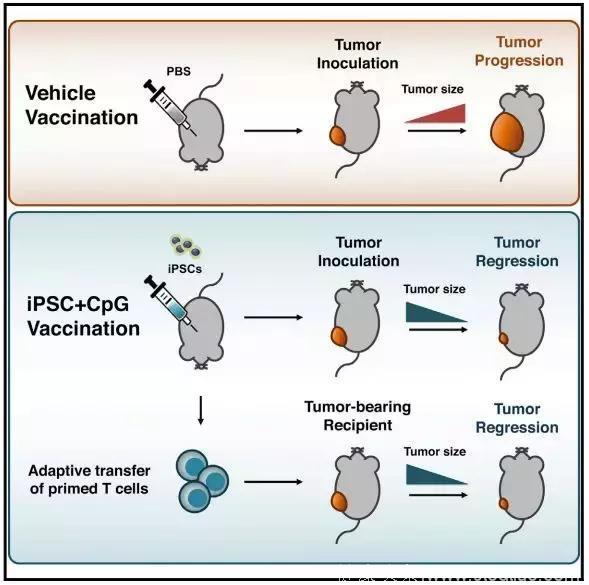
研 究人员将小鼠分为4组,其中一组是注射磷酸缓冲液的对照组,其余三组中,一组注射免疫刺激剂CpG寡核苷酸,一组注射iPSCs,最后一组注射 iPSCs+CpG。CpG作为免疫刺激剂,可以激活树突状细胞、抗原呈递细胞等免疫细胞,促进免疫应答,抑制肿瘤生长,给iPSCs打个配合。

这 些小鼠每周接受一次注射,一共注射4次。准备工作做好之后,研究人员给每只小鼠皮下注射了5x104个乳腺癌细胞,1周后,小鼠们都出现了凸起的肿瘤,但 是iPSCs+CpG组明显要小一些。4周后,研究人对每组的10只小鼠执行了“杀一半,留一半”的政策,处死的小鼠用来观察肿瘤的消退情况,对血液、脾 脏和淋巴结进行免疫学分析,留下的5只则用作长期观察,看看“感染”了癌细胞后,疫苗是不是能帮助它们长期存活。
结果研究人员发现,iPSCs+CpG的组合还是非常有用的,处死的20只小鼠中,iPSCs+CpG组有3只已经几乎看不到肿瘤了,另外2只的肿瘤体积也明显减小。通过流式细胞术,研究人员发现接种了疫苗的小鼠抑制免疫反应的调节性T细胞减少,效应T细胞、记忆T细胞和抗原呈递细胞都增加了。
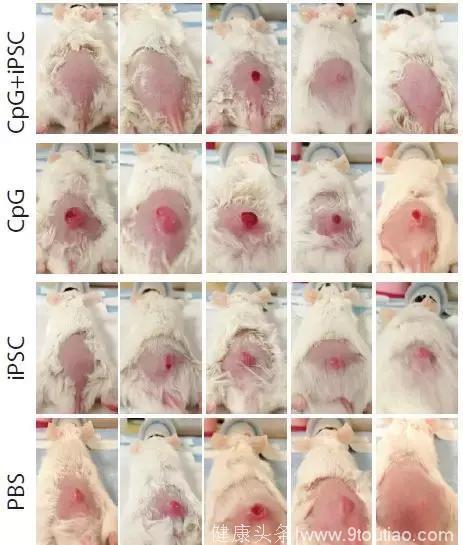
移植癌细胞4周后,被处死的4组共20只小鼠的肿瘤生长情况,由上至下依次为iPSCs+CpG组,CpG组,iPSCs组和磷酸缓冲液对照组
其余活下来的小鼠情况又如何呢?在其他组小鼠陆续撑不住,为科研献出生命的同时,iPSCs+CpG组有2只竟然平平安安的存活了1年多!并且始终具有与实验开始时同样的抗体水平。研究人员还尝试了再次给它们注射5x104个癌细胞,结果癌细胞被团灭了!
为了巩固研究结果,研究人员用黑色素瘤和间皮瘤的肿瘤细胞进行了重复实验,都观察到了iPSCs+CpG的抑癌效果。接下来,他们将接种过疫苗的小鼠的淋巴细胞转移给了荷载肿瘤的未接种小鼠,发现肿瘤有了数倍的减小。而将淋巴细胞转移给了严重免疫缺陷且移植了未经射线照射的iPSCs的小鼠后,与对照组相比,iPSCs发展的畸胎瘤也减小,甚至消失了。这种“双向免疫”再次验证了iPSCs和癌细胞之间共享抗原。
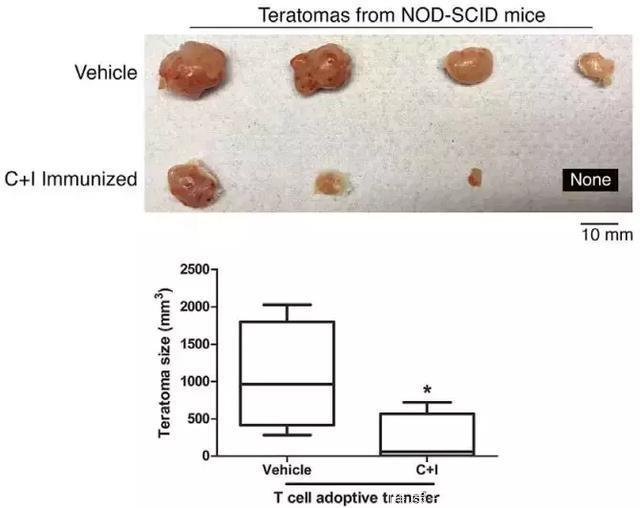
分别将接种了疫苗(C+I Immunized)和磷酸缓冲液(Vehicle)的小鼠的淋巴细胞转移给严重免疫缺陷且移植了未经射线照射的iPSCs的小鼠后,小鼠畸胎瘤大小的对照
既然疫苗也可以使已经形成的肿瘤缩小,研究人员又产生了新的想法。他们对黑色素瘤小鼠的肿瘤进行了手术切除,然后给小鼠接种iPSCs+CpG疫苗,一段时间后,注射了磷酸缓冲液的对照组肿瘤原位复发,而疫苗组则完全没有。除了切除的位置外,疫苗组引流淋巴结(肿瘤细胞沿淋巴管所能到达的淋巴结)中的肿瘤也显著减小,癌细胞的荷载量不足20%,而对照组则超过50%!
研究的第一作者Nigel Kooreman博士认为这种方法特别强大,因为它让免疫系统接触了许多不同的癌症特异性抗原和癌症相关抗原,之后,免疫系统就会警惕目标癌症的发展,在检测到抗原表达时消灭掉它们[5]。
研究人员接下来的目标是在实验室中对人类的癌细胞和iPSCs进行实验。如果成功,他们设想,在未来,任何年龄的人都可以接受经过射线照射的iPSCs和CpG组成的疫苗,以阻止数月或数年后癌症的发生,或是抑制癌症的复发。而且,疫苗还有可能被用作肿瘤切除术后的辅助治疗方式之一。
作为研究的主要通讯作者,Joseph Wu博士表示:“虽然还有很多研究尚待完成,但这个研究的概念本身很简单,我们可以利用每个人的血细胞等成熟细胞制造iPSCs,以预防癌症,我对它未来应用的可能性感到非常兴奋。”[5]
参考资料:
[1] Kooreman N G, Kim Y, de Almeida P E, et al. Autologous iPSC-based vaccines elicit anti-tumor responses in vivo[J]. Cell Stem Cell, 2018.
[2] Ben-Porath I, Thomson M W, Carey V J, et al. An embryonic stem cell–like gene expression signature in poorly differentiated aggressive human tumors[J]. Nature genetics, 2008, 40(5): 499.
[3] Ghosh Z, Huang M, Hu S, et al. Dissecting the oncogenic and tumorigenic potential of differentiated human induced pluripotent stem cells and human embryonic stem cells[J]. Cancer research, 2011, 71(14): 5030-5039.
[4] Bock C, Kiskinis E, Verstappen G, et al. Reference Maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines[J]. Cell, 2011, 144(3): 439-452.
[5] http://med.stanford.edu/news/all-news/2018/02/induced-pluripotent-stem-cells-could-serve-as-cancer-vaccine.html