《中国胃肠间质瘤诊断治疗共识》最新版本来啦,速度收藏!

干货满满,胃肠间质瘤诊治还有啥疑问,戳这里!
来源丨肿瘤综合治疗电子杂志
近年来,胃肠间质瘤(gastrointestinal stromal tumor,GIST)在诊断、治疗及研究领域取得快速进展,部分研究结果将对GIST临床诊疗实践产生重要影响。
为了进一步推动我国GIST的规范化诊断和治疗,经中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)胃肠间质瘤专家委员会对关键内容进行充分讨论,并对争议问题进行投票,最终,在2013年版共识基础上,形成了《中国胃肠间质瘤诊断治疗共识(2017年版)》,现予公布。
1
病理诊断原则
1.1 GIST的定义
GIST是胃肠道最常见的间叶源性肿瘤,在生物学行为上可从良性至恶性,免疫组化检测通常表达CD117和DOG1阳性,显示卡哈尔细胞(Cajal cell)分化,大多数病例具有c-kit或血小板源性生长因子受体α多肽(platelet derived growth factor receptor alpha,PDGFRA)基因活化突变,少数病例涉及其他分子改变,包括SDHX、BRAF、NF1、K/N-RAS及PIK3CA等基因突变等。
1.2 对标本的要求
手术后的标本需要及时固定,标本离体后应在30分钟内送至病理科,采用足够的中性10%福尔马林液(至少3倍于标本体积)完全浸泡固定。
对于直径≥2 cm的肿瘤组织,必须每隔1 cm予以切开,达到充分固定。固定时间应为12~48小时,以保证后续免疫组化和分子生物学检测的可行性和准确性。
有条件的单位应留取新鲜组织妥善冻存,以备日后基因检测之用。
1.3 GIST的病理诊断和辅助检测
基本诊断
组织学上,依据瘤细胞的形态可将GIST分为3大类:梭形细胞型(70%)、上皮样细胞型(20%)及梭形细胞-上皮样细胞混合型(10%)。
即使为同一亚型,GIST的形态在个例之间也可有很大的差异。除经典形态外,GIST还可有一些特殊形态,少数病例还可见多形性细胞,尤多见于上皮样GIST。间质可呈硬化性,可伴有钙化,特别是小GIST,偶可呈黏液样等。
此外,发生于小肠的GIST内常可见嗜伊红色丝团样纤维小结(skeinoid fiber),对诊断也具有一定的提示性意义。
靶向药物治疗后的GIST
经靶向药物治疗以后,GIST可发生坏死和(或)囊性变,部分病例中细胞密度明显降低,瘤细胞成分稀疏,间质伴有广泛胶原化,可伴有多少不等的炎性细胞浸润和组织细胞反应。
近年来,经靶向治疗后再经手术切除的GIST标本也逐渐增多,对这类标本推荐的组织学疗效评判标准为:
①轻微效应,0%~10%;
②低度效应,>10%且<50%;
③中度效应,≥50%且≤90%;
④高度效应,>90%。
但是组织学评估疗效与GIST预后的相关性尚有待于更多病例的积累和研究。
GIST的免疫组化
GIST的免疫组化检测推荐采用CD117、DOG1、CD34、琥珀酸脱氢酶B(SDHB)及Ki67标记,可酌情增加SDHA标记。CD117和DOG1建议加用阳性对照。
GIST的分子检测
应在符合资质的实验室进行分子检测,推荐采用聚合酶链式反应(polymerase chain reaction,PCR)扩增-直接测序的方法,以确保检测结果的准确性和一致性。GIST的分子检测十分重要,有助于疑难病例的诊断、预测分子靶向药物治疗的疗效及指导临床治疗。
专家委员会推荐存在下列情况时应进行分子检测:
①疑难病例应进行c-kit或PDGFRA突变分析,以明确GIST的诊断;
②术前拟行分子靶向药物治疗者;
③所有初次诊断的复发和转移性GIST,拟行分子靶向药物治疗;
④原发可切除GIST手术后,中-高度复发风险,拟行分子靶向药物治疗;
⑤鉴别野生型GIST;
⑥鉴别同时性和异时性多原发GIST;
⑦继发性耐药需要重新检测。
检测基因突变的位点,至少应包括c-kit基因的第9、11、13和17号外显子以及PDGFRA基因的第12和18号外显子。
对于继发耐药的患者,应增加检测c-kit基因的第14和18号外显子。
原发c-kit基因突变可表现为多种突变类型,其中缺失突变约占50%,特别是557-558缺失突变,其生物学行为较非缺失突变更差,表现为自然预后差、伊马替尼治疗有效时间相对较短等。
明确外显子11具体突变类型,对评估肿瘤的生物学行为、制订整体治疗策略具有一定价值。因此,分子检测报告中应对c-kit基因外显子11突变的具体类型加以描述。
BRAF突变在少数野生型GIST中可检测到,其可能作为野生型GIST的一个特殊亚组,BRAF抑制剂治疗该类患者仅有个案报道,且总体突变率低,不推荐将BRAF基因突变检测作为常规检查。
目前二代基因测序(next generation sequencing,NGS)与液体活检在GIST领域中的报道较少。但有少数研究发现其可检测到少见突变类型,并可能提早发现继发基因突变,具有潜在的可应用性。
鉴于NGS和液体活检的可靠性和临床价值尚有待于进一步评估,故这两种技术不能取代直接测序用于原发GIST的分子检测。但对于进展期GIST,尤其是继发耐药病例,推荐NGS与液体活检可用于探索性研究。
GIST的诊断思路和标准
从事GIST病理诊断的病理医生不仅要熟悉GIST的各种形态学表现,也要了解各种易被误诊为GIST的肿瘤。
免疫组化检测强调联合使用CD117和DOG1标记:
①对于组织学形态符合GIST且CD117和DOG1弥漫(+)的病例,可以作出GIST的诊断;
②形态上呈上皮样但CD117(-)、DOG1(+)或CD117弱(+)、DOG1(+)的病例,需要加行分子检测,以确定是否存在PDGFRA基因突变(特别是D842V突变);
③CD117(+)、DOG1(-)的病例首先需要排除其他CD117(+)的肿瘤,必要时加行分子检测帮助鉴别诊断;
④组织学形态和免疫组化标记均符合GIST,但分子检测显示无c-kit或PDGFRA基因突变的病例,需考虑是否有野生型GIST的可能性,应加行SDHB标记,表达缺失者应考虑SDHB缺陷型GIST,表达无缺失者应考虑其他野生型GIST的可能性,有条件者加行相应分子检测;
⑤CD117(-)、DOG1(-)的病例大多为非GIST,在排除其他类型肿瘤后仍考虑为GIST时,需加行分子检测。GIST的病理诊断思路参见图1。
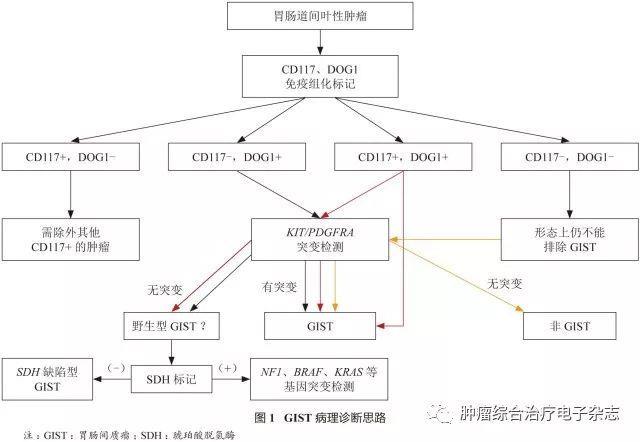
1.4 野生型GIST
野生型GIST指的是病理诊断符合GIST,但分子检测无c-kit/PDGFRA基因突变者。约85%的儿童GIST和10%~15%的成人GIST为野生型GIST。
根据是否有SDHB表达缺失,野生型GIST大致可分为两大类:
①SDH缺陷型GIST,包括SDHA突变型、散发性GIST、Carney三联征相关性及Carney-stratakis综合征相关性;
②非SDH缺陷型GIST,包括BRAF突变、Ⅰ型神经纤维瘤病(NF1)相关性、K/N-RAS突变及四重野生型(quadrupleWTGIST)等,参见图2。
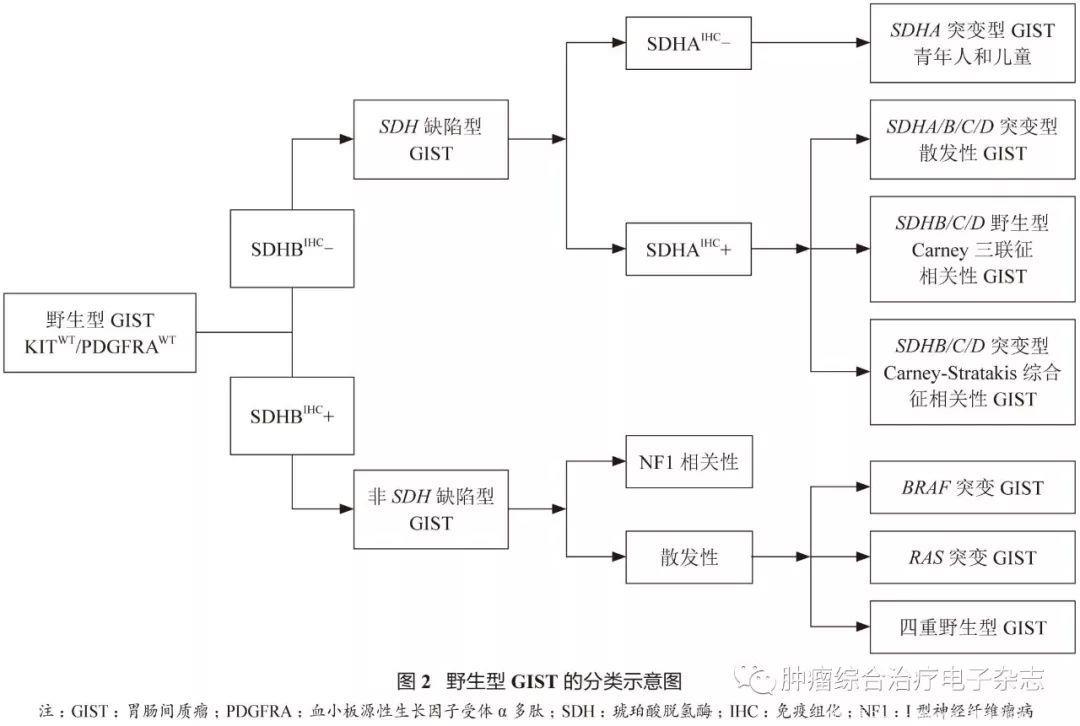
SDH缺陷型GIST
SDH缺陷型GIST约占野生型GIST的50%,包括:
①无综合征相关的SDH缺陷型GIST:
发生于儿童和青年人,女性多见。肿瘤发生于胃,镜下常呈多结节性或丛状生长方式,瘤细胞呈上皮样,也可为混合型,约50%的病例于淋巴管内可见瘤栓,约10%的病例于区域淋巴结内可见瘤转移,免疫组化标记显示瘤细胞可表达CD117和DOG1,但SDHB表达缺失。
- 分子检测显示约50%的SDH亚单位(SDHA、SDHB、SDHC或SDHD)功能丧失性胚系突变,其中约30%为SDHA突变(多为胚系突变),免疫组化SDHA失表达,20%为SDHB、SDHC或SDHD突变。
- 余50%的病例SDHC促进子高甲基化和SDH复合体表观基因沉默,常过表达胰岛素样生长因子受体1R(insulin-like growth factor 1 receptor,IGF1R)。
②Carney三联征相关性GIST(Carney Triad):
无家族性,可伴发肺软骨瘤(常为多灶性)和肾上腺外副神经节瘤,仅22%的患者同时合并三种肿瘤,53%的患者同时有GIST和肺软骨瘤,24%的患者同时有GIST和副神经节瘤。
其他可伴发的肿瘤包括嗜铬细胞瘤、肾上腺腺瘤及食管平滑肌瘤。由SDHC甲基化所致,标记SDHB为阴性,标记SDHA为阳性。
③Carney-stratakis综合征相关性GIST
Carney-stratakis综合征相关性GIST是一种遗传学疾病,为常染色体显性遗传,不全外显。由SDHB(10%)、SDHC(80%)及SDHD(10%)的胚系失活性突变所致,突变导致蛋白表达丢失,标记SDHB为阴性。
BRAF突变型GIST
占野生型GIST的3%~7%,好发于小肠(56%),其次为胃(22%)。组织形态上多为梭形细胞型,免疫组化标记仍显示CD117(+)、DOG1(+)。分子检测显示BRAF基因15号外显子(p.V600E)突变。少数情况下为伊马替尼(IM)耐药性二次突变。
NF1相关性GIST
GIST在NF1患者中的发生率为7%。NF1相关性GIST患者年龄相对较小,肿瘤多发生于空肠和回肠,常为多结节性,伴有Cajal间质细胞(ICC)增生。分子检测显示NF1功能丢失性胚系突变,但突变无热点集中现象,可为插入/缺失或框内移位突变、错义突变。
K/N-RAS突变型GIST
原发耐药GIST或KIT/PDGFRA突变型GIST可发生RAS突变。
四重野生型GIST
极为罕见,可过表达分子标记CALCRL和COL22A1,或涉及酪氨酸和细胞周期依赖激酶(NTRK6和CDK6)以及ETS转录因子(ERG)等基因,尚有待于进一步研究。
其他类型
包括PIK3CA突变和具有ETV6-NTRK3融合基因等。
1.5 小GIST和微小GIST
直径≤2 cm的GIST统称为小GIST,直径≤1 cm的GIST定义为微小GIST(micro-GIST),其中的大多数病例为偶然发现。尽管大多数小GIST或微小GIST病例在临床上呈良性或惰性经过,但确有极少数病例显示侵袭性行为,尤其是核分裂象计数>5/50 HPF或>10/50 HPF者。
1.6 原发完全切除GIST的危险度评估
GIST的危险度评估适用于原发完全切除的GIST。
下列几种情形不适合进行危险度评估:
①各类活检标本,包括细针穿刺活检、芯针穿刺活检及内镜活检等;
②已发生复发和(或)转移的GIST;
③经过靶向治疗的GIST。
原发可切除GIST术后复发风险评估系统包括美国国立卫生研究院(National Institutes of Health,NIH)(2008改良版)、WHO(2013年版)、美国国防病理学研究所(Armed Forces Institute of pathology,AFIP)标准、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南(2016年第2版)、热点图及列线图,参见表1~5和图3~4。
鉴于便捷性与操作简单性,CSCO胃肠间质瘤专家委员会推荐沿用稍作修改的NIH 2008改良版,可能更适合亚洲人种。没有一种评估系统是完美无缺的,各单位可结合本单位具体情况选择。关于核分裂象计数,现有评估系统均采用50 HPF,但各单位使用的显微镜目镜有所不同。
专家组建议采用5 mm2,如果对应多数单位现在使用的显微镜(目镜22 mm),实际计数21个HPF(10 mm2为42个HPF)。此外,对GIST危险度的评估,临床和病理可有不一致的情形,从事GIST靶向治疗的临床医生应综合临床、影像及病理等各方面的资料进行分析和研判。
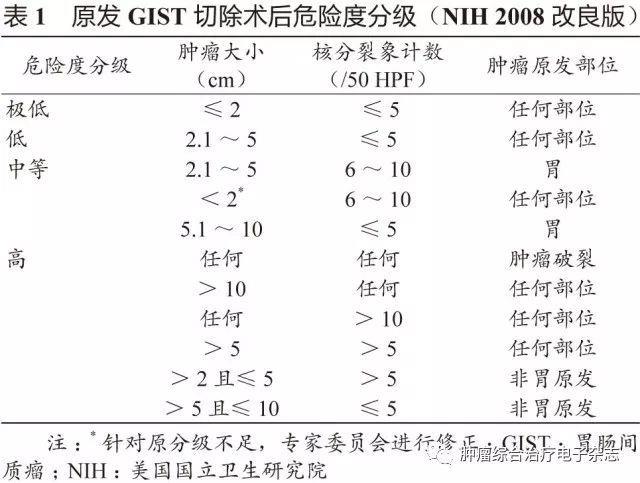
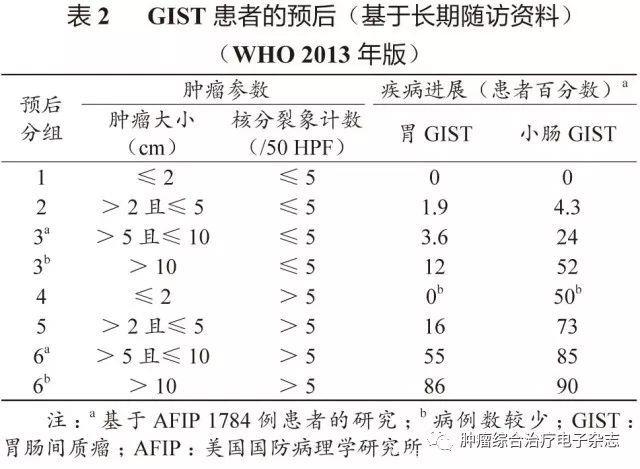
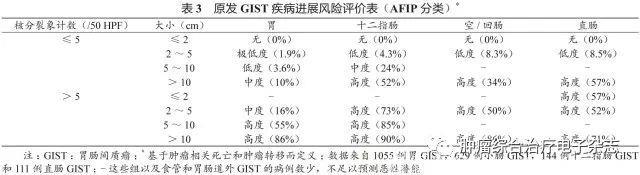
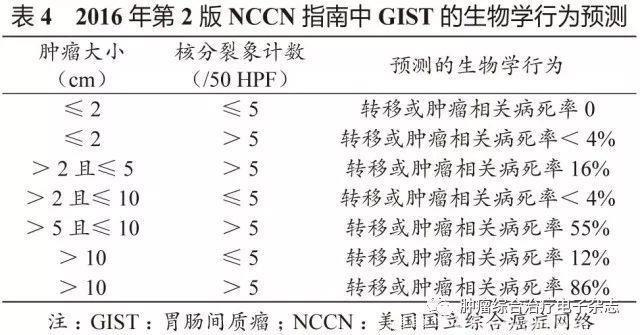
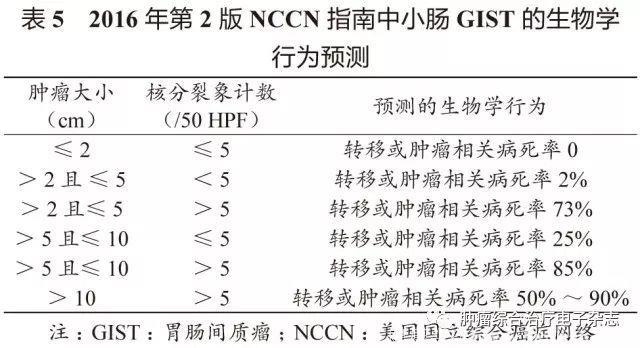
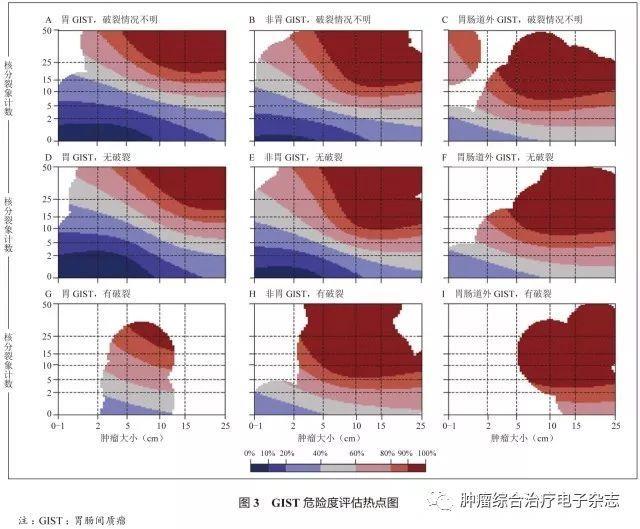
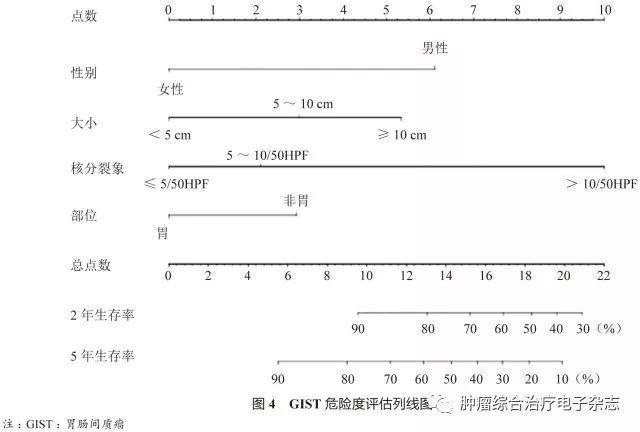
需要注意的是,SDH缺陷型GIST与普通型GIST有所不同,核分裂象不能作为危险度评估指标。核分裂象少的可发生肝转移,核分裂象多的却可不转移。另一特点是发生转移的间隙期较长,故需长期随访。
1.7 规范GIST病理诊断报告
病理报告应该规范化,必须准确地注明原发部位、肿瘤大小、核分裂象计数(/50 HPF)及肿瘤破裂等情况;应附有免疫组化检测结果,分子病理学检测结果可另附。GIST病理报告请见文末附件。
2
外科治疗原则
2.1 活检
活检原则
评估手术能够完整切除且不会明显影响相关脏器功能者,可以直接进行手术切除。对于大多数可完整切除的GIST,术前不推荐进行常规活检。如果需要进行术前药物治疗,应行活检。需注意,不适当的活检可能引起肿瘤破溃、出血,增加肿瘤播散的危险性,应慎重。
活检适应证
①需要联合多脏器切除者,或术后可能明显影响相关脏器功能者,术前可考虑行活检以明确病理诊断,有助于决定是否直接手术或术前药物治疗;
②对于无法切除或估计难以获得R0切除的病变,拟采用术前药物治疗者,应先进行活检;
③初发且疑似GIST者,术前如需明确性质(如排除淋巴瘤);
④疑似复发转移GIST,药物治疗前需明确性质者。
活检方式
(1)超声内镜下细针穿刺活检(endoscopic ultrasonography - fine needle aspiration,EUS-FNA):由于其造成腔内种植的概率甚小,应作为首选活检方式。但仅限于超声内镜可以达到的消化道管腔范围内,且由于其获得组织较少,诊断难度常较大。
(2)空芯针穿刺活检(core needle biopsy,CNB):可在超声或CT引导下经皮穿刺进行,与手术标本的免疫组化染色表达一致性可达90%以上,诊断准确性也达到90%以上。但由于存在肿瘤破裂腹腔种植的风险,常应用于转移病灶。
(3)内镜活检:常难以明确病理诊断,仅适用于黏膜受累的病例,且偶可导致肿瘤严重出血。
(4)经直肠或阴道引导穿刺活检:对于直肠、直肠阴道隔或盆腔肿物,可考虑应用此方式。
(5)术中冰冻活检:不常规推荐,除非术中怀疑GIST周围有淋巴结转移或不能排除其他恶性肿瘤。
2.2 手术
手术原则
对于局限性GIST和潜在可切除GIST,手术切除是首选治疗方法。
(1)手术目标是尽量争取R0切除。如果初次手术仅为R1切除,术后切缘阳性,目前国内外学者倾向于进行分子靶向药物治疗,一般不主张再次补充手术。
(2)GIST很少发生淋巴结转移,一般情况下不必行常规清扫,但在存在病理性肿大的淋巴结的情况下,需考虑SDH缺陷型GIST的可能,应切除病变淋巴结。
(3)术中应避免肿瘤破裂,注意保护肿瘤假性包膜的完整。肿瘤破溃出血的原因包括术前较少发生的自发性肿瘤破溃出血以及术中触摸肿瘤不当造成的破溃出血。因此,术中探查需注意细心轻柔。
手术适应证
(1)局限性GIST原则上可直接进行手术切除;不能切除的局限性GIST,或接近可切除但切除风险较大或可能严重影响脏器功能者,宜先行术前分子靶向药物治疗,待肿瘤缩小后再行手术。
①位于胃的最大径线≤2 cm的无症状拟诊GIST,应根据其超声内镜表现确定风险分级,不良因素为边界不规整、溃疡、强回声及异质性。如合并不良因素,应考虑切除;如无不良因素,可定期复查超声内镜,时间间隔通常为6~12个月。
②位于其他部位的GIST,由于恶性程度相对较高,一经发现均应考虑手术切除。
③位于特殊部位的GIST,如直肠、胃食管结合部、十二指肠,肿瘤一旦增大,保留肛门、贲门功能的手术难度相应增加,或增加联合脏器切除的风险,应积极行手术切除。
(2)不可切除GIST经术前伊马替尼治疗后明显缓解的病灶,如达到可切除标准,应尽快切除。
(3)对于复发或转移性GIST,分为下列几种情况,需区别对待:
①未经分子靶向药物治疗,但估计能够完全切除且手术风险不大者,可以考虑手术切除并联合药物治疗。
②分子靶向药物治疗有效,且肿瘤维持稳定的复发或转移性GIST,估计所有复发转移病灶均可切除的情况下,建议考虑手术切除全部病灶。
③局限性进展的复发转移性GIST,鉴于分子靶向药物治疗后总体控制满意,仅有单个或少数病灶进展,可以考虑谨慎选择全身情况良好的患者行手术切除。术中将进展病灶切除,并尽可能切除更多的转移灶,完成较满意的减瘤手术。
④分子靶向药物治疗过程中仍然广泛性进展的复发转移性GIST,原则上不考虑手术治疗。
⑤姑息减瘤手术仅限于患者能够耐受手术并预计手术能改善患者生活质量的情况。
(4)急诊手术适应证:在GIST引起完全性肠梗阻、消化道穿孔、保守治疗无效的消化道大出血以及肿瘤自发破裂引起腹腔大出血时,须行急诊手术。
手术方式
(1)开腹手术:目前仍是GIST最常用的手术方法。区段或楔形切除是最常用的局部切除方法。
- 手术切除应争取最小的手术并发症,尽量避免复杂手术(如全胃切除、腹会阴联合切除等)或多脏器联合切除手术(如胰十二指肠切除术等)。
- 此外,涉及器官功能保护的病例,如中低位直肠GIST、胃食管结合部GIST,推荐首选括约肌保留手术和食管保留手术。
- 对于涉及复发手术或器官功能保护的病例,推荐进行多学科专家组讨论决定是否进行术前伊马替尼治疗。
(2)经直肠、阴道或会阴切除:对于位于直肠或直肠阴道隔的病灶,可考虑截石位或折刀位下局部完整切除。
(3)腹腔镜手术:近年来腹腔镜手术适应证不断扩大。在有经验的医疗中心,可以根据肿瘤部位和大小考虑行腹腔镜切除。
- 推荐位于胃大弯侧及胃底体前壁直径≤5 cm的病灶可以考虑腹腔镜手术。
- 空回肠GIST行腹腔镜手术的意义主要在于探查、定位。
- 此外,位于直肠的小GIST也可以考虑腹腔镜手术切除。
- 如GIST肿瘤需要较大腹部切口才能完整取出,不建议应用腹腔镜手术。
由于肿瘤破裂是GIST独立的不良预后因素,因此术中要遵循“非接触、少挤压”的原则,且必须使用“取物袋”,以避免肿瘤破裂播散。
内镜治疗
由于多数GIST起源于固有肌层,生长方式多种多样,瘤体与周围肌层组织界限并不十分清晰,内镜下不易根治性切除,且操作并发症的发生率高(主要为出血、穿孔、瘤细胞种植等),目前尚缺乏内镜下切除GIST的中长期安全性的对比研究,故不作为常规推荐。
3
分子靶向药物治疗原则
3.1 GIST术前治疗
术前治疗的意义
术前进行分子靶向药物治疗的意义在于:减小肿瘤体积,降低临床分期;缩小手术范围,避免不必要的联合脏器切除,降低手术风险,增加根治性切除机会;对于特殊部位的肿瘤,可以保护重要脏器的结构和功能;对于瘤体巨大、术中破裂出血风险较大的患者,可以减少医源性播散的可能性。
术前治疗的适应证
①术前估计难以达到R0切除;
②肿瘤体积巨大(>10 cm),术中易出血、破裂,可能造成医源性播散;
③特殊部位的肿瘤(如胃食管结合部、十二指肠、低位直肠等),手术易损害重要脏器的功能;
④虽然肿瘤可以切除,但是估计手术风险较大,术后复发率和死亡率均较高者;
⑤估计需要实施多脏器联合切除手术者;
⑥复发转移的患者,切除困难者,也可先行药物治疗,待肿瘤缩小后实施减瘤手术。
术前治疗时间、治疗剂量及手术时机的选择
在分子靶向药物治疗期间,应定期(每2~3个月)评估治疗效果,推荐使用Choi标准或参考RECIST(Response Evaluation Criteria in Solid Tumors)1.1版标准。对于术前治疗时间,一般认为给予伊马替尼术前治疗6~12个月施行手术比较适宜。过度延长术前治疗时间可能会引起继发性耐药。
术前治疗时,推荐先进行基因检测,并根据检测结果确定伊马替尼的初始剂量。对于伊马替尼治疗后肿瘤进展的患者,应综合评估病情,有可能切除进展病灶者,可考虑停用药物,及早手术干预;不能实施手术者,可以按照复发/转移患者进行二线治疗。
术前停药时间及术后治疗时间
建议术前1~2周停用分子靶向药物,待患者基本情况达到要求,可考虑进行手术。术后,原则上只要患者胃肠道功能恢复且能耐受药物治疗,应尽快进行后续药物治疗。对于R0切除者,术后药物维持时间可参考辅助治疗的标准,以药物治疗前的复发风险分级来决定辅助治疗的时间;对于姑息性切除或转移、复发患者(无论是否达到R0切除),术后分子靶向药物治疗与复发/转移未手术的GIST患者相似。
3.2 GIST术后辅助治疗
辅助治疗适应证
(1)危险度分级:危险度分级是评估辅助治疗适应证最主要的标准,目前推荐依据NIH 2008版(中国共识改良版)危险度评估具有中高危复发风险的患者作为辅助治疗的适应人群。
(2)基因分型:PDGFRA外显子18 D842V突变GIST对伊马替尼原发耐药,辅助治疗未能获益,不推荐给予伊马替尼辅助治疗。
c-kit外显子9突变、野生型GIST能否从辅助治疗中获益存在争议,但相关研究样本量小,证据级别尚不够充分,暂不能作为评估辅助治疗适应证的依据,建议开展进一步的临床研究。
辅助治疗剂量和时限
(1)治疗剂量:不论何种基因类型,推荐伊马替尼辅助治疗的剂量均为400 mg/d。研究表明,c-kit外显子9突变GIST,接受伊马替尼400 mg/d辅助治疗能否获益存在争议,但目前尚无证据支持c-kit外显子9突变患者辅助治疗应增加剂量至600 mg/d或800 mg/d。
(2)治疗时限:①中度复发风险:非胃(主要为小肠、结直肠)来源的中危GIST危险度高于胃来源的中危GIST,复发风险相对偏高,建议对非胃来源的GIST,伊马替尼辅助治疗3年;胃来源的GIST,伊马替尼辅助治疗1年。②高度复发风险:高度复发风险GIST,辅助治疗时间至少3年;发生肿瘤破裂患者,可以考虑延长辅助治疗时间。
(3)复发后处理:伊马替尼辅助治疗期间出现GIST复发或转移,考虑伊马替尼耐药,建议依据耐药后原则处理(见下文)。
伊马替尼辅助治疗停药后出现GIST复发或转移,目前尚缺乏高级别的循证医学证据以推荐最佳后续治疗方法,建议进行前瞻性临床研究。
转移复发/不可切除GIST的治疗
a. 伊马替尼一线治疗
伊马替尼是转移复发/不可切除GIST的一线治疗药物,一般主张初始推荐剂量为400 mg/d;而c-kit外显子9突变患者,有国外学者主张伊马替尼的初始治疗剂量应为800 mg/d。
鉴于国内临床实践中,多数患者无法耐受伊马替尼800 mg/d治疗,因此对于c-kit外显子9突变的我国GIST患者,初始治疗可以给予伊马替尼600 mg/d;
对于体力评分较好可耐受高强度治疗的c-kit外显子9突变患者,也可直接给予伊马替尼800 mg/d。如伊马替尼治疗有效,应持续用药,直至疾病进展或出现不能耐受的毒性。
伊马替尼的常见不良反应包括水肿、胃肠道反应、白细胞减少、贫血、皮疹、肌肉痉挛以及腹泻等;大多数不良反应为轻至中度,对症支持治疗即可改善或恢复正常。
b. 伊马替尼标准剂量失败后的治疗选择
如果在伊马替尼治疗期间发生肿瘤进展,首先应确认患者是否严格遵从了医嘱,即在正确的剂量下坚持服药;在除外患者依从性因素后,应按以下原则处理。
(1)局限性进展:局限性进展表现为伊马替尼治疗期间,部分病灶出现进展,而其他病灶仍然稳定甚至部分缓解。
- 局限性进展的GIST,在手术可以完整切除局部进展病灶的情况下,建议实施手术治疗,术后可依据病情评估与需要,选择继续原剂量伊马替尼治疗、换用舒尼替尼治疗或伊马替尼增加剂量治疗;
- 如未能获得完整切除时,后续治疗应遵从GIST广泛性进展的处理原则;
- GIST广泛进展时,不建议采取手术。
对于部分无法实施手术的GIST肝转移患者,动脉栓塞与射频消融治疗也可以考虑作为姑息治疗方式;而不宜接受局部治疗的局灶性进展患者,建议换用舒尼替尼治疗或伊马替尼增加剂量治疗。
(2)广泛性进展:对于标准剂量的伊马替尼治疗后出现广泛进展者,建议换用舒尼替尼或选择伊马替尼增加剂量治疗。
舒尼替尼治疗:37.5 mg/d连续服用与50 mg/d(4/2)方案均可作为选择。尽管缺乏随机对照研究,但是舒尼替尼37.5 mg/d可能获得更好的疗效与耐受性。国内研究数据显示,中国患者接受舒尼替尼治疗生存获益高于西方患者,药物不良反应经对症治疗后可获得缓解。
伊马替尼增加剂量:考虑耐受性问题,推荐我国GIST患者优先增量为600 mg/d。伊马替尼增加剂量后的不良反应经对症治疗后可获得缓解。
c. 伊马替尼与舒尼替尼治疗失败后的治疗
瑞戈非尼治疗伊马替尼与舒尼替尼失败的转移/不可切除的GIST,可显著延长患者总生存期,推荐用于伊马替尼与舒尼替尼治疗失败后的三线治疗。常见不良反应包括乏力、高血压、手足综合征、口腔黏膜炎、贫血与粒细胞减少。
瑞戈非尼治疗失败的GIST患者,建议参加新药临床研究,或者考虑给予既往治疗有效且耐受性好的药物进行维持治疗。
d. c-kit/PDGFRA基因突变与分子靶向治疗疗效的相关性
c-kit/PDGFRA基因突变类型可以预测分子靶向药物的疗效。
一线治疗中,c-kit外显子11突变者接受伊马替尼治疗疗效最佳;
二线治疗中,原发c-kit外显子9突变和野生型GIST患者接受舒尼替尼治疗的生存获益优于c-kit外显子11突变患者,继发性c-kit外显子13、14突变患者接受舒尼替尼治疗疗效优于继发性c-kit外显子17、18突变患者;
三线治疗中,继发性c-kit外显子17突变患者接受瑞戈非尼治疗取得了较好的疗效;PDGFRA D842V和D816V突变可能对伊马替尼、舒尼替尼与瑞戈非尼治疗原发性耐药。
e. 血药浓度监测
如果有条件,建议对下列患者进行伊马替尼血药浓度检测:
①伊马替尼400 mg一线治疗进展的患者;
②药物不良反应较重的患者,如系血药浓度过高引起,可以在保证有效血药浓度的情况下,酌情减量;
③未遵从医嘱定期定量服药的患者。如GIST患者的血浆伊马替尼浓度低于1100 ng/ml,临床疗效降低,疾病很快进展。
f. 药物疗效的判断
(1)原发耐药与继发耐药:原发耐药的定义为接受伊马替尼一线治疗6个月内发生肿瘤进展;继发耐药的定义为初始接受伊马替尼或舒尼替尼治疗获得肿瘤缓解或稳定后,随着治疗时间的延长再次出现肿瘤进展。
明确原发与继发耐药性质有助于评估GIST生物学行为与耐药机制,对合理制订后续治疗策略具有重要意义。
(2)改良的Choi疗效评估标准:既往多采用细胞毒药物疗效评价标准(RECIST标准),仅考虑瘤灶体积变化因素,存在明显缺陷。Choi等结合长径和CT值(Hu)提出新的标准(表6),有些研究表明其评效能力可能优于RECIST标准。本共识建议,对于治疗早期肿瘤体积缩小不明显甚至增大者,应补充测量CT值(Hu),参照Choi标准进行评价。

(3)CT扫描和测量规范:CT扫描范围应包括整个腹、盆腔区域;层厚≤5 mm;轴位图像测量肿瘤最大径线;增强静脉期,于肿瘤最大层面采用曲线边缘描记法获得肿瘤整体CT值(Hu);有条件的,应报告病灶的平均CT值。
(4)PET-CT的应用:PET-CT扫描是目前诊断GIST和评估分子靶向药物疗效最敏感的方法,但检查器械尚不够普及,价格较昂贵,可用于靶向药物疗效的早期判断,但不推荐用于术后的常规随访。
(5)MRI的应用:磁共振扩散加权成像可能成为PET-CT之外另一项可以提供功能定量指标的影像学方法,但其确切的临床意义有待于进一步研究。
4
随访原则
4.1 术后随访的患者
GIST术后最常见的转移部位是腹膜和肝脏,故推荐进行腹、盆腔增强CT或MRI扫描作为常规随访项目,必要时行PET-CT扫描。
①中、高危患者,应每3个月进行CT或MRI检查,持续3年,然后每6个月1次,直至5年;5年后每年随访1次。
②低危患者,应每6个月进行CT或MRI检查,持续5年;
③由于肺部和骨骼转移发生率相对较低,建议至少每年进行1次胸部X线检查,在出现相关症状情况下推荐进行ECT骨扫描。
4.2 转移复发/不可切除或术前治疗患者
①治疗前必须行增强CT或MRI作为基线和疗效评估的依据;
②开始治疗后,至少应每3个月随访1次,复查增强CT或MRI;如果涉及治疗决策,可以适当增加随访次数;
③治疗初期(前3个月)的密切监测非常重要,必要时可行PET-CT扫描确认肿瘤对治疗的反应;
④必要时,应监测血药浓度,指导临床治疗。

共识英文版已于2017年8月发表于Chinese Journal of Cancer Research.
参考文献(略)。
版权声明
本文版权归《肿瘤综合治疗电子杂志》所有,欢迎转发分享,任何机构转载请注明文章来源。
引用本文:
中国临床肿瘤学会胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2017年版)[J].肿瘤综合治疗电子杂志,2018,4(1):31-43.