Nature盘点:非小细胞肺癌的生物学机理和治疗方法
肺癌是世界上导致癌症患者死亡的首要因素,据统计每年有160万患者因此而去世。其中85%的患者根据组织学特征被归类为非小细胞肺癌(non-smallcelllungcancer,NSCLC),其中最常见的亚型为肺腺癌(lungadenocarcinoma,LUAD)和肺鳞状细胞癌(lungsquamouscellcarcinoma,LUSC)。肺癌最常见的病因是吸烟,NSCLC与吸烟的关联尤其紧密,因此在全球范围内减少烟草产品的使用是防治肺癌的重要一环。但是禁烟本身不能完全防止肺癌的发生,近20年来,肺癌疗法发生了重大变化,先进的靶向疗法和免疫肿瘤疗法在一部分患者身上取得了可喜的疗效。近日《自然》杂志对NSCLC的病理研究和治疗方法进行了盘点。
肺癌的生物学机理
肺癌是一种在分子水平上存在异质性的疾病,而理解肺癌的生物学机理对开发有效疗法至关重要。与其它癌症一样,肺癌由不同细胞克隆构成,每个克隆有自己独特的分子特征。在肺癌早期发现克隆中能够被靶向的遗传变异为肺癌的治疗方式带来了重大的改变。肺癌疗法不再是根据医生的经验开出的细胞毒性疗法,而是针对患者肿瘤中存在基因变异的个体化靶向疗法,或者基于患者PD-L1的表达水平而使用的免疫检查点抑制剂(immunecheckpointblockers,ICBs)。
下图总结了在LUAD和LUSC中最常见的遗传变异。其中KRAS和EGFR基因中出现的变异通常出现在初始克隆(founderclones)中,这意味着它们在肿瘤发生中有重要作用。通常KRAS和EGFR基因上的变异不会同时出现,但是如果同时出现,KRAS基因突变可能带来对EGFR抑制剂的抗性。p53基因上出现的变异通常在级别更高的肿瘤中出现,这表明它在肿瘤进一步恶化方面的作用。与此相比,KRAS基因变异出现的频率在不同级别的肿瘤中几乎是恒定的,进一步验证了KRAS在肿瘤发生和早期生成方面的作用。
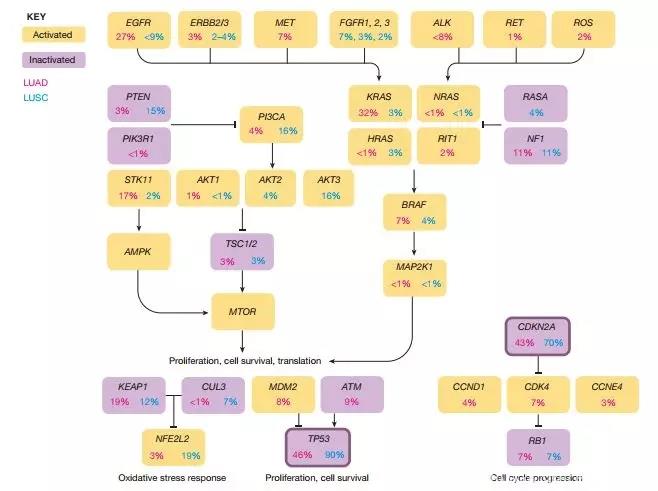
非小细胞肺癌中常见的遗传突变(图片来源:《自然》)
从未吸烟的肺癌患者基因组变异状况与吸烟的肺癌患者有很大区别,吸烟肺癌患者的基因变异频率大幅度增加,其中大多为胞嘧啶与腺嘌呤(C>A)核苷酸颠换,而且有很多基因突变目前还不能靶向,例如在KRAS和p53基因上的基因突变。而从未吸烟的肺癌患者中通常出现的是胞嘧啶向胸腺嘧啶的转换(C>T),其中更多基因突变可以被靶向,比如激活EGFR的突变和ROS1与ALK易位。
肿瘤微环境
启动和推动肿瘤进化的遗传变异不但会影响到肿瘤细胞本身的健康,同时还会影响到肿瘤微环境(tumormicroenvironment,TME)的特性。NSCLC通常携带高度体细胞肿瘤突变负担,在吸烟患者中突变负担尤其严重。基因变异对TME的影响大不相同。有些基因突变会产生新抗原,而这些新抗原可能被浸润肿瘤的细胞毒性T细胞识别。在LUAD中新抗原负担高的克隆的TME通常富集被激活的效应T细胞,以及与抗原呈现、T细胞迁移、效应T细胞功能相关的蛋白,同时抑制T细胞活性的PD-L1、PD-1和LAG-3等调节因子也相对增多。这样的TME对ICBs非常敏感。而让STK11(又名LKB1)失活的基因突变会让TME中积累具有免疫抑制能力的中性粒细胞,抑制PD-L1的表达,减少肿瘤浸润淋巴细胞的数量。因此,我们需要对NSCLC的基因组和TME的细胞构成进行大规模的研究,才能确定什么样的基因变异会决定TME的细胞组成。
近20年来的疗法进展
对于1期,2期和部分3A期NSCLC患者来说,手术切除是最有效的治疗方法,但是接受手术治疗后的患者中仍然有很大比例会复发。5年存活率对1A期患者为83%,而3A期患者则下降到36%。铂基二联化疗是治疗NSCLC的标准化疗手段。它也可以用于在手术治疗后对患者进行辅助治疗。对于无法切除的局部晚期NSCLC患者,标准疗法为化疗与胸部放疗的组合疗法。

该时间表说明二十年来靶向疗法和免疫疗法在NSCLC治疗中的发展。(图片来源:《自然》)
而肺癌死亡率高的原因是大部分患者在确诊时肿瘤已经转移,这意味着要改善患者的长期生存率需要更有效的全身疗法。在这方面,通过发现可以靶向的基因变异而开发出的靶向疗法和免疫肿瘤疗法彻底改变了对这些患者的治疗方式。
靶向疗法
对患者肿瘤的基因型进行检测,并且根据可靶向的基因变异让患者接受与之匹配的酪氨酸激酶抑制剂(tyrosinekinaseinhibitors,TKIs)让为肺癌患者提供个体化的疗法成为可能,并且获得比非靶向疗法更好的疗效。
1.EGFR
EGFR属于一个受体酪氨酸激酶家族,这个家族同时包括HER2、HER3和HER4。通常EGFR需要配体与之结合,导致受体二聚化并且激活下游信号通路,但是在激酶蛋白域的突变可能造成这些受体不需要配体结合就可以被持续激活。最常见的EGFR变异包括19号外显子缺失和在21号外显子出现的L858R突变。
第一代EGFRTKIs包括gefitinib和erlotinib,它们在治疗携带相应EGFR变异的患者时与标准化疗相比能够提高客观缓解率(objectiveresponserate,ORRs),延长无进展生存期(progression-freesurvival,PFS)。第二代EGFRTKIs包括afatinib和dacomitinib,它们是不可逆EGFR抑制剂,同时还可以靶向HER2和HER4。
肿瘤对第一代TKIs产生抗性的原因通常是在EGFR20号外显子中出现的T790M变异。其它产生抗性的原因包括HER2扩增,或者在MET、BRAF、或PIK3CA基因中出现突变。这意味着医生们需要对肿瘤的基因组状况进行重复检查和监控,才能找出合适的下一步治疗方法。第三代EGFRTKIs不但能够抑制最初导致EGFR持续激活的突变,还能够抑制T790M突变造成的EGFR活性异常。其中名为osimertinib的第三代TKI在治疗携带T790M的NSCLC患者时表现出良好效果,这些患者已经接受过第一代TKI治疗并且病情继续恶化。而且在治疗携带EGFR19号外显子缺失或L858R突变的未接收过治疗的NSCLC患者的临床试验中,osimertinib与erlotinib或gefitinib相比能够显著改善患者的PFS。这让osimertinib可能成为一线EGFRTKI选择。
2.ALK
ALK编码的跨膜受体酪氨酸激酶在人体中的功能还不清楚。在ALK重排中最常见的重排对象时EML4基因。Crizotinib时一种口服竞争性ALK、MET和ROS1抑制剂。它与标准化疗相比能够提高患者的ORRs和PFS。接受过crizotinib治疗的患者大多会从第二代ALK抑制剂中获益,它们包括ceritinib、alectinib和brigatinib。
对ALK抑制剂的抗性的可以通过ALK基因的突变或者扩增而产生,另外产生抗性的机制包括EGFR和MAPK等旁路信号通路(bypasssignalingpathways)的上调。对第二代ALK抑制剂产生抗性的机制主要时ALK基因上出现的次级突变,其中最常见的突变为G1202R,这种突变能够使癌细胞在体外培养环境下对所有第二代ALK抑制剂产生抗性。唯一的例外是名为lorlatinib的第三代ALK抑制剂,它对几乎所有ALK抗性突变都有效果,并且对已经接受过多达三种ALK抑制剂的患者仍然有效。
3.ROS1
ROS1编码的受体酪氨酸激酶的激酶蛋白域与CD74基因融合时会导致激酶持续激活。由于ROS1和ALK在激酶蛋白域的高度同源性,包括crizotinib、ceritinib、和lorlatinib在内的ALK抑制剂对ROS1阳性的肿瘤也有显著效果。
免疫疗法
在肿瘤产生的过程中,PD-1信号通路的激活会让识别肿瘤特异性抗原的T细胞失活,从而让肿瘤进一步增殖和转移。用抗体阻断PD-1信号通路能够恢复T细胞媒介的抗癌免疫反应。ICBs已经在广泛的NSCLC患者中显示出显著疗效。目前已经获得批准和处于研发过程中的ICBs包括PD-1抗体nivolumab,PD-L1抗体atezolizumab,durvalumab和avelumab。

晚期或转移性NSCLC的当前和在研治疗选择。(图片来源:《自然》)
IBCs已经被批准作为治疗接受一线化疗后肿瘤继续恶化的晚期NSCLC患者的标准疗法之一。在一线疗法方面,pembrolizumab已经成为肿瘤中PD-L1表达量超过50%的晚期或转移NSCLC患者的新标准疗法。这些患者可能占NSCLC患者总数的30%。ICBs更好的毒副作用特征和与化疗相仿的存活结果可能支持它们作为一线疗法治疗那些表达PD-L1的晚期NSCLC患者,尤其是那些无法接受化疗的患者。
化疗可以与ICBs构成组合疗法协同治疗肿瘤。一方面,化疗可以杀伤肿瘤细胞,从而改善T细胞和肿瘤细胞之间的比例,而且化疗可能减少免疫抑制因子的释放或者促进新抗原的释放,从而推广抗癌T细胞的免疫反应。Pembrolizumab和化疗药物构成的组合疗法与单一化疗相比显著提高了患者的ORR和PFS。
虽然ICB单一疗法对于那些高度表达PD-L1或者携带高度肿瘤突变负担的肿瘤是合适的疗法,但是对于突变负担较低或在肿瘤中T细胞较少的肿瘤来说我们需要新的策略。这些策略包括使用化疗药物、表观遗传调控药物或者溶瘤病毒来制造激发免疫反应的肿瘤细胞死亡。另外一种方法是与抗血管增生药物构成组合疗法。VEGF可以通过募集免疫抑制细胞来帮助构建免疫抑制TME。而且血管增生抑制剂可以增加免疫细胞浸润。
对于那些突变负担低,没有T细胞浸润并且PD-L1表达量很低的肿瘤来说,需要解决的问题不单是将更多的效应T细胞吸引到TME中,还需要将肿瘤抗原呈现给T细胞。改善这方面的方法包括使用CAR-T细胞疗法,这种方法需要找到对NSCLC有特异性的细胞表面抗原。
肿瘤免疫疗法在短时间里取得的卓越临床成功意味着它们可能成为未来治愈包括NSCLC在内的多种肿瘤的基础。
推动个体化医疗和临床试验设计
在肿瘤进化的过程中对肿瘤的基因组特征进行重复检查是设计个体化医疗的关键步骤。过去对基因组特征的重复检查意味着再度进行组织活检,这一方法并不是对每个患者都适用,而且伴随着并发症的风险。最近新兴的检测手段是通过液体活检检查血液中的循环肿瘤DNA(circulatingtumorDNA,ctDNA)。临床试验表明,使用液体活检来检测EGFRT790M突变可以帮助筛选适于接受osimertinib治疗的患者。目前,研究人员正在开发能够同时检测多种分子标记物的ctDNA检测方法,从而进一步支持对肺癌患者的个体化治疗。
由于很多基因变异不常见或者非常罕见,而且在临床试验中接受检测的组合疗法有上百种,这对募集足够的患者来进行临床试验是一个很大的挑战。为此,新的临床试验流程被设计出来。这类新流程可以在同一个临床试验中检测多种不同靶向疗法的作用,或者检测同一种靶向疗法对多种不同癌症的作用。
展望未来
对NSCLC的治疗方法已经出现了翻天覆地的变化。对肿瘤生物机理更深刻的了解让开发靶向疗法成为可能,这迎来了个体化医药的时代。而且,ICBs的出现让某些患者的存活期大幅度增加。然而,这些疗法的疗效通常只出现在少数患者身上。靶向治疗的一个主要顾虑是最初靶向初始克隆的疗法不能有效靶向次级克隆,导致癌症复发。因此为了进一步改善患者预后,我们需要对肿瘤获得抗性的机制做出更深入的了解。同时关注主要肿瘤和次级肿瘤可能是开发更有效持久的靶向疗法的必要条件。
使用ctDNA来追踪早期肺癌的进化动态应该被扩展到检测致癌基因和抗性基因突变,从而提供一种ctDNA指导的靶向疗法模式。对肿瘤组织进行系统性地收集(包括在癌症进化过程中不同时间点和不同转移病灶)对进一步的医疗进展非常关键。
发现更准确预测对免疫疗法反应的生物标记物对最有效地使用免疫疗法至关重要。目前虽然PD-L1和肿瘤突变负担可以被用于选择患者,但是大部分患者不属于使用这两种生物标记物划分出的理想人群。将癌症基因组信息与TME的细胞构成对应起来将有助于理性设计组合疗法。
参考资料:
[1]Thebiologyandmanagementofnon-smallcelllungcancer
(原标题—Nature盘点:非小细胞肺癌的生物学机理和治疗方法)