首个治疗银屑病(牛皮癣)及银屑病关节炎的口服药物:阿普斯特
2014年9月,美国(FDA)批准阿普斯特作为口服药物治疗活动性银屑病关节炎(PsA)的成年患者以及能用光学或系统疗法治疗的中重度斑块状银屑病患者。
阿普斯特是一种口服磷酸二酯酶4 (PDE4)的小分子抑制剂,特异性为环腺苷单磷酸(cAMP)。有研究者认为银屑病表皮的异常增殖与cAMP有关,PDE4抑制会导致细胞内cAMP水平升高,以此治疗银屑病关节炎及银屑病患者。
 Glenmark版阿普斯特 30mg*30
Glenmark版阿普斯特 30mg*30商品名:OTEZLA
通用名:Apremilast(阿普斯特)
厂家:新基制药(后被百时美施贵宝收购)
规格: 10mg,20mg,30mg
首次获批时间:2014年9月
用法用量为了减少胃肠道症状,按照以下计划滴定至推荐剂量30mg,每天2次。
①第一天:早晨10mg
②第二天:早晨10mg和傍晚10mg
③第三天:早晨10mg和傍晚20mg
④第四天:早晨20mg和傍晚20mg
⑤第五天:早晨20mg和傍晚30mg
⑥第六天及之后:30mg每天两次
与食物或不与食物同服均可,不可粉碎、裂开或咀嚼药片。
严重肾功能损害时:
①推荐剂量为30mg每天一次。
②对于初始剂量滴定调整,可按上述早晨剂量逐渐调整至30mg,每天一次。
银屑病关节炎
临床数据阿普斯特的安全性和有效性在3个多中心、随机、双盲、安慰剂对照试验(研究PsA-1、PsA-2和PsA-3)中进行了评估。本研究随机选取了1493例接受过或正在接受疾病改善型抗风湿药物(DMARD)治疗的成人活动性PsA(3个关节肿胀和3个关节疼痛)患者。参与这些研究的患者至少确诊PsA有6个月。在PsA-3研究中,患者被要求有一个直径至少为2厘米的符合条件的银屑病皮损。
在3项研究中,患者被随机分为安慰剂组(n=496)、阿普斯特20 mg组(n=500)和阿普斯特30 mg组(n=497),每天两次。在试验期间,患者被允许同时接受稳定剂量的甲氨蝶呤[MTX (25 mg/周)]、磺胺嘧啶[SSZ (2 g/天)]、来氟米特[LEF (20 mg/天)]、低剂量口服皮质类固醇(相当于每天10 mg强的松)和/或非甾体类消炎药(NSAIDs)。
主要观察终点是在第16周达到ACR20缓解的患者百分比,第24周收集安慰剂对照的疗效数据并进行分析。在第16周时,关节计数至少没有改善20%的患者被认为是无反应者。
安慰剂无反应者按照滴定方案以盲法按1:1的比例重新随机分配至阿普斯特每天两次,每次20mg组或阿普斯特每天两次,每次30mg组。阿普斯特组患者仍在接受最初的治疗。在第24周,所有剩余的安慰剂患者被重新随机分配至阿普斯特每天两次,每次20mg组或阿普斯特每天两次,每次30mg组。
为了便于统一在RA的治疗试验中观察药物的疗效,美国风湿病学会(ACR)规定一些观察指标,若患者达到20%、50%或70%的缓解即达到ACR20、ACR50或ACR70缓解。这些指标包括:关节压痛数、关节肿胀数及下列5项中至少3项:患者对疼痛的VAS评分、患者对疾病全面的评估、医师对患者的全面评估、患者对残疾状况的评价、急性期反应物 (如ESR或CRP)。
3项研究均纳入PsA亚型患者,包括对称性多关节炎(62.0%)、非对称性少关节炎(27.0%)、远端指间关节(DIP)关节炎(6.0%)、残肢关节炎(3.0%)和主导性脊柱炎(2.1%)。PsA的平均病程为5年。患者同时接受至少一种DMARD (65.0%)、MTX(55.0%)、SSZ(9.0%)、LEF(7.0%)、低剂量口服皮质类固醇(14.0%)和NSAIDs(71.0%)的治疗。既往用小分子DMARDs治疗的患者仅占76.0%,既往用生物DMARDs治疗的患者占22.0%,其中9.0%的患者既往用生物DMARD治疗失败。
试验结果表明:
PsA-1组中,两组患者(安慰剂组 VS 阿普斯特)在16周达到ACR20缓解的比例为19% VS 38%,ACR50缓解的比例为6% VS 16%,ACR70缓解的比例为1% VS 4%。
PsA-2组中,两组患者(安慰剂组 VS 阿普斯特)在16周达到ACR20缓解的比例为19% VS 32%,ACR50缓解的比例为5% VS 11%,ACR70缓解的比例为1% VS 1%。
PsA-3组中,两组患者(安慰剂组 VS 阿普斯特)在16周达到ACR20缓解的比例为18% VS 41%,ACR50缓解的比例为8% VS 15%,ACR70缓解的比例为2% VS 4%。

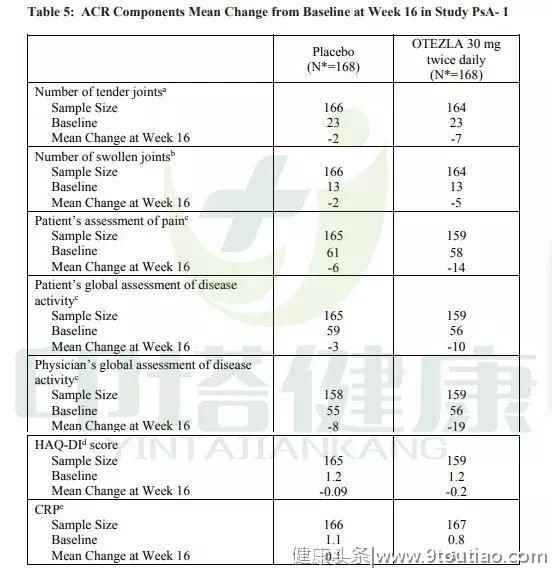
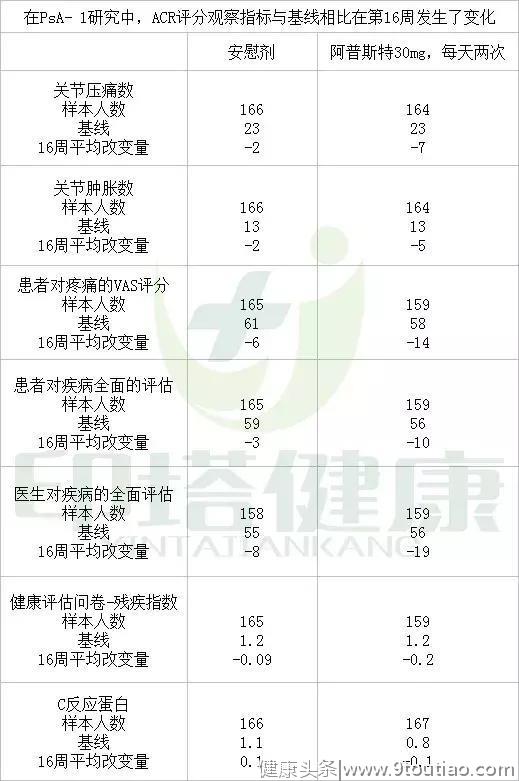
与第16周的安慰剂相比,每天两次每次30mg的阿普斯特可以改善ACR评分的各项观察指标。结果见下表:
 不良反应
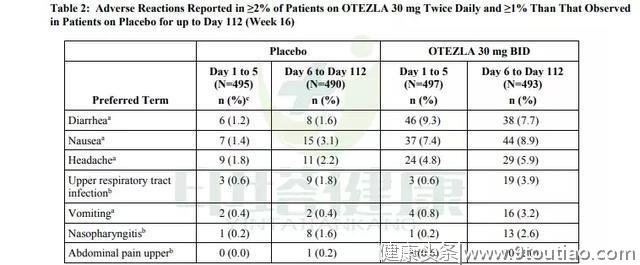
不良反应阿普斯特组第1~5天最常见的不良反应有:腹泻(9.3%)、恶心(7.4%)、头痛(4.8%)、呕吐(0.8%)、上呼吸道感染(0.6%)、腹痛(0.6%)、鼻咽炎(0.2%)。
阿普斯特组第6~112天最常见的不良反应有:恶心(8.9%)、腹泻(7.7%)、头痛(5.9%)、上呼吸道感染(3.9%)、呕吐(3.2%)、鼻咽炎(2.6%)、腹痛(2%)。
在临床研究中,包括扩展研究中报道的患者对阿普斯特的其他不良反应有:
免疫系统疾病:过敏
调查研究:体重减轻
胃肠道疾病:频繁排便,胃食管反流症,消化不良
新陈代谢和营养失调:食欲下降
神经系统紊乱:偏头痛
呼吸、胸部和纵隔疾病:咳嗽
皮肤和皮下组织疾病:皮疹
银屑病
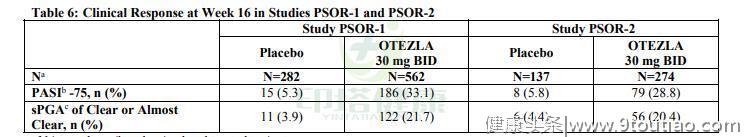
临床数据两项多中心、随机、双盲、安慰剂对照试验(研究PSOR-1和PSOR-2)共纳入1257名受试者,年龄18岁以上,有中度至重度斑块性银屑病【体表面积(BSA)累及≥10%,静态医师全面评估(Static Physician Global Assessment sPGA)≥3(中度或重度疾病),银屑病面积及严重程度指数(PASI,Psoriasis area and severity index)评分≥12分,可选用光学治疗或全身治疗】。受试者被允许在面部、腋窝和腹股沟使用低效力局部皮质激素治疗。头皮银屑病患者可以使用煤焦油洗发水和/或水杨酸头皮制剂治疗头皮损伤。
PSOR-1纳入844名受试者,PSOR-2纳入413名受试者。在这两项研究中,受试者被随机分配到阿普斯特组,每次接受阿普斯特30mg,每日两次,或安慰剂组16周。
两项研究都评估了受试者在第16周达到PASI-75的比例,以及在第16周sPGA评分为0(clear 完全清除)或1(almost clear 大部分清除)的比例。
在两项研究中,受试者的年龄都在18岁到83岁之间,总体平均年龄为46岁。BSA累及的平均基线为25.19% (中位21.0%),PASI评分平均基线为19.07 (中位16.80),sPGA评分为3分(中度)和4分(重度)的受试者分别为70.0%和29.8%。约30%的受试者接受过光疗法,54%的受试者接受过常规全身和/或生物治疗,37%的受试者接受过常规全身治疗,30%的受试者接受过生物治疗。大约三分之一的受试者没有接受过光疗法、常规全身疗法或生物疗法。共有18%的受试者有银屑病关节炎病史。
试验结果表明,PSOR-1组中两组患者(安慰剂组 VS 阿普斯特组)达到PASI-75的受试者比例为5.3% VS 33.1%,sPGA评分为0或1的比例为3.9% VS 21.7%。PSOR-2组中两组患者(安慰剂组 VS 阿普斯特组)达到PASI-75的受试者比例为5.8% VS 28.8%,sPGA评分为0或1的比例为4.4% VS 20.4%。
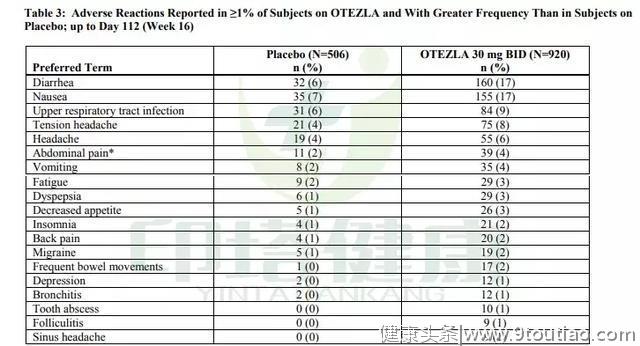
 不良反应
不良反应阿普斯特组最常见的不良反应有:腹泻(17%)、恶心(17%)、上呼吸道感染(9%)、紧张性头痛(8%)、头痛(6%)、腹痛(4%)、呕吐(4%)、疲劳(3%)、消化不良(3%)、食欲下降(3%)、失眠(2%)、背痛(2%)、偏头痛(2%)、频繁排便(2%)、抑郁(1%)、支气管炎(1%)、牙脓肿(1%)、毛囊炎(1%)、窦性头痛(1%)。
警告及注意事项
腹泻、恶心和呕吐上市后有与使用阿普斯特有关的严重腹泻、恶心和呕吐的报道,大多数事件发生在治疗的最初几周内,有些病人住院治疗。65岁或65岁以上的患者以及服用会导致血容量不足或低血压的患者,发生严重腹泻、恶心或呕吐并发症的风险可能更高,所以需要特别监测更容易出现腹泻或呕吐并发症的患者。减少剂量或停用阿普斯特的患者一般情况下病情迅速好转。如果患者出现严重腹泻、恶心或呕吐,考虑减少或暂停使用阿普斯特。
抑郁使用阿普斯特会增加患抑郁症的风险,在对有抑郁症病史和/或自杀想法或行为的患者使用阿普斯特之前,医生应仔细权衡使用阿普斯特治疗此类患者的风险和益处。应告知患者、他们的护理人员和家属,有必要对抑郁症的出现或恶化、自杀想法或其他情绪变化保持警惕,如果出现这些变化,应联系他们的医疗服务提供者。如果发生此类事件,处方者应仔细评估继续使用阿普斯特治疗的风险和益处。
银屑病性关节炎
在3个对照临床试验期间,两组患者(阿普斯特 VS 安慰剂)中报告有抑郁或情绪低落的比例为1.0%(10/998) VS 0.8%(4/495)。
两组患者(阿普斯特 VS 安慰剂)中因抑郁或情绪低落而停止治疗的比例为0.3%(4/1441) VS 0% (0/495)。
两组患者(阿普斯特 VS 安慰剂)中抑郁严重的比例为0.2%(3/1441) VS 0%(0/495)。
两组患者(阿普斯特 VS 安慰剂)中有自杀意念和自杀行为的比例为0.2%(3/1441) VS 0%(0/495)。
接受安慰剂治疗的两名受试者自杀,而接受奥替斯拉治疗的受试者没有自杀。
银屑病
在3个对照临床试验期间,两组患者(阿普斯特 VS 安慰剂)中报告有抑郁症的比例为1.3%(12/920) VS 0.4%(2/506).
两组患者(阿普斯特 VS 安慰剂)中因抑郁症停止治疗的比例为0.1%(1/1308) VS 0%(0/506)。
两组患者(阿普斯特 VS 安慰剂)中抑郁严重的比例为0.1%(1/1308) VS 0%(0/506)。
两组患者(阿普斯特 VS 安慰剂)中观察到自杀行为的比例为0.1%(1/1308) VS 0.2%(1/506)。
一名接受阿普斯特治疗的受试者试图自杀,一名接受安慰剂治疗的受试者自杀。
体重减轻在对银屑病关节炎(PsA)研究的对照期间,10% (49/497)服用阿普斯特的研究对象体重下降了5%-10%,而服用安慰剂的研究对象的这一比例为3.3% (16/495)。
在银屑病试验的对照期间,12%(96/784)使用阿普斯特治疗的受试者体重下降5%-10%,而服用安慰剂的研究对象的这一比例为5%(19/382)。体重下降≥10%发生在2%(16/784)使用阿普斯特的受试者中,发生在接受安慰剂治疗的受试者中仅有1%(3/382) 。
药物相互作用联合使用强细胞色素P450酶诱导剂利福平可减少阿普斯特的全身暴露,从而可能导致阿普斯特的疗效下降。因此,不推荐将细胞色素P450酶诱导剂(如利福平、苯巴比妥、卡马西平、苯妥英)与阿普斯特联用。
【重要提示】本公号【全球好药资讯】所有文章信息仅供参考,具体治疗谨遵医嘱!