[快讯]中国中枢神经系统胶质瘤免疫和靶向治疗专家共识 正式发布 | 姚瑜点评

神外前沿讯,1月29日,中华医学杂志官网上线了由中国医师协会脑胶质瘤专委会、上海市抗癌协会神经肿瘤分会编写的《中国中枢神经系统胶质瘤免疫和靶向治疗专家共识》
在免疫治疗与靶向治疗蓬勃发展的今天,中国第一个脑胶质瘤的免疫与靶向治疗专家共识的问世,对临床医生的指导意义重大。
据悉,为规范和提高胶质瘤的免疫和靶向治疗,中国医师协会脑胶质瘤专委会牵头组织国内有关专家,由上海华山医院神经外科、解放军总医院神经外科等共同牵头,历经数月制定了《中国中枢神经系统胶质瘤免疫及靶向治疗共识》(以下简称“共识”)
共识主要执笔者、本文通讯作者、复旦大学附属华山医院神经外科姚瑜教授对“神外前沿”表示:免疫和靶向治疗(技术)日新月异,在脑胶质瘤中的治疗作用越来越重要。此次共识的编写工作中,非常感谢各位专家的出色贡献。期待将来有更多中国学者,用自己数据来更新共识,以造福病患。
中国中枢神经系统胶质瘤免疫和靶向治疗专家共识(摘要)
中国医师协会脑胶质瘤专业委员会
上海市抗癌协会神经肿瘤分会
脑胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤之一。其中胶质母细胞瘤(GBM)的发病率最高,占全部胶质瘤的46.1%,年发病率约为3.20/10万。包括最大程度手术切除、术后辅助同步放化疗(替莫唑胺:TMZ)在内的现代综合治疗,仅能延缓胶质母细胞瘤的进程,肿瘤不可避免地复发。中位的进展时间6.9个月,总生存期14.6个月,治疗效果并不理想,急需开拓新的治疗策略。
靶向治疗主要是针对已经明确的肿瘤细胞致癌位点,从基因到蛋白分子水平,从而诱发肿瘤细胞的特异性死亡。靶向治疗导致的细胞可以引起或不引起相应的机体抗肿瘤免疫反应。
肿瘤免疫治疗是应用免疫学原理和方法,提高肿瘤细胞的免疫原性和对效应细胞杀伤的敏感性,激发和增强机体抗肿瘤免疫应答,并应用免疫细胞和效应分子输注宿主体内,协同机体免疫系统杀伤肿瘤、抑制肿瘤生长。
最近研究证实,中枢神经系统(CNS)存在淋巴管和活跃且被严密调控的免疫系统[1],打破了中枢神经系统是“免疫豁免(immune privileged)”区的传统认识, 同时GBM的生长可以破坏血脑屏障的紧密性,有利于淋巴细胞进出脑组织[2];即便是血脑屏障完整,淋巴细胞在趋化因子的作用下也可穿过血脑屏障[3]。
这些为脑GBM的免疫治疗提供理论依据。随着对CNS免疫系统的重新认识、以及免疫治疗在其他实体肿瘤领域取得重大成果,脑胶质瘤免疫治疗已经成为一种极具潜力的治疗方式。并且,从整个肿瘤的领域来看,随着肿瘤免疫学机制的逐渐阐明,在未来的几十年内,肿瘤的治疗策略将从以肿瘤为中心转向以患者(包括免疫系统)为中心。
胶质瘤的重要靶向及免疫治疗方法
(一)贝伐单抗靶向治疗进展
贝伐单抗是一种重组人源性IgG1单克隆抗体(MAb),由约93%人源抗体的结构区和7%可结合VEGF的鼠源单抗的互补决定区组成,与VEGF亚型结合具有高亲和性,特异性强。贝伐单抗能够特异性地与VEGF结合(主要与VFGF-A结合),减弱或阻止VEGF与血管内皮细胞表面的VEGFR-1、VEGFR-2结合,并阻断VEGFR介导的下游信号转导通路,抑制其生物学活性,减少肿瘤新生血管的形成,使肿瘤生长受限。此外,VEGF诱导生成的肿瘤血管存在结构和功能的异常,血管渗透性增加,组织间压力增高,影响抗肿瘤药物到达肿瘤组织,导致放化疗的疗效降低。而贝伐单抗可使肿瘤血管正常化,改善血管通透性,增加肿瘤组织有效药物浓度,发挥其抗肿瘤作用。(相关报道:[研究]应用贝伐珠单抗治疗高级别胶质瘤的研究进展/ 颜成睿 张梦雨 马文斌)
国外大型机构做的贝伐单抗治疗GBM的临床研究如下,为胶质瘤的综合治疗提供了较多思路。对于原发GBM来说,贝伐单抗联合替莫唑胺不能延长患者的总生存期(OS),只能延长患者的无进展生存期(PFS)。RTOG-0825和AVAglio2个三期临床研究均证实了上述结论[15,16](I级证据)(循证医学证据级别详见表 1)。当考虑到分子亚型和不同分子标志物,在一些特殊种类原发GBM中,贝伐单抗的应用可能提高患者的OS。Chinot等[17]应用AVAglio临床研究的数据,对这些病人的血浆进行MMP9检测,最后统计发现低表达MMP9的原发GBM应用贝伐单抗可以延长患者的OS,平均安慰剂组OS为13.6月,贝伐单抗治疗组平均OS为18.8月(I级证据)。Sandmann等[18]同样对AVAglio临床研究的数据进行分析,发现TCGA分型神经元前型中IDH野生型应用贝伐单抗可以延长患者的总OS,平均贝伐单抗组OS17.1个月,安慰剂组12.8个月(I级证据)。对于复发GBM来说,贝伐单抗,联合其他化疗方式如洛莫司汀、伊立替康(CTP-11)、TMZ可部分延长患者的OS。Taal等设计一组对比贝伐单抗单药和联合治疗的临床差异,9个月总生存率贝伐单抗单药组为38%,洛莫司汀组43%,贝伐单抗/洛莫司汀110mg组为87%,贝伐单抗/洛莫司汀90mg组为59%[19]。Field[20]等对比贝伐单抗单药和联合卡铂的临床疗效,发现联合治疗组不能改变复发GBM患者的中位OS及PFS(II级证据)。Friedman等[21]对比贝伐单抗单药及联合CPT-11的临床试验发现中位PFS贝伐单抗单药组为4.2个月,联合治疗组为5.6个月。中位OS贝伐单抗单药组为9.2个月,联合治疗组为8.7个月(II级证据)。而基础研究表明贝伐单抗在胶质瘤动物模型中弊多利少,易增加MET表达,促进肿瘤间质改变[22]。
推荐:对于初发GBM患者标准化治疗上不推荐加贝伐单抗,因为加用只延长PFS,不延长OS,除非有分子标记物等亚组检测。亚组分析发现低MMP9组及前神经元型中IDH野生型患者可能对贝伐单抗治疗获益,在未来需要更多的结合分子标志物的指导来寻找合适的受益者。对于复发GBM,推荐使用贝伐单抗,可联合采用洛莫司汀、CTP-11、TMZ等[15,19]。5项II期临床试验数据表明,弥散MRI是抗VEGF治疗复发GBM的独立预测性影像生物标志物。此信息可用于在未来的临床试验确定复发患者抗血管治疗选择[23]。
另一方面,由于贝伐单抗主要是作用于新生血管,也易抑制正常新生血管的形成,会导致一些不良反应。其中发生频率最高的包括高血压(发生率高达42.1%,高血压危象的发生率可达1.0%,一般可通过口服抗高血压来进行有效控制)、疲乏或乏力、腹泻和腹痛。而严重的不良反应则包括胃肠道穿孔、手术伤口开裂,伤口愈合并发症、重度或致死性出血、血栓栓塞、尿蛋白增高、超敏反应、输液反应、中性粒细胞减少症、感染几率增加等。临床上值得关注。故而应用贝伐单抗治疗的病人在短期内(1个月)不宜再次手术治疗,以免影响手术愈合。
(二)脑胶质瘤抗表皮生长因子受体(EGFR)治疗进展
EGFR,主要调节细胞增殖等细胞活动。EGFR基因突变或扩增常导致EGFR过度激活,成为肿瘤细胞增殖失控的重要因素。尼妥珠单抗、帕尼单抗、西妥昔单抗和mAb 806是针对EGFR的单克隆抗体,可竞争性特异性结合EGFR蛋白或(和)EGFRvⅢ型突变体,阻断EGFR胞内磷酸化位点激活,抑制肿瘤恶性表型。
国内外大型机构做了部分抗EGFR治疗GBM的临床研究,目前还没有理想的疗效。对于新诊断胶母患者,Weller在目前标准化疗方案上,增加Rindopepimut不能延长新发的EGFRvⅢ型GBM患者的生存时间(I级证据)。Westphal等[25]在标准放化疗及放化疗后12周加入尼妥珠单抗治疗,残余肿瘤组的中位OS试验组为19.5个月,对照组16.7个月(P = 0.706 1),肿瘤全切组OS试验组为23.3个月,对照组为21个月的患者(P = 0.406 8)(I级证据)。Wang等[26]在标准化同期放化疗及TMZ6周期化疗加入尼妥珠单抗平均PFS10.0个月,平均OS15.9个月(III级证据)。
在复发GBM中,Reardon等[27]应用帕唑帕尼和拉帕替尼II期试验中,6个月的无进展生存期在PTEN/EGFRvIII阳性和阴性组中分别为0、15%。因此,实验提前终止,两种药物联合的抗肿瘤效力有限(IV级证据)。Wen等[28]应用埃罗替尼联合替西罗莫司治疗复发GBM,42例胶母患者中12例(29%)病情稳定,PFS6为13%,16例间变性胶质瘤患者中2例(12.5%)病情稳定,PFS6为8%。由于药物毒性,最大耐受剂量并没有取得预期效果(IV级证据)。
还需进一步结合分子标记物的筛选,找出可能的受益者。
(三)MET融合基因治疗进展
通过对中国人群脑胶质瘤的高通量NGS测序数据库,中国胶质瘤协作组发表了脑胶质瘤中融合基因的全景图,首次在胶质母细胞瘤中发现了多次重复出现的PTPRZ1-MET融合基因及其4种不同的融合方式,并且利用独立的192个病例验证了这一发现。随后靶向治疗PTPRZ1-MET融合基因继发胶质母细胞瘤的药物——伯瑞替尼产生,这是中国第一个从大数据模拟、靶点验证到高通量筛选的精准治疗药物,也是国际上第一个针对继发胶质母细胞瘤特异亚型的靶向小分子化合物。目前该研究处于Ⅰ期临床试验,招募已经结束。(相关报道:[简讯]伯瑞替尼I期临床试验初见成效 部分继发胶质瘤母细胞瘤总生存期有望大幅提高 |李文斌 姚瑜点评)
此外,c-MET(mesenchymal-epithelial transitionfactor)信号可以通过基因突变、基因增殖、蛋白过表达和/或配体依赖性的自分泌、旁分泌途径促进肿瘤生长、侵袭和播散,并与肿瘤的较差的临床预后和药物耐药有较强的关联性。目前针对该信号通路靶点的药物有卡博替尼(XL184 cabozantinib)、Foretinib、MetMAb和Tivantinib。目前有在I期和II期临床试验正在进行。
(四)BRAF靶向治疗研究新进展
BRAF V600改变在胶质瘤中占相当大的比例,包括GBM、星形细胞瘤(A)、PXA和JPA。1项II期(n=122)、开放、不依赖组织学的VE-BASKET研究(NCT01524978),探讨了选择性BRAF V600激酶抑制剂维罗非尼在BRAF突变的胶质瘤的活性。患者接受维罗非尼(960mg,2次/d)治疗直至出现疾病进展或不可耐受的毒性。维罗非尼在BRAF V600突变的胶质瘤(PXA、恶性胶质瘤、JPA和AA)均表现出活性,同时具有可耐受的安全性,不良事件情况与之前在黑色素瘤研究中观察到的一致。 期待进一步的临床试验结果。在儿童低级别星形细胞瘤领域,具有更佳血脑屏障穿透能力的BRAF肿瘤蛋白新一代抑制剂MLN2480,也正在积极开展相关研究当中。
(五)胶质瘤抗PD-1治疗进展
程序性细胞死亡因子1(programmed cell death1, PD-1)是一种共刺激分子,属于CD28/CTLA-4家族。PD-L1广泛分布于组织中与PD-1结合后通过抑制T、 B细胞活性来防止自身免疫疾病的发生。PD-1/PD-L1是肿瘤细胞逃离机体免疫杀伤的重要免疫抑制靶点。Nduom等[29]研究者证实PD-L1 表达越高,GBM患者预后越差。国内的研究进展也发现PD-L1 表达和胶质瘤的分级相关[12]。PD-1/PD-L1抗体包括Pembrolizumab、Nivolumab、Durvalumab等,目前,有若干针对GBM的临床研究在进行中,希望肿瘤免疫治疗为胶质瘤的治疗提供新的思路和进展。
同时也有学者在探究PD-L1与基因错配修复(MMR)间的关系。有的研究认为,两者在胶质瘤中并无很明显的关联性。而在其他如肠癌的肿瘤中,MMR的出现对PD-L1免疫检查点疗法的疗效有一定的预测意义。同时由于MMR在胶质瘤中的发生率并不高,单次研究中的结论,或许还需要更多的更大样本研究来进一步评估来MMR分子标志对PD-L1的免疫检查点疗法所能起的预期收益的预示作用。(相关报道:、、)
考虑到PD-1抗体在胶质瘤治疗中具有重要的潜力。亟需要对胶质瘤样本进行PD-1相关分子标记物检测,2017年美国临床肿瘤学会(ASCO)会议指出PD-1/PD-L1 抑制剂均有其特定的PD-L1检测方法,可使用依赖着不同的PD-L1水平检测。但肿瘤固有的时空异质性一定程度上限制了PD-L1作为一个预测性生物标志物的临床应用。
此外,会议中还介绍了目前生物标记物在肿瘤免疫治疗中的研究进展。潜在的标记物包括PD-L1蛋白表达,TIL,Th1/IFN-Ƴ,microbiome,肿瘤突变负荷(TMB)、干扰素通路基因突变、错配修复缺失(dMMR)等。目前的研究表明,除了肿瘤细胞PD-L1的表达与肿瘤浸润的淋巴细胞外,肿瘤突变负荷(TMB)、微卫星不稳定(MSI)、错配修复缺陷(dMMR)及新抗原负荷等均与PD-1免疫治疗的疗效相关[34-36]。目前获批的肿瘤免疫生物标记物为PD-L1和MSI。未来需要更多的蛋白或基因研究来指导临床用药或改善耐药。
在临床中,对肿瘤样本进行全外显子组测序能够有效地分析肿瘤的突变负荷、微卫星状态及错配修复机制的功能。最新的临床试验表明,通过全外显子组测序能够为肿瘤患者根据个人特定的癌症突变定制相应的疫苗,起到避免肿瘤复发的疗效[37]。因此,这些潜在不断被研究与开发的新型生物标志物不仅能够准确地检测与PD-1免疫检查点抑制剂疗效相关的指标,为免疫治疗提供全面的预测;同时还能够完整地分析肿瘤的基因特征,为肿瘤疫苗的开发制备提供重要的依据。
(六)脑胶质瘤细胞免疫治疗进展
免疫治疗是通过宿主免疫系统调节产生靶向肿瘤的反应过程。这类技术包括过继免疫细胞治疗(ACT)[38]、肽疫苗(peptide vaccination)[39-40]、树突状细胞免疫治疗(dendritic cell-based therapy)[7-9]和溶瘤病毒治疗(immunovirotherapy)等[41]。
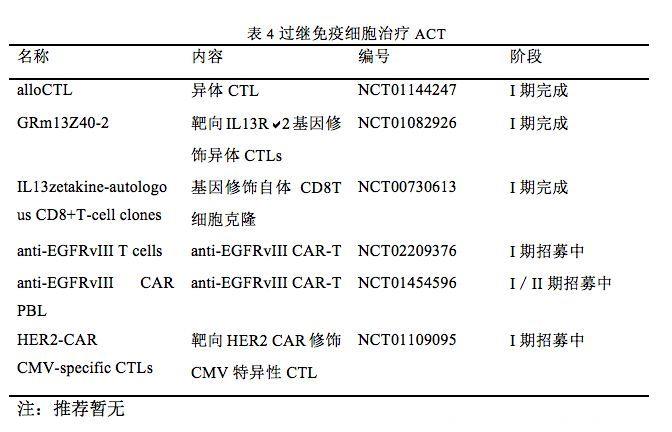
过继免疫细胞治疗(表 4):ACT是指向肿瘤患者体内转输具有抗肿瘤效应的免疫活性细胞,特异性或者非特异性杀伤肿瘤或者激发体内抗肿瘤免疫应答。特异性肿瘤相关抗原(TAA)不表达或很少表达在肿瘤周围正常组织,可成为免疫治疗有意义的靶标。有学者利用SEREX方法筛选胶质瘤干细胞相关抗原,发现URGCP是胶质瘤的一种新的相关抗原[42]。ACT能够扩增活化具有抗肿瘤反应的宿主细胞,如NK,LAK,γδT细胞。应用于GBM的ACT治疗从非特异性NK和LAK细胞发展到肿瘤特异性免疫系统如病毒特异性CTL和CAR修饰T细胞。GBM特异性T细胞临床试验包括靶向EGFRvIII的CAR-T细胞,靶向IL13R2异体CTL和CAR修饰的CMV特异性CTL。

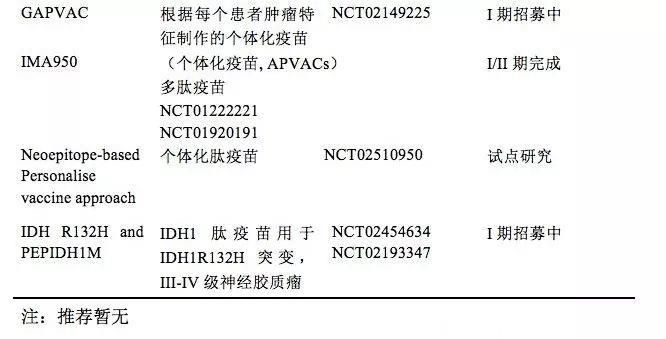
肽疫苗(表 5):此类疫苗产生基于代表肿瘤抗原特异性靶标的肽序列。肽疫苗具有高度特异性并易于产生抗原,但免疫原性较弱,可以通过联合载体蛋白钥孔戚血蓝蛋白和破伤风类毒素解决。因为液性抗原不利于诱导细胞免疫反应,所以需要添加佐剂。针对EGFRvIII阳性患者的疫苗Rintega II临床试验显示复发性患者受益,三期临床试验初步数据无效[43]。增加Rindopepimut不能延长新发的EGFRvⅢ型胶质母细胞瘤患者的生存时间[24]。另有靶向IDH1突变的肽疫苗也在试验。GBM因缺乏共通的特异性抗原表达,对肽疫苗的发展是重要挑战。
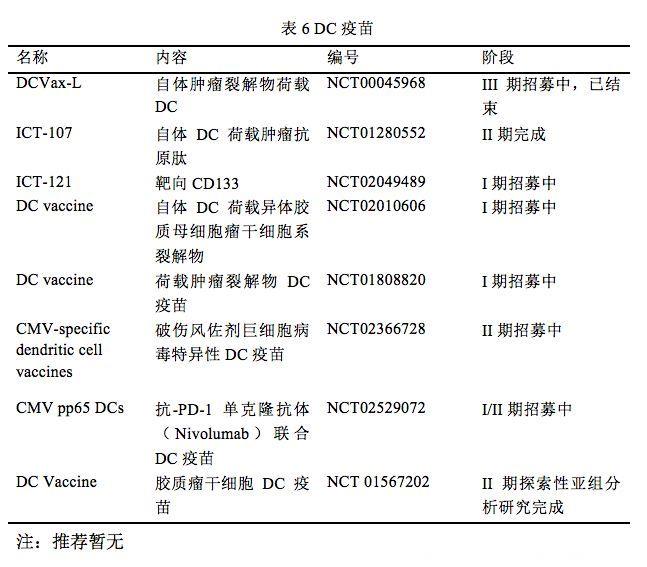
DC疫苗(表 6):DC作为重要的抗原提呈细胞并启动获得性免疫。DC转运至淋巴结,通过MHC I类和II类分子提呈肿瘤抗原给CD8+ T细胞和CD4+ T细胞,诱导肿瘤特异性免疫反应。因GBM的TAA范围过于广泛,多采用肿瘤裂解物等荷载DC。临床试验显示DC免疫治疗与标准疗法比较,可以有效提高总生存期和2年生存率。

溶瘤病毒(表 7):使用活的病毒运载DNA进入人细胞的免疫方法称为病毒载体疫苗。载体包括编码抗原的DNA,一旦在感染细胞上表达,就能诱导免疫反应。病毒具有免疫原性并能编辑表达特异肿瘤抗原,增强肿瘤抗原提呈,诱导靶向肿瘤细胞的CTL增强。同时,病毒可以作为溶瘤制剂。溶瘤病毒针对特异性肿瘤细胞,减少脱靶效应。腺病毒、风疹病毒和疱疹病毒应用于临床试验。初步病毒免疫治疗直接采用瘤内给药,全身给药效果和抗肿瘤作用有待进一步评估。
(本文为摘要版,全文请访问:中华医学杂志官网 http://nmjc.net.cn,或扫描下面二维码)
共识专委会名单

共识撰写者名单

责任编辑: