16+文章带你用机器学习深入研究2型糖尿病
今天和大家分享的是2020年12月份发表在Diabetes Care杂志上的一篇文章(IF=16.019)“Interpretable Machine Learning Framework Reveals Robust Gut Microbiome Features Associated With Type 2 Diabetes”。文章中作者使用机器学习在三个中国人群队列(1个发现队列,2个独立验证队列,总计逾9千人)的横断面分析中确定与2型糖尿病相关的肠道微生物组特征,构建了具有识别特征的微生物组风险评分(MRS),后续研究进一步证实了2型糖尿病MRS的关系,发现体内脂肪分布是调节肠道微生物组与2型糖尿病关系的关键因素。
Interpretable Machine Learning Framework Reveals Robust Gut Microbiome Features Associated With Type 2 Diabetes
机器学习揭示2型糖尿病相关肠道微生物组特征
一、研究背景
2型糖尿病受宿主遗传和环境因素的共同影响,其患病率在发达国家和发展中国家都迅速上升。肠道微生物组被认为是可改变的环境因素,在2型糖尿病的发展中起着重要作用。到目前为止,尚未有证据证明将特定的肠道微生物组特征与2型糖尿病密切相关。由于机器学习预测通常难以解释,因此其在临床环境中的应用仍然受到限制。值得注意的是,随着近几年方法学的发展,可解释的算法可以解锁传统的机器学习结果“黑匣子”状态。新算法与大规模肠道微生物组数据的集成有可能从根本上揭示肠道微生物组与2型糖尿病之间的关系。
二、研究思路
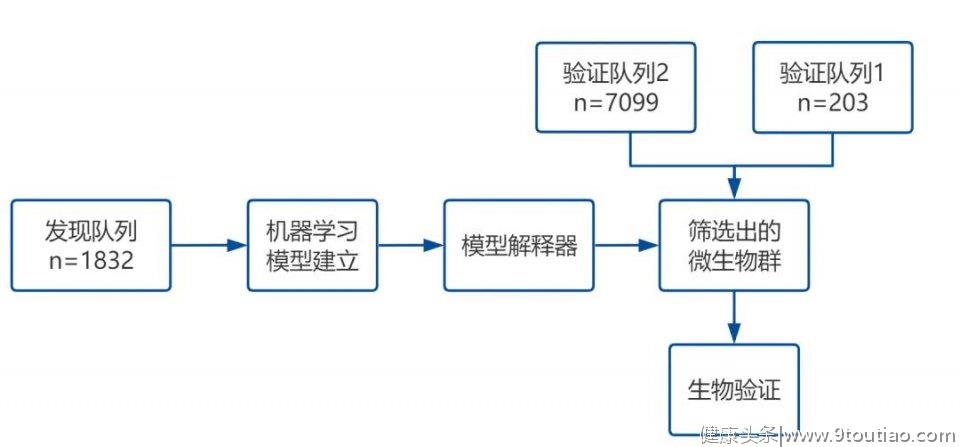
三、结果解读
1.鉴定出的微生物组合对2型糖尿病风险有很强的预测作用
在当前研究中,2型糖尿病的预测使用的是LightGBM,确定了有助于2型糖尿病预测的21个特征,其中15个是微生物组特征(unweighted_nmds6和observed_species是微生物多样性的指标,其他是与分类群相关的特征)。与所有297个输入特征相比,最终发现已识别的21个特征显示出相似的预测能力,并且大多数选定的与分类群相关的特征具有低到中等的相关性。
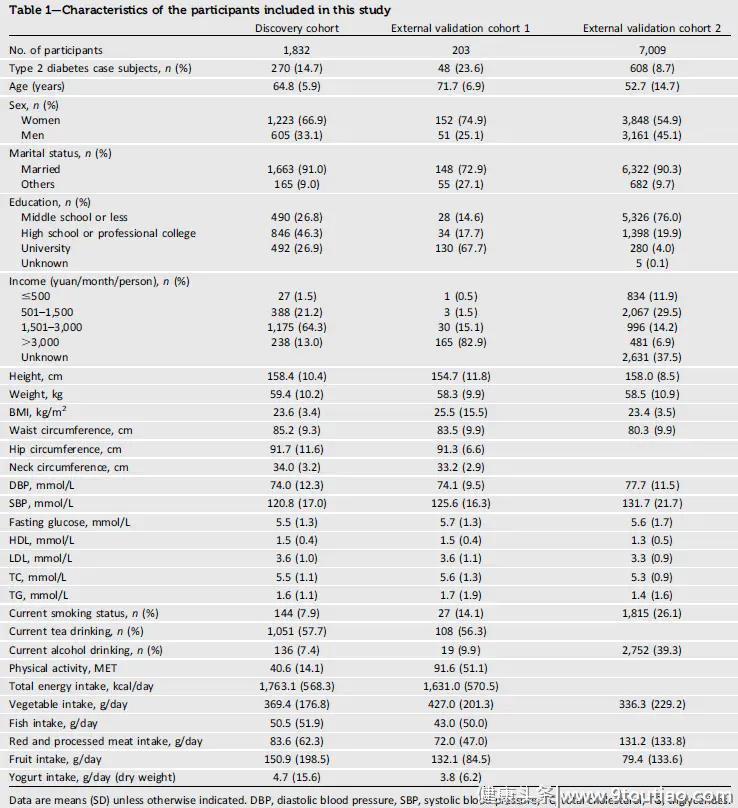 表1.三个研究队列的具体特征
表1.三个研究队列的具体特征与宿主遗传学和其他环境因素(Framingham-Offspring Risk Score [FORS]1lifestyle1diet) 相比,选定的微生物组特征显示出更好的2型糖尿病预测准确性。在内部验证队列中,在模型中添加选定的微生物组特征(FORS 1 lifestyle 1 diet) 可将曲线下的面积从0.63(95%CI 0.55-0.71)增加到0.73(95%CI 0.66-0.8)(P = 0.0024),内部测试队列中的0.66(95%CI 0.57–0.76)至0.73(95%CI 0.65-0.82)(P = 0.016)和0.51(95%CI 0.45–0.57)至0.64(95%CI外部验证组1(P中为0.56-0.71)= 0.0036)。在排除发现队列(P = 0.49)和验证队列1(P = 0.14)中,基于微生物组的分类在排除糖尿病前期患者之前和之后的个别性能没有显着差异。
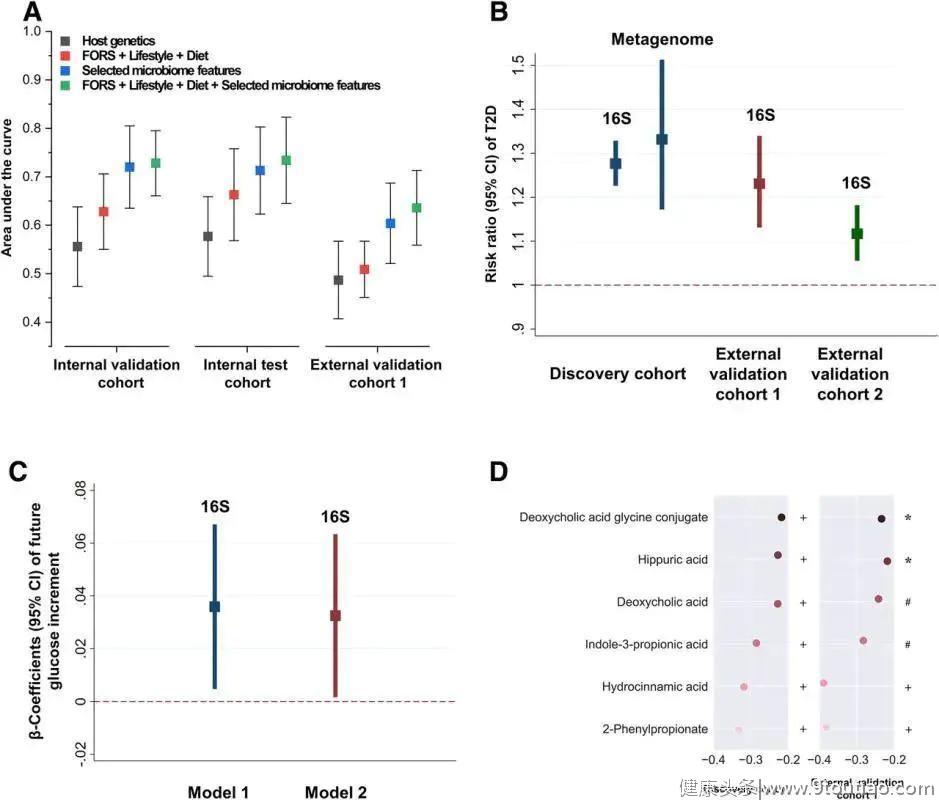 图1.微生物组特征显示出2型糖尿病高预测准确性
图1.微生物组特征显示出2型糖尿病高预测准确性为评估2型糖尿病发展过程中个体微生物组的风险,基于14种已鉴定的微生物组特征(表2)生成了MRS(评分范围0–14 )。发现队列中的MRS(每1单位MRS变化)始终与2型糖尿病风险呈正相关(风险比[RR] 1.28,95%CI 1.23–1.33),外部验证队列1(RR 1.23、95%CI 1.13–1.34)和外部验证队伍2(RR 1.12、95%CI 1.06-1.18)。还发现可以根据发现队列中1,068例基于宏基因组测序注释的样本(包括159例2型糖尿病患者)中的数据来复核MRS 2型糖尿病的相关性。与16S rRNA结果一致,基于基因组的MRS始终显示与2型糖尿病风险呈正相关(新MRS的每单位变化:RR 1.33,95%CI 1.17-1.51)。但是传统方法导出的MRS结果无法在两个外部队列中得到验证。
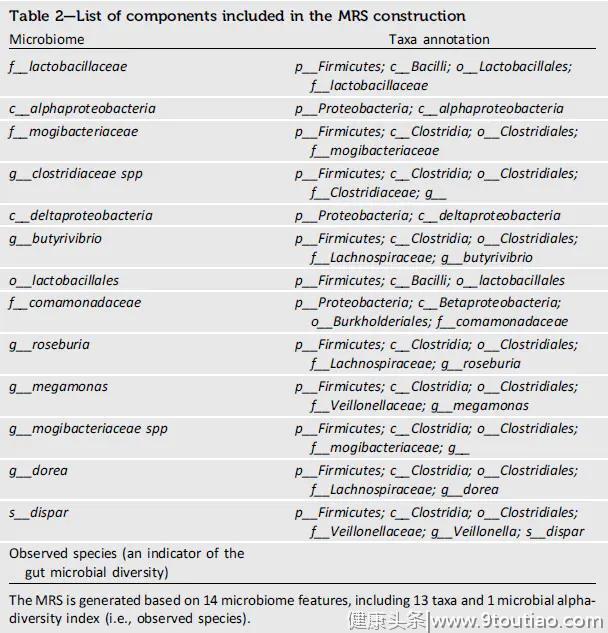 表2.MRS结构中包含的组件列表
表2.MRS结构中包含的组件列表在发现队列中,MRS与年龄(Pinteraction= 0.8)或MRS与性别(Pinteraction= 0.3)在2型糖尿病风险方面没有显著的交互作用。按年龄和性别分层的MRS-2型糖尿病关系的亚组分析得出了相似的结果。
2.2型糖尿病预测的基础因素
研究结果表明,年龄> 66.7岁或腰围> 84.6 cm的个体有2型糖尿病的高风险。这是符合标准的在医疗保健中国(标准2型糖尿病一致的),这表明个人> 65岁腰围>85厘米(男)或80厘米(女)是在高风险2型糖尿病的高危人群。
根据其SHAP依赖性确定已识别的13个与生物分类相关的特征的最佳阈值。当将13类群相关特征中的8种显示为二元变量时,它们与2型糖尿病具有统计学意义的相关性-高丰度(即等于或高于最佳阈值),而低丰度(即低于最佳阈值)。如果将选定的微生物组的丰度视为连续变量,则只有3个与分类单元相关的特征显示出与2型糖尿病的显着相关性。
3.鉴定的微生物的组合与葡萄糖的增加是纵向的
我们对基线时空腹血糖正常(空腹血糖<7 mmol / L)的249位受试者进行了前瞻性研究。该组的平均(SD)起始和终止血糖水平分别为5.2(0.5)mmol / L和5.4(0.6)mmol / L。我们的结果表明,在两个统计模型中,MRS与未来的葡萄糖增加显着正相关(P <0.05)。
4.微生物鉴定与宿主血液代谢组的相关性
对发现队列(n = 903)和外部验证队伍1(n = 113)的血清样本进行了目标代谢组学分析,并评估了2型糖尿病相关微生物(即MRS)与199种血清代谢物的相关性。具有2型糖尿病药物使用史的参与者被排除在本分析之外。在与粪便样品相同的时间点收集血清样品。我们发现,MRS与发现队列和外部验证队列1中的六种代谢物始终相关。
MRS与2-苯基丙酸、氢肉桂酸和吲哚-3-丙酸呈负相关,均与肠道微生物代谢相关(22-24)。去氧胆酸和去氧胆酸甘氨酸合物是由结肠环境微生物菌群中存在的酶作用产生的次级胆汁酸。脱氧胆酸和脱氧胆酸甘氨酸共轭物是通过存在于结肠环境的微生物菌群中的酶的作用而产生的二级胆汁酸。最近的研究表明,肠道菌群的改变不仅会影响胆汁酸,而且还会影响胆汁酸受体的信号传导(即FXR和TGR5)。据报道,FXR参与了葡萄糖稳态,能量消耗和脂质代谢有关。这些观察提供了对我们鉴定的以MRS为代表的微生物特征在宿主代谢中的潜在功能和机制的见解。
5.无菌小鼠中确定的微生物组合影响2型糖尿病的发展
在四个实验组之间,基础空腹血糖没有显着差异(P = 0.11)。与低MRS个体或无菌对照小鼠的水平相比,从非2型糖尿病或2型糖尿病的高MRS个体移植肠道菌群的小鼠显示空腹血糖水平显着增加。无菌对照组和低MRS组之间的空腹血糖无明显差异。
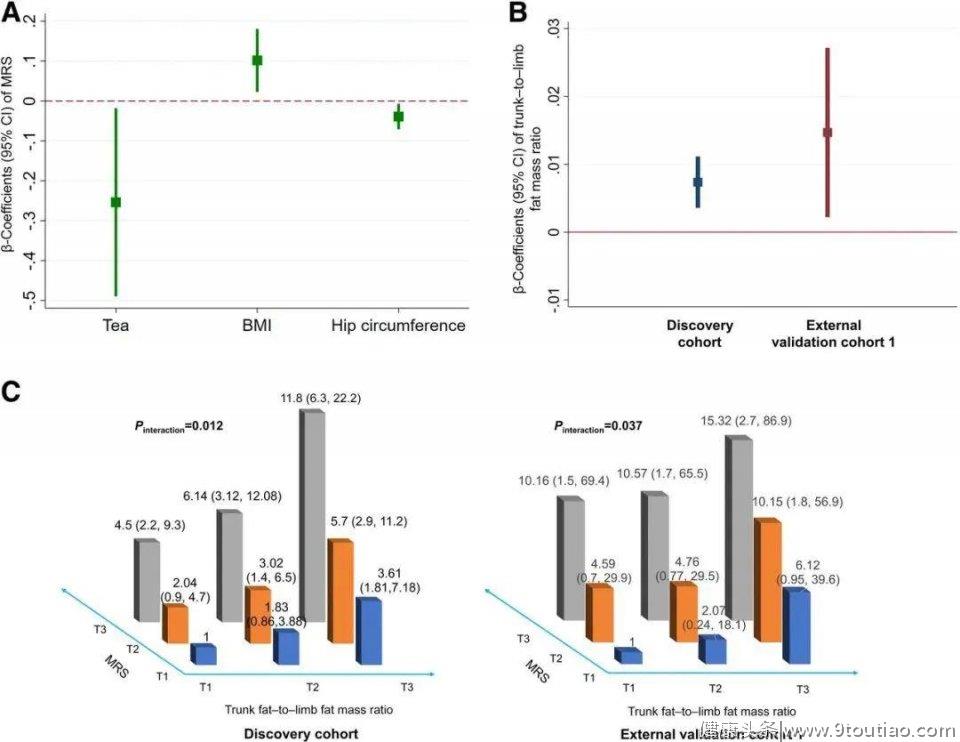 图2.肥胖和饮食因素调节肠道微生物组与2型糖尿病之间的关联
图2.肥胖和饮食因素调节肠道微生物组与2型糖尿病之间的关联6.体型与肠道微生物组相关,调节肠道微生物组与2型糖尿病的关系
肥胖是2型糖尿病最重要的危险因素。BMI和髋围与MRS密切相关,作者假设肠道微生物组与2型糖尿病的关系可能受到肥胖状况的影响。在发现队列(β 0.007, 95% CI 0.0037-0.011)和外部验证队列1 (β 0.015, 95% CI 0.0023-0.03)中,MRS(每1个单位MRS的变化)与躯干-肢体脂肪比的分布呈正相关(P<0.05)。在发现队列(Pinteraction= 0.012)和外部验证队列1 (Pinteraction=0.037)中,作者发现MRS和躯干-肢体脂肪质量比在2型糖尿病风险方面存在显著的交互作用,并对潜在的混杂因素进行了调整。在发现队列中,躯干到肢体的第1、2和3号的2型糖尿病的调整后RR(95%CI)分别为1(reference),1.83(0.86-3.88)和3.61(1.81-7.18)。最低MRS水平的个体之间的脂肪质量比(MRS)。在MRS最高的三分位数中,个人分别为4.5(2.21-9.17),6.14(3.12-12.08)和11.79(6.28-22.16)。在外部验证队列1中发现了相似的交互结果。
四、小结
在本研究中作者将可解释性机器学习框架与队列研究相结合,识别与2型糖尿病相关的人类肠道微生物组特征,评估了鉴定出的微生物与宿主血液代谢产物之间的相关性。构建了具有识别特征的微生物组风险评分(MRS)并评估了MRS与宿主血液代谢产物、2型糖尿病之间的相关性。人体脂肪分布是调节肠道微生物组与2型糖尿病关系的关键因素,揭示了与2型糖尿病风险和未来血糖增加相关的一组肠道微生物组特征。