成人急性髓系白血病诊疗规范(2018年版)
一、概述
白血病(leukemia)是起源于造血干细胞的恶性克隆性疾病,受累细胞(白血病细胞)出现增殖失控、分化障碍、凋亡受阻,大量蓄积于骨髓和其他造血组织,从而抑制骨髓正常造血功能并浸润淋巴结、肝、脾等组织器官。白血病的临床表现主要表现两类,一类是正常造血抑制导致的骨髓衰竭相关的临床表现,如贫血、白细胞减少导致的感染。另一类是白血病细胞浸润组织器官引起的临床表现,如肝脾肿大、绿色瘤等。
白血病的诊断主要是依赖骨髓涂片计数原始细胞比例。白血病的分型早期主要是依赖细胞形态学和细胞化学染色,目前白血病的分型主要是以流式细胞仪为基础的免疫学。遗传学信息主要用于白血病患者的诊断分型和预后判断。
根据白血病细胞的分化程度和自然病程,将白血病分为急性和慢性两大类。急性白血病(acute leukemia,AL)细胞的分化停滞于早期阶段,多为原始细胞和早期幼稚细胞,病情发展迅速,自然病程仅数月。慢性白血病(chronic leukemia,CL)细胞的分化停滞于晚期阶段,多为较成熟细胞或成熟细胞,病情相对缓慢,自然病程可达数年。
根据主要受累的细胞系列可将急性白血病分为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性髓系白血病(acute myeloid leukemia,AML)。慢性白血病则分为慢性髓性白血病,常称为慢性粒细胞白血病(chronic myeloid leukemia,CML)、慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)及少见类型的白血病。目前按照WHO造血系统和淋巴组织肿瘤分类,CLL与小淋巴细胞淋巴瘤为一类疾病,所以CLL的诊疗规范归入淋巴瘤部分。
临床上白血病的分类主要有两大标准,一个是FAB标准,临床重要性逐渐下降,见表1。FAB标准将原始细胞≥30%作为急性白血病的诊断标准,按照细胞形态和细胞化学染色分为AML和ALL,AML分为M0~M7型,ALL分为L1、L2和L3型。由于ALL的FAB分型在临床已经不再使用,这里就不做介绍。
另一诊断分型标准是较新的WHO标准,见表2和表3。WHO将原始细胞≥20%作为急性白血病的诊断标准。将AML和ALL的细胞形态学-免疫学-细胞遗传学-分子生物学特征纳入,形成了MICM分型。WHO(2016)分类方案中对诊断AML时原始细胞计数标准进行了明确,原始细胞百分比是指原始细胞占所有骨髓有核细胞的百分比。



对于本病的治疗按照作用机制大致可以分为几类:①传统化疗,包括蒽环、抗代谢药物及烷化剂等;②诱导分化治疗,以用于急性早幼粒细胞白血病的全反式维甲酸和亚砷酸为代表;③造血干细胞移植;④分子靶向治疗,以用于慢性粒细胞白血病的伊马替尼为代表;⑤免疫治疗,包括用于成熟B淋巴细胞肿瘤治疗的CD20单抗的抗体免疫治疗,还有近年新兴的CART细胞免疫治疗。
二、急性髓系白血病
(一) 临床表现
正常造血功能受抑制表现
1.贫血 少数患者因病程短可无贫血,多数患者就诊时已有贫血。
2.发热 白血病本身可以发热,但发热往往提示有继发感染。
3.出血 主要为皮肤和黏膜出血,也可见消化道、呼吸道、泌尿道、眼底甚至中枢神经系统出血,严重时威胁生命。急性早幼粒细胞白血病(AML-M3,APL)因并发DIC而出现全身广泛性出血。
白血病增殖浸润的表现
1.肝、脾淋巴结肿大:AML较ALL少见。
2.骨骼和关节:急性白血病常有胸骨下段局部压痛和骨关节疼痛。发生骨髓坏死时,可引起骨骼剧痛。
3.粒细胞肉瘤 2%-14% AML患者出现粒细胞肉瘤(granulocytic sarcoma),又称绿色瘤。常累及骨膜,以眼眶部位最常见,可引起眼球突出、复视或失明。
4.口腔和皮肤:常见于急性单核细胞白血病,是由于白血病细胞浸润出现牙龈增生、肿胀,皮肤出现局限性或弥漫性紫色突起硬结或斑块。
5.中枢神经系统白血病(CNSL):AML以t(8;21)/AML、inv(16)/AML、M4和M5多见。临床上轻者表现为头痛、头晕,重者有呕吐、颈项强直,甚至抽搐、昏迷。可能存在视乳头水肿、视网膜出血、颅神经麻痹,常侵及软脑膜,脑实质损伤少见。
(二)实验室检查
1.血常规
血常规可见贫血、血小板减少,白细胞数目可高可低。血涂片分类检查可见数量不等的原始和幼稚细胞。
2.骨髓象
骨髓增生多明显活跃或极度活跃,也可以增生减低。少数甚至骨髓“干抽”,主要见于白血病细胞显著增高,或合并骨髓纤维化的患者,需骨髓活检明确诊断。Auer小体是急性髓系白血病的特征。
3.细胞化学
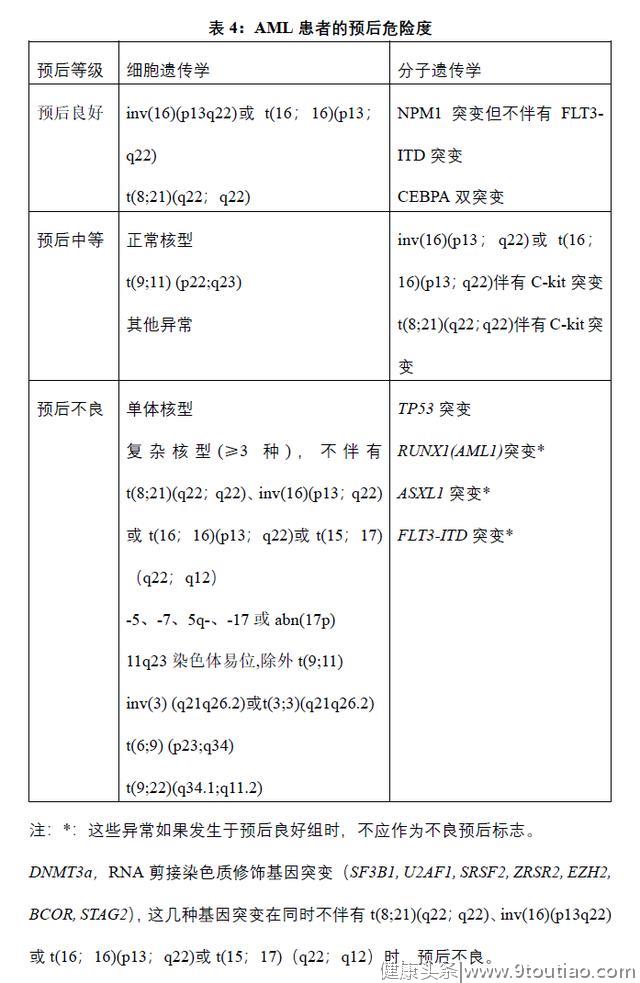
细胞化学染色是形态诊断的重要组成部分。可以用于鉴别AML和ALL,常见反应见表4。近年随着流式细胞免疫表型的广泛开展,逐渐被免疫表型代替。
4.免疫学检查
流式细胞仪的免疫学检查主要用于急性白血病的分型,按照WHO标准对AML和ALL鉴别诊断。
5.染色体核型和分子生物学检查
主要用于检查白血病的遗传学异常,用于诊断分型和预后评估。
6.血液生化改变
血清尿酸浓度增高,特别在化疗期间,尿酸排泄量增加。血清乳酸脱氢酶(LDH)可增高。
7.脑脊液检查
出现CNSL时,脑脊液压力升高,白细胞数增加,蛋白质增多,糖定量减少,涂片中可找到白血病细胞。
(三)鉴别诊断
根据外周血或者骨髓中原始细胞≥20%,诊断白血病一般不难。进一步根据骨髓细胞形态学,尤其是流式免疫表型确定为急性髓系白血病。初诊患者应尽力获得全面的MICM分型资料,以全面评价预后,利于治疗方案的制定。
应注意排除下述疾病
类白血病反应:类白血病反应表现为外周血白细胞增多,血涂片可见中、晚幼粒细胞;骨髓粒系左移,有时原始细胞增多。但类白血病反应多有原发病,血液学异常指标随原发病的好转而恢复。
骨髓增生异常综合征:表现为血细胞减少(尤其是白细胞减少)的AML患者需与骨髓增生异常综合征相鉴别。主要鉴别点在于,骨髓增生异常综合征原始细胞小于20%,一般没有脾、淋巴结肿大及其他浸润症状。
再生障碍性贫血:表现为全血细胞减少,骨髓增生减低的患者需与该病鉴别。该病原始细胞少见,无肝脾肿大。
其他原因引起的白细胞异常:EB病毒感染如传染性单核细胞增多症,百日咳、传染性淋巴细胞增多症、风疹等病毒感染时及幼年特发性关节炎,也可表现为发热、脾淋巴结腺体肿大或全血细胞减少。但此类疾病病程短呈良性经过,骨髓象原始幼稚细胞均不增多。
巨幼细胞性贫血:巨幼细胞性贫血有时可与红白血病混淆。但前者骨髓中原始细胞不增多、幼粒细胞PAS反应常为阴性。
三、急性髓系白血病的治疗
确诊后,应根据患者意愿和疾病特点,进行综合治疗。
(一)支持治疗
1.高白细胞血症的处理:化疗前预处理——AML应用羟基脲或阿糖胞苷降低白细胞水平。外周血白细胞数增高(尤其是>100×109/L)时,患者可产生白细胞淤滞,表现为呼吸困难,甚至呼吸窘迫、反应迟钝、言语不清、颅内出血等。除APL外,可采用白细胞分离术清除过高的白细胞,同时给予化疗药物和水化,并预防高尿酸血症及电解质紊乱,给予血制品积极纠正凝血异常。
2.防治感染:白血病患者常伴有粒细胞减少,应注意口腔、鼻腔及肛周护理。化疗、放疗后,粒细胞缺乏将持续较长时间,可住层流病房。化疗后可使用粒细胞集落刺激因子(G-CSF)促进粒细胞恢复。发热应进行细菌培养和药敏试验,并及时予经验性抗生素治疗。
3.成分输血:严重贫血可吸氧、输浓缩红细胞。血小板计数过低时,需输注单采血小板悬液,维持血小板计数≥10×109/L,合并发热感染时应维持血小板计数≥20×109/L。
4.防治尿酸性肾病:由于白血病细胞大量破坏,特别在化疗时,血清和尿中尿酸浓度增高,积聚在肾小管,引起阻塞而发生尿酸性肾病。应适量输液饮水,碱化尿液,可给予别嘌醇抑制尿酸形成。
5.出凝血障碍的纠正:患者因血小板减少或合并感染,可引起凝血功能紊乱,严重者可并发DIC,尤其是APL。应严密监测出凝血时间、适当补充凝血因子。
(二)联合化疗
1.AML(非APL)的诱导缓解治疗:目前初治成人非APL的AML诱导治疗方案的组成以蒽环类药物联合阿糖胞苷为基础,常用的有去甲氧柔红霉素(IDA)或柔红霉素(DNR)联合阿糖胞苷(Ara-C)组成的IA/DA(3+7)方案,具体剂量需要根据患者的病情决定。同时,随着近年新药的研发,AML的诱导治疗也可以在3+7方案的基础上加用其他药物,如目前美国已经上市的米哚妥林(midostaurin)和靶向CD33的免疫毒素GO单抗。此外,柔红霉素和阿糖胞苷的脂质体混合物CPX351也可以用于AML的诱导治疗。
目前国内2017年AML治疗指南推荐年龄<60岁AML患者诱导缓解治疗方案包括:
标准剂量阿糖胞苷(Ara-C)100~200mg/(m2·d)´7天联合去甲氧柔红霉素(IDA)12mg/m2/d´3天或柔红霉素(DNR)60-90mg/m2/d´3天
含中大剂量Ara-C的诱导治疗方案:
蒽环(包括IDA、DNR等)类药物联合中大剂量Ara-C,AraC用量为1.0~2.0g/m2/q12h´3-5天(第1、3、5天或1-5天)。
含中剂量Ara-C的HAD方案:
高三尖杉酯碱(HHT)2mg/m2/d´7天,DNR40mg/m2/d´3天,Ara-C前4天为100mg/m2/d,第5、6、7天为1-1.5g/m2/q12h。
其他HA+蒽环类药物组成的方案,如HAA(HA+阿克拉霉素)、HAD(HA+DNR)等
2.AML(非APL)缓解后治疗:①高危组,首选异基因造血干细胞移植(Allo-HSCT);②低危组,首选大剂量Ara-C为主的巩固化疗,可以使用大剂量阿糖胞苷3g/m2 Q12h 共6个剂量,3~4个疗程。也可以使用中剂量阿糖胞苷或者标准剂量阿糖胞苷的方案进行巩固治疗。③中危组,HSCT和化疗均可采用。自体HSCT(auto-HSCT)适用于部分中低危组患者。④初诊时白血病细胞高,伴髓外病变,M4/M5,存在t(8;21)或inv(16)、或有颅内出血者,应在CR后作脑脊液检查并鞘内预防性用甲氨蝶呤(MTX)、阿糖胞苷及地塞米松。
通过多色流式细胞术、定量PCR等技术监测患者体内微小残留病(MRD)水平是预警白血病复发的重要方法。巩固治疗后MRD持续高水平或先下降后上升,往往提示复发高风险。对这些患者应考虑造血干细胞移植治疗。
3.老年AML的治疗:老年患者,年龄小于75岁、一般情况好、不具有不良预后因素(不良染色体核型、前期血液病病史、治疗相关性AML),可用标准3+7方案诱导治疗。2017年中国AML指南推荐的首选方案为:标准剂量AraC(100mg/m2/d´7天)联合IDA(8-12mg/m2/d)或DNR 30~60mg/(m2·d)或米托蒽醌 6~8mg/(m2·d)(1~2个疗程)。
年龄≥75岁、一般情况差或具有不良预后因素的患者多采用支持治疗或低强度治疗(如地西他滨或CAG方案等)。2017年中国AML指南推荐的首选方案为:地西他滨[20 mg/(m2·d),5~10天方案];小剂量化疗±G-CSF(如小剂量AraC为基础的方案—CAG、CHG、CMG等,C-阿糖胞苷、A-阿克拉霉素、H-高三尖杉酯碱、M-米托蒽醌);地西他滨联合小剂量化疗等
缓解后可以使用标准剂量的化疗巩固治疗,对于预后良好的患者也可以使用中剂量阿糖胞苷巩固治疗。一般情况可,且有合适供者的患者在缓解后可行降低强度预处理的造血干细胞移植。
(二)APL的治疗
APL根据诊断时白细胞数和血小板计数进行预后分组:低危组—WBC<10×109/L且PLT>40×109/L;中危组—WBC<10×109/L且PLT<40×109/L;高危组—WBC>10×109/L。目前常常把低危组和中危组放在一起作为低危组,治疗策略相同。
由于APL的出血倾向,往往由于出血导致早期死亡。因此,对于疑诊APL的患者,应先按APL治疗(如口服ATRA治疗),待明确诊断后再调整诊疗方案。2018年中国APL诊疗指南的推荐方案如下。
1. 中低危组APL
(1)可采用全反式维甲酸(ATRA)联合砷剂的治疗方案
诱导治疗:ATRA 25 mg/(m2·d)同时联合三氧化二砷[简称亚砷酸,0.16mg/(kg·d)]或复方黄黛片(60 mg/(kg·d),直到完全缓解(CR)。
巩固治疗:ATRA 25 mg/(m2·d)×2周,间歇2周,为1个疗程,共7个疗程。亚砷酸0.16 mg/(kg·d)或者复方黄黛片60 mg/(kg·d)×4周,间歇4周,为1个疗程,共4个疗程。总计约7个月。维持治疗可用,也可不用。
(2)维甲酸+砷剂+化疗的治疗方案
诱导治疗:ATRA 25mg/(m2·d)联合亚砷酸0.16 mg/(kg·d)或复方黄黛片60 mg/(kg·d),直到CR。
巩固治疗(2~3个疗程):可选方案:①HA方案:高三尖杉酯碱(HHT)2 mg/(m2·d),第1~7天;Ara-C 100 mg/(m2·d),第1~5天。②MA方案:米托蒽醌(MIT)6~8 mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。③DA方案:柔红霉素(DNR)40 mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。④IA方案:去甲氧柔红霉素(IDA)8 mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。若第3次巩固化疗后未达到分子学转阴,可加用IDA[8 mg/(m2·d),第1~3天]和Ara-C (1.0 g/m2,每12小时1次,第1~3天)。必须达到分子学转阴后方可开始维持治疗。
维持治疗:每3个月为1个周期,第1个月:ATRA:25 mg/(m2·d)×14 天,间歇14天;第2个月和第3个月:亚砷酸0.16mg/(kg·d)或复方黄黛片60mg/(kg·d)×14 天,间歇14 d。完成8 个周期,维持治疗期总计约2 年。
2.高危组APL
(1)维甲酸+砷剂+化疗诱导治疗继之巩固、维持治疗。
诱导治疗:ATRA25 mg/(m2·d)联合亚砷酸0.16 mg/(kg·d)或复方黄黛片60 mg/(kg·d),直到CR;DNR 45mg/(m2·d)或IDA 8 mg/(m2·d) 第1~3天。
巩固治疗(3个疗程)
可选用以下方案:①HA方案:HHT 2 mg/(m2·d),第1~7天;Ara-C 100mg/(m2·d),第1~5天。②MA方案:MIT 6~8 mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。③DA方案:DNR 45mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。④IA方案:IDA 8 mg/(m2·d),第1~3天;Ara-C 100 mg/(m2·d),第1~5天。若第3次巩固化疗后未达到分子学转阴,可加用IDA[8mg/(m2·d),第1~3天]和Ara-C(1.0 g/m2,每12小时 1次,第1~3天)。必须达到分子学转阴后方可开始维持治疗。
维持治疗:每3个月为1个周期,第1个月:ATRA:25 mg/(m2·d)×14 天,间歇14 天;第2个月和第3个月:亚砷酸0.16 mg/(kg·d)或复方黄黛片60 mg/(kg·d)×14天,间歇14 天。完成8个周期,维持治疗期总计约2年。
(2)维甲酸+砷剂+诱导、巩固、维持治疗。
诱导治疗:ATRA 25 mg/(m2·d),第1~36天;亚砷酸0.16 mg/(kg·d),第9~36天;IDA 6~12 mg/(m2·d),静脉注射,第2、4、6、8 天。
巩固治疗(2个疗程):① ATRA 25 mg/(m2·d),第1~28天 +亚砷酸0.16mg/(kg·d),第1~28天;②ATRA 25 mg/(m2·d), 第1~7、15~21、29~35 天+亚砷酸0.16mg/(kg·d),第1~5、8~12、15~19、22~26、29~33天。
维持治疗(2年):每3个月为1个周期: ATRA:25 mg/(m2·d),第1~14天;6-MP 50~90 mg/(m2·d),第15~90天;MTX 5~15 mg/m2,每周1次,共11次。共8个周期,维持治疗期总计约2年余。
建议采用定量PCR监测骨髓PML-RARα转录本水平,治疗期间建议2~3个月进行1次分子学反应评估,持续监测2年。上述融合基因持续阴性者继续维持治疗,融合基因阳性者4 周内复查。复查阴性者继续维持治疗,确实阳性者按复发处理。流式细胞术因对于APL的MRD敏感性显著小于定量PCR,因此不建议单纯采用流式细胞术对APL进行MRD监测。
在APL诱导治疗过程中,为了减少出血的风险,应维持PLT>30~50×109/L,纤维蛋白原1.5g/L。另外需警惕出现诱导分化综合征:主要表现为不明原因发热、呼吸困难、胸腔或心包积液、肺部浸润、肾脏衰竭、低血压、体重增加5 kg,符合2~3个者属于轻度分化综合征,符合4个或更多个者属于重度分化综合征。分化综合征的发生通常发生于初诊或复发患者,WBC>10×109/L并持续增长者,应考虑停用ATRA或亚砷酸,或者减量,并密切关注体液容量负荷和肺功能状态,尽早使用地塞米松(10 mg,静脉注射,每日2 次)直至低氧血症解除。
低中危APL患者,ATRA联合砷剂作为一线治疗方案中建议预防性鞘内治疗;高危APL或复发患者,因发生CNSL的风险增加,对这些患者应进行至少2~6次预防性鞘内治疗。对于已诊断CNSL患者,按照CNSL常规鞘内方案执行。
5.复发、难治性AML的治疗:复发、难治性AML(非APL)患者仍缺乏有效的治疗方式。对于CR1期时间大于12个月的患者,可以使用初次诱导方案治疗。CR1期小于12个月的患者,需要尝试其他的治疗方案。可以尝试新的靶向治疗药物,如表观遗传学调控药物地西他滨、国外已经上市的IDH2抑制剂enasidenib,CD33的免疫毒素GO单抗等。也可选择FLAG等化疗方案。异基因HSCT(allo-HSCT)是唯一可能获得长期缓解的治疗措施,移植前通过挽救方案获得缓解有利于提高移植疗效。对于allo-HSCT 后复发患者可尝试供体淋巴细胞输注(DLI)、二次移植等。
APL复发患者一般采用亚砷酸±ATRA±蒽环类化疗进行再次诱导治疗。诱导缓解后必须进行鞘内注射,预防中枢神经系统白血病(CNSL)。达再次缓解(细胞形态学)者进行PML-RARα融合基因检测,融合基因阴性者可以行自体造血干细胞移植或亚砷酸巩固治疗(不适合移植者)6个疗程,融合基因阳性者进入临床研究或行异基因造血干细胞移植。再诱导未缓解者可加入临床研究或行异基因造血干细胞移植。
来源:国家卫生健康委员会官网