治疗复发/难治慢性淋巴细胞白血病及淋巴瘤疗效显著
编译:Alina HMU来源:肿瘤资讯
Umbralisib (TGR-1202)是第二代PI3Kδ抑制剂,在选择性抑制PI3Kδ的同时也能特异性抑制Casein激酶-1ε(CK1ε)。本研究为Umbralisib首次用于人体的Ⅰ期剂量爬升研究,旨在评价Umbralisib用于血液系统恶性疾病患者的安全性及有效性。结果显示,客观反应率可达37%,部分缓解率33%。该研究初步证明,Umbralisib在复发/难治血液系统恶性肿瘤中有一定疗效且耐受性良好,尤其在慢性淋巴细胞白血病(CLL)及滤泡淋巴瘤(FL)中显示出优异的有效性。
研究背景
I类PI3Ks是一类膜为基础的酶家族,包含一个由α、β、γ和δ四种同种型组成的p110级联亚单位,能够级联激活信号调节细胞增殖、分化和生存。PI3Kα和PI3Kβ同种型广泛表达,而PI3Kγ和PI3Kδ主要限制性的表达于造血干细胞。在B细胞发育过程和功能中PI3Kδ起到重要作用,并且在B细胞恶性疾病中PI3Kδ经常过度激活,提示PI3Kδ可能成为这些疾病的有效治疗靶点。尽管第I类PI3Kδ抑制剂Idelalisib在慢性淋巴细胞白血(CLL)和惰性B细胞非霍奇金淋巴瘤(NHL)中显示出了显著疗效,但它与严重的免疫介导的副反应相关,包括肝毒性、机会性感染、腹泻和结肠炎。由于早期研发的PI3Kδ抑制剂缺乏特异性、多重脱靶效应或药理学特点导致其耐受性不佳。
Umbralisib (TGR-1202)是一种新型、第二代PI3Kδ抑制剂,具有嵌合结构的Casein激酶1ε(CK1ε),其大体结构与Idelalisib及Duvelisib不同。Umbralisib是高度选择性的PI3Kδ抑制剂,限制性抑制细胞色素P450的同时,可以在每日一次的剂量时保证血浆药物水平。目前已有的研究结果提示,在淋巴瘤中,Umbralisib是更具有选择性的PI3Kδ和CK1ε抑制剂,可能产生与Idelalisib和Duvelisib相当或更强的有效性以及更强的安全性。该研究首次报道了Umbralisib应用于人体的I期临床研究,评价Umbralisib在血液系统恶性集中的安全性、最大耐受剂量、药代动力学和临床有效性。
研究设计
该研究为一项开放标签、I期、剂量测评研究。入组患者来自美国7家临床中心,年龄18岁以上、复发/难治慢性淋巴细胞白血病(CLL)或小细胞淋巴瘤(SLL)、B细胞或T细胞非霍奇金淋巴瘤(NHL),之前接受过一线或多线治疗,疾病可以评价和测量,且器官功能尚可。
患者每日自行口服Umbralisib片剂,28天一个周期,应用传统的剂量测评3+3设计来评价安全性并确定最大耐受剂量。在最初的患者列队中,患者在未进食状态下口服Umbralisib,起始剂量50mg,逐步增加到100、200、400、800、1200和1800mg,直到达到最大耐受剂量或者最大剂量群体已完成治疗而没有剂量限制性毒性发生。随后,入组列队在进食状态下自行口服微粒形式的Umbralisib,以200mg为起始剂量,定量增加剂量到400、800、1200和1800mg,直到达到最大耐受剂量或达到最大剂量水平。至2014年8月,所有在组患者均转换成800mg微粒形式并停止最初服药模式。
主要研究终点为研究者评价所有接受治疗患者(安全患者群体中)的安全性最大耐受剂量,以及Umbralisib的药代动力学特点。次要终点为抗肿瘤活性的首次评价,包括客观反应率和反应持续时间。随访持续到患者首次未连续治疗.
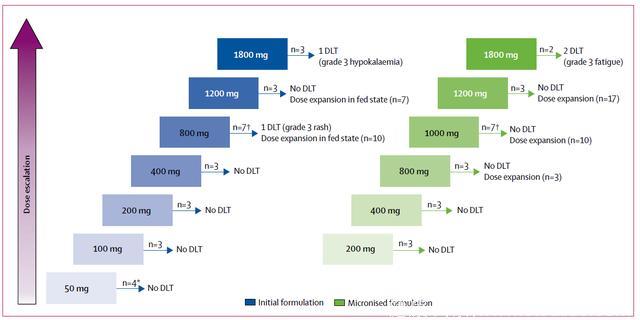
图1 研究设计. 蓝色框内为未进食状态下患者初始形式的剂量爬坡。绿色框内显示进食状态下服用微粒化制剂患者的剂量爬坡。
研究结果
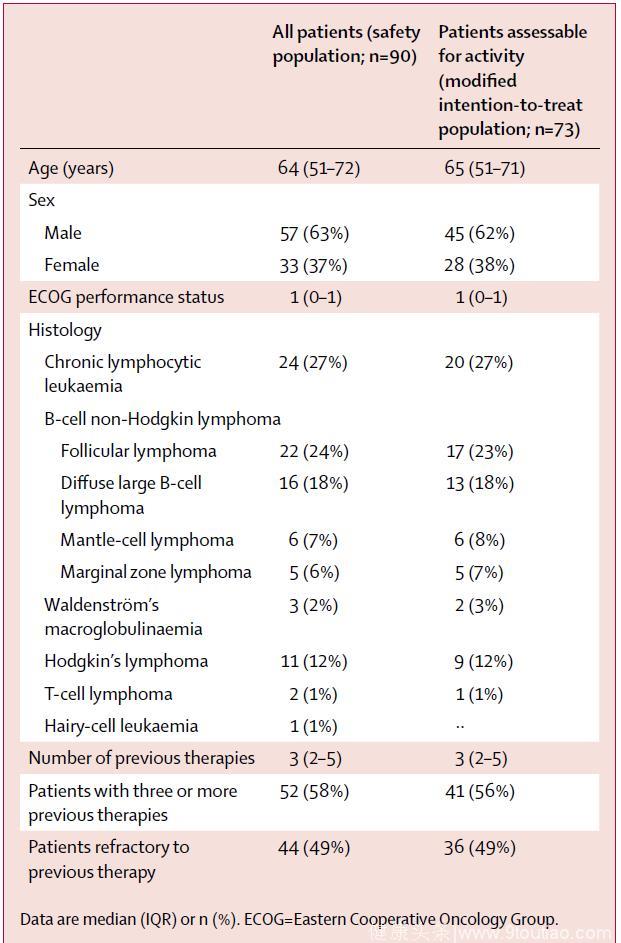
从2013年1月17日至2016年1月14日,该研究共入组90例患者,并予以Umbralisib治疗,包括24例CLL(27%)、49例B-NHL(54%)、11例HL(12%)和6例(7%)其他血液系统恶性疾病(表1)。数据截至2016年11月15日,44例患者(49%)接受Umbralisib治疗超过6周期(168天),23例患者(26%)接受Umbralisib治疗超过12周期(336天)。中位持续治疗时间和中位随访时间分别为4.7个周期(IQR 2·0–14·0)和133天(IQR 55–335),平均接受9.6个周期治疗(SD 11.2)。
表1 患者基线特点
最常见的治疗相关副作用为腹泻39例(43%)、恶心38例(42%)和疲乏28例(31%),大多数为1-2级不良反应。最常见的3-4级不良反应为中性粒细胞减少12例(13%),贫血8例(9%)和血小板减少6例(7%)。所有的3-4级治疗相关副作用和死亡发生率低于10%。7例患者发生Umbralisib导致的或与Umbralisib相关的严重不良反应:包括3例肺炎(3%),1例肺感染(1%),1例发热性肺炎(1%)和2例结肠炎(2%),其中一例合并发热性肺炎。微粒形式最大耐受剂量是1200mg,其中800mg是在第二阶段试验中推荐应用的。两例结肠炎均发生在推荐2阶段剂量中。
大多数接受Umbralisib治疗的患者显示出临床有效性。在90例入组患者中,56例(62%)CT检查显示肿瘤负担降低,33例(37%)达到客观反应,30例(33%)部分缓解。在20例复发/难治CLL中,17例(85%)达到客观反应。1例FL患者中9例(53%)达到客观缓解,包括2例(12%)完全缓解和7例部分缓解。13例弥漫大B细胞淋巴瘤中4例(31%)客观缓解,2例(15%)疾病稳定。
研究结束后,无进展生存率(PFS)亚组分析的结果显示,20例CLL患者的中位PFS为24.0个月(95% CI.7.4个月-未达),24例惰性NHL患者为16个月(9.2个月-未达)。未出现时间相关毒性的趋势。
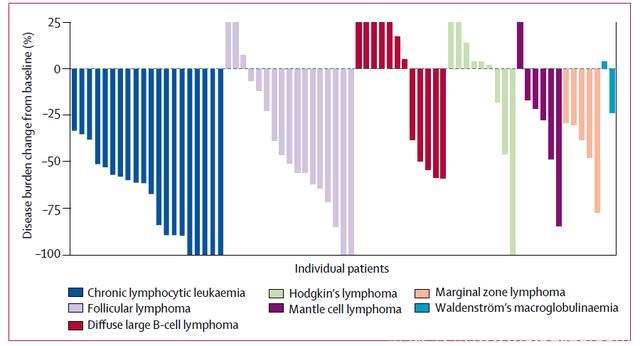
图2 Umbralisib治疗后疾病负荷改变百分比
结论
由于早期研发的PI3Kδ抑制剂特异性缺乏、易出现多重脱靶效应的药理学特点,其耐受性不佳。Umbralisib (TGR-1202)是第二代PI3Kδ抑制剂选择性显著提升,在选择性抑制PI3Kδ的同时还能够特异性抑制蛋白翻译调节因子——Casein激酶-1ε(CK1ε)。该研究显示,Umbralisib耐受性良好,且在复发/难治血液系统恶性肿瘤中初步显示有效。Umbralisib安全性特点为较少发生自身免疫样毒性(如结肠炎),有别于其他PI3K抑制剂。Umbralisib的安全性、活性和药代动力学特点支持其单药应用或联合其他新的靶向药物应用于血液系统恶性疾病中。
参考文献
Umbralisib, a novel PI3Kδ and casein kinase-1ε inhibitor, in relapsed or refractory chronic lymphocytic leukaemia and lymphoma: an open-label, phase 1, dose-escalation, first-in-human study. Lancet Oncol. 2018 Apr;19(4):486-496. doi: 10.1016/S1470-2045(18)30082-2.
责任编辑:肿瘤资讯-Amiee 版权声明版权属肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!