药审中心去年优先审评423件药品,过半为临床新药和儿童药
3月22日,国家食药监总局官网发布《2017年度药品审评报告》,披露了过去一年总局药品注册申请审评审批完成情况和注册申请受理情况。
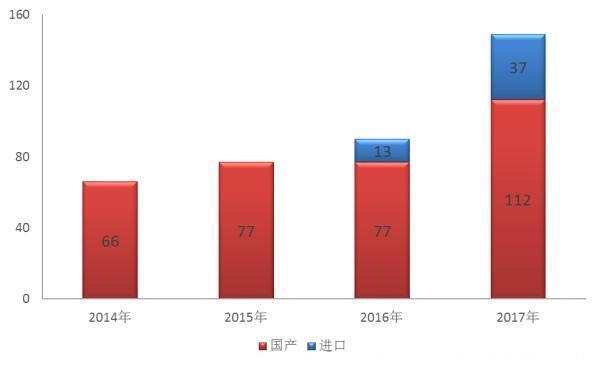
2014年-2017年化药创新药注册申请接收情况(以品种计) 来源:《2017年度药品审评报告》截至2017年底,药审中心共将25批423件注册申请纳入优先审评程序,其中具有明显临床价值的新药占比最大,共191件,占45%,儿童用药共47件。二者合计占比过半。
截至2017年底,纳入优先审评程序的423件注册申请中已有272件完成审评,占比为64%。
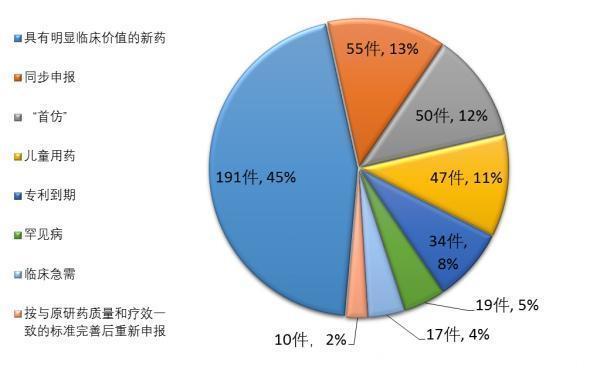
纳入优先审评程序的注册申请情况 来源:《2017年度药品审评报告》根据食药监总局此前颁发的《关于鼓励药品创新实行优先审评审批的意见》,纳入优先审评的药品需满足具有明显临床价值,或者防治艾滋病、肺结核、病毒性肝炎、罕见病、恶性肿瘤、儿童用药品、老年人特有和多发的疾病且具有明显临床优势等条件。
报告还显示,去年共有50种具有明显临床价值的药品通过优先审评程序得以加快、优先批准上市,包括国产自主研发的创新药重组埃博拉病毒病疫苗、口服丙肝治疗用新药阿舒瑞韦软胶囊、非小细胞肺癌靶向药甲磺酸奥希替尼片、儿童抗癫痫用药左乙拉西坦注射用浓溶液、治疗乙肝和艾滋病的国产仿制药富马酸替诺福韦二吡呋酯胶囊等。