为结直肠癌高危人群提供预防新策略!Nature三篇齐发
撰文 | 柠檬树
责编 | Qi
#结直肠癌#
约80%的结肠癌(colorectal cancer, CRC)患者中存在抑癌基因Apc突变。Apc突变促进了增殖,抑制了细胞死亡,同时阻断了肠道内的分化,可能会有助于提高细胞的相对适应度【1, 2】。现有的研究显示,肠道干细胞中Apc的突变会通过引导β-catenin的磷酸化和降解,负调控WNT信号转导【3】,从而不受控制的打破了WNT激动剂和拮抗剂间的平衡【4, 5】,这一现象往往会诱发早期的结直肠癌。
迄今为止,由于直接靶向WNT信号存在困难,这些研究尚未促进更有效的治疗方法或新的CRC预防策略的产生。但Apc缺失型细胞与野生型细胞竞争的分子机制,在推动发现新的化学方法来抑制结直肠癌形成方面具有巨大的潜力。

2021年6月2日,Nature杂志背靠背刊发了三项分别来自于英国比森癌症研究所的Owen J. Sansom团队联合芬兰赫尔辛基大学Pekka Katajisto团队、英国剑桥大学Benjamin D. Simons团队联合英国剑桥大学Bon-Kyoung Koo团队以及荷兰阿姆斯特丹大学医学中心Louis Vermeulen团队的工作,探讨了肠道干细胞通过抑制Apc突变,恢复野生型细胞的竞争力,从而提高正常细胞的健康程度,限制癌前克隆的增殖扩张,为结直肠癌高危人群提供预防策略。



在第一项题为“NOTUM from Apc-mutant cells biases clonal competition to initiate cancer”的研究中,作者发现NOTUM基因是Apc突变早期阶段的一个关键中介。NOTUM可以通过去除WNT上棕榈酸酯修饰的羧酸酯酶或者抑制WNT与其受体结合,使WNT通路丧失功能。作者通过体外实验和小鼠体内试验发现NOTUM优先抑制野生型细胞而非Apc突变细胞的生长,作为Apc突变型细胞调控WNT信号的关键旁分泌负因子,可以抑制野生型肠道干细胞的功能(图1)。与此同时,NOTUM是驱动Apc突变克隆固定的主要介质,是肿瘤形成所必需的,可以定位为Apc驱动下肠道肿瘤的治疗靶点。现有的研究表明,根据WNT靶基因的表达,人类结直肠癌可以分为配体依赖(RSPO-fusion / RNF43-mutant)和配体不依赖(APC-mutant)亚型,激活WNT信号通路的不同突变方式(APC vs RSPO或RNF43)将通过相应分子机制来实现突变克隆固定,配体依赖的结直肠癌不受NOTUM调控。
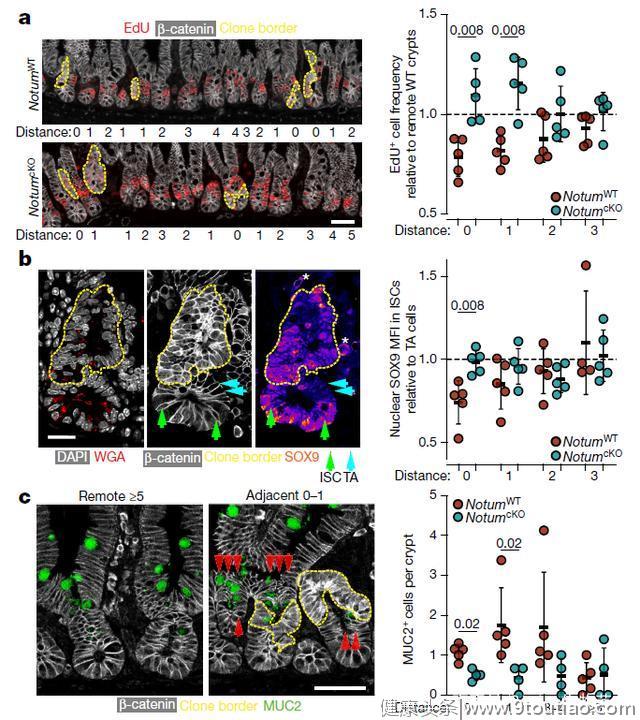 图1. NOTUM 抑制细胞增殖并促进野生型肠道干细胞的分化
图1. NOTUM 抑制细胞增殖并促进野生型肠道干细胞的分化在第二项题为“Tracing oncogene-driven remodelling of the intestinal stem cell niche”的研究中,作者在小肠中构建了一种允许对同一组织中的突变型和野生型细胞进行差异追踪的,癌基因相关的多色报告小鼠模型——Red2Onco系统(图2)。肿瘤免疫微环境与结直肠癌的早期的形成是息息相关的。基于Red2Onco系统,研究结合单细胞分析发现KRAS与PI3K等癌基因突变或者Apc缺失驱动的旁分泌重构创建了生态位环境,促进了致癌克隆,改变了WNT信号的功能,从而更容易诱发结直肠癌。总之,生态位重构可能是致瘤突变体的常见特征。
 图2. Red2Onco系统——癌基因相关多色报告
图2. Red2Onco系统——癌基因相关多色报告在第三项题为“Apc-mutant cells act as supercompetitors in intestinal tumour initiation”的研究中,作者首先通过类器官和小鼠体内试验,发现Apc突变型表现出超级竞争者的特性,会积极抑制邻近细胞的生长甚至诱导野生型肠道干细胞凋亡。其次,作者在果蝇体内检测到Apc突变细胞通过分泌多种WNT拮抗剂诱导野生型肠道干细胞的分化。Notum作为WNT拮抗剂被发现是果蝇翅膀成虫盘细胞竞争的主要驱动因子。与此同时,作者证实了在小肠隐窝的上皮性颗粒状细胞中药理抑制NOTUM能使衰老肠道中的干细胞功能增强,恢复活力。最后,作者在Apc突变的人类细胞中检测到了WNT拮抗剂NOTUM、DKK1、SFRP5和WIF1的过表达(图3)。总之,针对WNT通路配体受体水平的药理激活的方法虽然不能抑制肿瘤的生长,但可以预防肿瘤的发生。
综上所述,以上三项研究一致表明Apc突变可能作为超级竞争者,抑制野生型的活性,同时调控WNT通路激动剂和拮抗剂的平衡,诱发早期肠道癌症的形成。识别和抑制产生超级竞争表型的恶性前克隆信号,可能是预防癌症发生的新策略。

原文链接:
参考文献
1. Morin, P. J., Vogelstein, B. & Kinzler, K. W. Apoptosis and APC in colorectal tumorigenesis. Proc. Natl Acad. Sci. USA 93, 7950–7954 (1996).
2. Fevr, T., Robine, S., Louvard, D. & Huelsken, J. WNT/β-catenin is essential for intestinal homeostasis and maintenance of intestinal stem cells. Mol. Cell. Biol. 27, 7551–7559 (2007).
3. Morin, P. J. et al. Activation of β-catenin–Tcf signaling in colon cancer by mutations in β-catenin or APC. Science 275, 1787–1790 (1997).
4. Powell, S. M. et al. APC mutations occur early during colorectal tumorigenesis. Nature 359, 235–237 (1992)
5. Fearon, E. R. & Vogelstein, B. A genetic model for colorectal tumorigenesis. Cell 61, 759–767 (1990).