拿下全球首款靶向CD19的ADC药物,ADC Therape
作者:贝壳社
继FDA加速批准靶向CD19的CAR-T疗法Monjuvi后,CD19又有新动态。
近日,FDA加速批准ADC Therapeutics(ADCT)靶向CD19抗体偶联药物Zynlonta(Loncastuximab tesirine-lpyl)上市,可作为单药用于经两种或两种以上全身疗法后复发或难治性(r/r)弥漫大B细胞淋巴瘤(简称r/r DLBCL),成为全球首款获批靶向CD19的ADC药物。
值得一提的是,Monjuvi与Zynlonta都可用于r/r DLBCL成人患者治疗,其中Monjuvi需联合来那度胺使用,是第一个获FDA批准用于一线治疗期间或治疗后病情进展的r/r DLBCL成人患者的二线疗法。
01、Zynlonta成功获批上市,且在国内进入临床据悉,此次获批是基于一项LOTIS-2的单臂2期临床试验结果,数据显示,在接受Zynlonta治疗的145名r/r DLBCL患者中,患者总缓解率ORR为48.3%,其中完全缓解率CR为24.1%;中位缓解持续时间可达12.58个月,而获得完全缓和的患者亚群的中位缓解持续时间达到13.37个月。
最常见的不良反应(≥20%)为血小板减少、γ-谷氨酰转移酶升高、中性粒细胞减少、贫血、高血糖、转氨酶升高、疲劳、低白蛋白血症、皮疹、水肿、恶心和肌肉骨骼疼痛。在LOTIS-2中,最常见的(≥10%)3级以上治疗引起的不良事件为中性粒细胞减少症(26.2%)、血小板减少症(17.9%)、γ-谷氨酰转移酶升高(17.2%)和贫血(10.3%)。
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤类型,是一种进展迅速的侵袭性疾病且具有多种亚型。超过40%的一线DLBCL疗法会失效,且预后往往不良。
Zynlonta 是与吡咯并苯并二氮(PBD)二聚体细胞毒素偶联的人源化靶向CD19的ADC药物, 当PBD二聚体进入细胞之后与DNA特异性结合,形成有效的细胞毒性DNA链间交联从而阻断细胞分裂并杀死癌细胞。其中,CD19是B细胞表面表达的特异性抗原,是多种CAR-T疗法的靶点。
值得一提的是,瓴路药业通过与ADCT成立合资公司Overland ADCT BioPharma,获得在大中华区和新加坡开发并推广Zynlonta的独家权益。今年3月,ADCT与瓴路药业联合申报的注射用Loncastuximab Tesirine项目已经获批临床,拟联合伊布替尼治疗经标准治疗失败或不耐受标准治疗的晚期r/r DLBCL或经一线标准治疗后复发或难治性套细胞淋巴瘤。

截图自CDE
此外,ADCT也计划开展多项临床试验,进一步探索Zynlonta与伊布替尼联用治疗套细胞淋巴瘤(MCL)、DLBCL以及单药治疗滤泡型淋巴瘤(FL)的潜力。
02、其他5款ADC在研产品ADCT创立于2011年,是一家专注于临床阶段肿瘤学的生物技术公司,其ADC产品由靶向特定抗原的单克隆抗体和PBD二聚体技术偶联而成。目前,ADCT正在使用最新一代的PBD二聚体技术开发系列抗癌新药,与临床前研究中的第一代PBD相比最新一代的PBD具有更高的治疗指数,可以主动杀死癌细胞。
ADCT官网显示,除了Zynlonta,其管线还包括Camidanlumab tesirine(Cami)、ADCT-602、ADCT-601、ADCT-901及ADCT-701产品,并正在进行多项针对血液疾病和实体瘤适应症的临床试验。其中,Cami是目前进度最快的一款产品。
01、Cami靶向CD25Cami以CD25为靶点,通过与PBD二聚体细胞毒素结合进入细胞后杀伤癌细胞。此外,Cami能在局部肿瘤环境中消耗CD25阳性的调节性T细胞(Tregs),从而增强对肿瘤细胞的免疫反应,引发免疫原性细胞死亡。
2020年12月,ADCT在ASH年会上公布Cami用于复发或难治性HL患者的关键性2期临床最新数据。结果显示,Cami单药治疗复发或难治性HL患者,ORR为83%,CRR为38.3%。
此外,Cami联合pembrolizumab用于实体瘤1b期试验的药代动力学和生物标志物数据已在2020年ESMO上公布,临床前数据也发表在Journal for ImmunoTherapy of Cancer上。
02、ADCT-602靶向CD22ADCT-602是一种针对CD22单克隆抗体组成的ADC,通过与PBD二聚体细胞毒素结合发挥作用。一旦与表达CD22的细胞结合,ADCT-602被内化到细胞中,从而杀伤细胞。其中,CD22是临床验证的ADC靶点,在大多数恶性B细胞上高度表达,包括在90%以上的B细胞急性淋巴细胞白血病(ALL)。
目前,ADCT-602正在被用于复发性或难治性B细胞患者的I/II期临床试验(NCT03698552)。
03、ADCT-601靶向AXLADCT-601是一种针对AXL人源化单克隆抗体组成的ADC,通过与PBD二聚体细胞毒素结合发挥作用。一旦与表达AXL的细胞结合,ADCT-601就被内化到细胞中,从而杀伤癌细胞。研究发现,AXL在许多实体肿瘤(如肺癌、乳腺癌、前列腺癌、胰腺癌、胶质瘤和食管癌)、血液恶性肿瘤(如急性和慢性髓细胞白血病)中高度表达。因此AXL可作为ADC肿瘤新药研发的理想靶点。
目前,ADCT-601正在被用于选定的晚期实体瘤患者的评估试验(NCT03700294)。
04、ADCT-901靶向KAAG1ADCT-901是一种针对人KAAG1的人源化单克隆抗体(3A4)组成的ADC,通过组织蛋白酶与PBD二聚体细胞毒素结合。KAAG1是一个细胞内靶点,但是可暴露在肿瘤细胞膜上,KAAG1在卵巢癌和三阴性乳腺癌中高度表达,而在健康组织中表达却非常有限,可成为ADC肿瘤新药研发的新型靶点。
目前,ADCT-901正在被开发用于治疗晚期实体肿瘤,包括耐铂卵巢癌和三阴性乳腺癌。
05、ADCT-701靶向DLK-1ADCT-701是一种针对DLK-1的人源化单克隆抗体(HuBa-1-3D)组成的ADC,并通过组织蛋白酶与PBD二聚体细胞毒素结合。DLK-1在胎儿发育过程中广泛表达,但在成人中的表达受到高度限制。研究表明DLK-1可在成人神经母细胞瘤、肝癌(HCC)、小细胞肺癌(SCLC)和急性髓细胞白血病(AML)中表达,是ADC肿瘤新药研发的新型靶点。
目前,ADCT-701正在被开发用于治疗晚期实体瘤、神经母细胞瘤、HCC和SCLC。
虽然ADCT目前拥有众多在研产品,但大多属于全新靶点,且均处于临床或临床前研究阶段,存在较大的研发风险。因此,ADCT的前景并不乐观。
03、Zynlonta上市能改变ADCT亏损的局面吗?
今年3月,ADCT公布其2020第四季度及全年财务业绩。截至2020年12月31日,其第四季度研发支出为4860万美元,全年为1.42亿美元,而2019年同期和全年的支出分别为3040万美元和1.075亿美元。
此外,2020年第四季度,为推进Zynlonta上市计划,共产生营销支出940万美元,全年为2210万美元。而2019年之前未存在类似支出。2020年公司上市,由于股份薪酬支出和上市公司成本的增加,一般和行政费用从2019年的1420万美元增长至5510万美元。
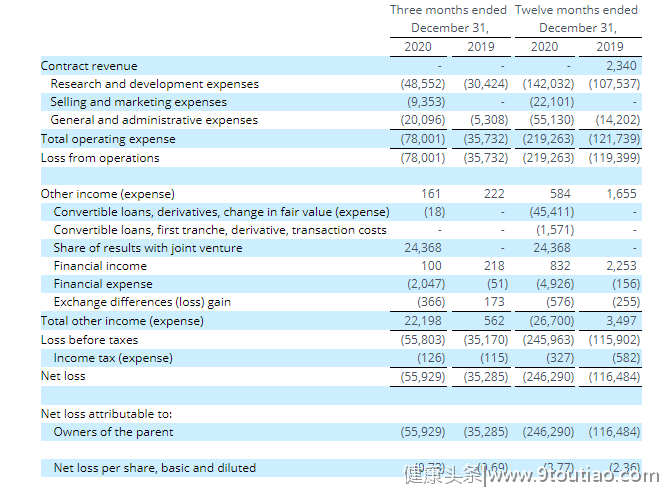
截图自ADCT官网
因此,2020年全年净亏损为2.463亿美元。
结合ADCT之前发布的公告,其2017年全年净亏损8990万美元,2018年全年净亏损为1.231亿美元,2019年全年净亏损为1.165亿美元。近4年累计亏损5.758亿美元(约37.35亿元)。
值得一提的是,2020年5月,ADCT在纽约证券交易所完成2.676亿美元的首次公开募股。而在此之前,ADCT曾因市场情况不明在上市前夕撤销在纳斯达克上市的申请。
现如今,随着产品陆续进入临床试验阶段,以及继续扩大Zynlonta在早期治疗和多种适应症方面的潜在市场机会,预计ADCT在研发和市场化的投入将进一步增加。
此外,Zynlonta上市后也面临着比较激烈的竞争。仅2020年FDA就批准多款针对r/r DLBCL的疗法,主要包含:一、Xpovio(selinexor),用于治疗接受过至少两种系统疗法的r/r DLBCL成人患者,包括滤泡性淋巴瘤(FL)引起的DLBCL。Xpovio是目前用于治疗r/r DLBCL的唯一一种单药口服疗法,也是首个且唯一一个获FDA批准可同时用于骨髓瘤和DLBCL的药物;二、Monjuvi,可联合来那度胺(lenalidomide),用于治疗不适合自体干细胞移植(ASCT)的r/r DLBCL成人患者,包括源于低级别淋巴瘤的DLBCL;三、Pola,可联合BR(苯达莫司汀、利妥昔单抗)用于治疗不适合移植的r/r DLBCL患者。
与Xpovio、Monjuvi相比,Zynlonta目前治疗范围相对单一,竞争压力较大,而对ADCT来说,单靠Zynlonta短期内恐怕无法改变其当下亏损的现状。不过此次Zynlonta获批上市,也意味着ADCT在商业化布局上迈出成功的第一步,后续发展如何,还需拭目以待。
有关ADCT的最新动态,贝壳社将继续保持关注。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])